
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 13 章 p 区元素(一) Chapter 13 p Block (1) 教学要求 1.了解 p 区元素的特点; 2.了解 p 区元素的存在、制备及用途; 3.掌握重点元素硼、铝、碳、硅、氮和磷的单质及其化合物的性质,会用结构理论和 热力学解释它们的某些化学现象; 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解一些无机材料的制备和用途; 6.了解惰性电子对效应概念及其应用。 课时分配(9 学时) 1. 概述:(1 学时) 2. 天然资源、单质的提取和用途:(1 学时) 3. 硼的单质和化合物:(1 学时) 4. 金属铝及其化合物:(1 学时) 5. 碳的单质及其化合物:(1 学时) 6. 硅及其化合物:(1 学时) 7. 氮及其化合物:(1 学时) 8. 磷及其化合物:(1 学时) 9. 长周期元素和惰性电子对效应:(1 学时)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 13 章 p 区元素(一) Chapter 13 p Block (1) 教学要求 1.了解 p 区元素的特点; 2.了解 p 区元素的存在、制备及用途; 3.掌握重点元素硼、铝、碳、硅、氮和磷的单质及其化合物的性质,会用结构理论和 热力学解释它们的某些化学现象; 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解一些无机材料的制备和用途; 6.了解惰性电子对效应概念及其应用。 课时分配(9 学时) 1. 概述:(1 学时) 2. 天然资源、单质的提取和用途:(1 学时) 3. 硼的单质和化合物:(1 学时) 4. 金属铝及其化合物:(1 学时) 5. 碳的单质及其化合物:(1 学时) 6. 硅及其化合物:(1 学时) 7. 氮及其化合物:(1 学时) 8. 磷及其化合物:(1 学时) 9. 长周期元素和惰性电子对效应:(1 学时)

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 p 区包括第13 至第 18 共六族元素, 加上新近合成的 114 号、116 号和 118 号在内, 元素总 数共 34 种。该区的 12 个短周期元素(硼、碳、氮、氧、氟、氖和铝、硅、磷、硫、氯、氩)与 s 区的 4 个短周期元素(锂、铍、钠、镁)一起被叫作为典型元素; 包括尚未发现的 3 个元素(Z=113, 115, 117)在内的 24 个长周期元素又叫过渡后元素. p区元素价电子组态为ns 2 np 1~6. 最高氧化态为+3至+8,不再与IUPAC推荐的族序号相一致。 ● 唯一同时包括金属和非金属元素的一个区 ● 包括 “不活泼的单原子气体—稀有气体” ● 无机非金属材料库:C—C复合材料,人造金刚石,半导体硅,分子筛(铝硅酸盐), 高能燃料(N2H4) ● 有毒的小元素群 ● 多有同素异形体 ● 成键的多样性:如乙硼烷的 3c2e 键等 13.1 第 13、第 14 和第 15 族概述 本节介绍硼族、碳族和氮族元素的重要物理和化学特征。 Some properties of group 13 to group 15 elements Element First ionization energy I1/kJ·mol-1 Electronegativity a χ Covalent radius rcov/pm Ionic radius rion/pm Oxidation state b B Al Ga In Tl C Si Ge Sn Pb N P As Sb Bi 899 578 579 558 589 1086 786 760 708 715 1410 1020 953 840 710 2.04 1.61 1.84 1.78 2.04 2.55 1.90 2.01 1.96 2.33 3.04 2.06 2.18 2.05 2.02 85 143 153 167 171 77 117 122 140 175 75 110 122 143 152 - 54 62 80 89 - 40 53 69 92 - - - - - +3 +3 +3, +1 +3, +1 +3, +1 (+4, +2)c +4 +4, +2 +4, +2 +4, +2 +5, +4, +3, +2, +1, -3 +5, +3, -3 +5, +3 +5, +3 +5, +3 a in Pauling scale. b Oxidation numbers in bold type indicate the most stable state(s). c for inorganic compounds of carbon. 周期表中即包括非金属元素又包括金属元素的族只有硼族、碳族和氮族。 ★ 金属性:总的变化规律是由上而下逐渐增强 P区元素的化学以其多样性为特点:
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 p 区包括第13 至第 18 共六族元素, 加上新近合成的 114 号、116 号和 118 号在内, 元素总 数共 34 种。该区的 12 个短周期元素(硼、碳、氮、氧、氟、氖和铝、硅、磷、硫、氯、氩)与 s 区的 4 个短周期元素(锂、铍、钠、镁)一起被叫作为典型元素; 包括尚未发现的 3 个元素(Z=113, 115, 117)在内的 24 个长周期元素又叫过渡后元素. p区元素价电子组态为ns 2 np 1~6. 最高氧化态为+3至+8,不再与IUPAC推荐的族序号相一致。 ● 唯一同时包括金属和非金属元素的一个区 ● 包括 “不活泼的单原子气体—稀有气体” ● 无机非金属材料库:C—C复合材料,人造金刚石,半导体硅,分子筛(铝硅酸盐), 高能燃料(N2H4) ● 有毒的小元素群 ● 多有同素异形体 ● 成键的多样性:如乙硼烷的 3c2e 键等 13.1 第 13、第 14 和第 15 族概述 本节介绍硼族、碳族和氮族元素的重要物理和化学特征。 Some properties of group 13 to group 15 elements Element First ionization energy I1/kJ·mol-1 Electronegativity a χ Covalent radius rcov/pm Ionic radius rion/pm Oxidation state b B Al Ga In Tl C Si Ge Sn Pb N P As Sb Bi 899 578 579 558 589 1086 786 760 708 715 1410 1020 953 840 710 2.04 1.61 1.84 1.78 2.04 2.55 1.90 2.01 1.96 2.33 3.04 2.06 2.18 2.05 2.02 85 143 153 167 171 77 117 122 140 175 75 110 122 143 152 - 54 62 80 89 - 40 53 69 92 - - - - - +3 +3 +3, +1 +3, +1 +3, +1 (+4, +2)c +4 +4, +2 +4, +2 +4, +2 +5, +4, +3, +2, +1, -3 +5, +3, -3 +5, +3 +5, +3 +5, +3 a in Pauling scale. b Oxidation numbers in bold type indicate the most stable state(s). c for inorganic compounds of carbon. 周期表中即包括非金属元素又包括金属元素的族只有硼族、碳族和氮族。 ★ 金属性:总的变化规律是由上而下逐渐增强 P区元素的化学以其多样性为特点:
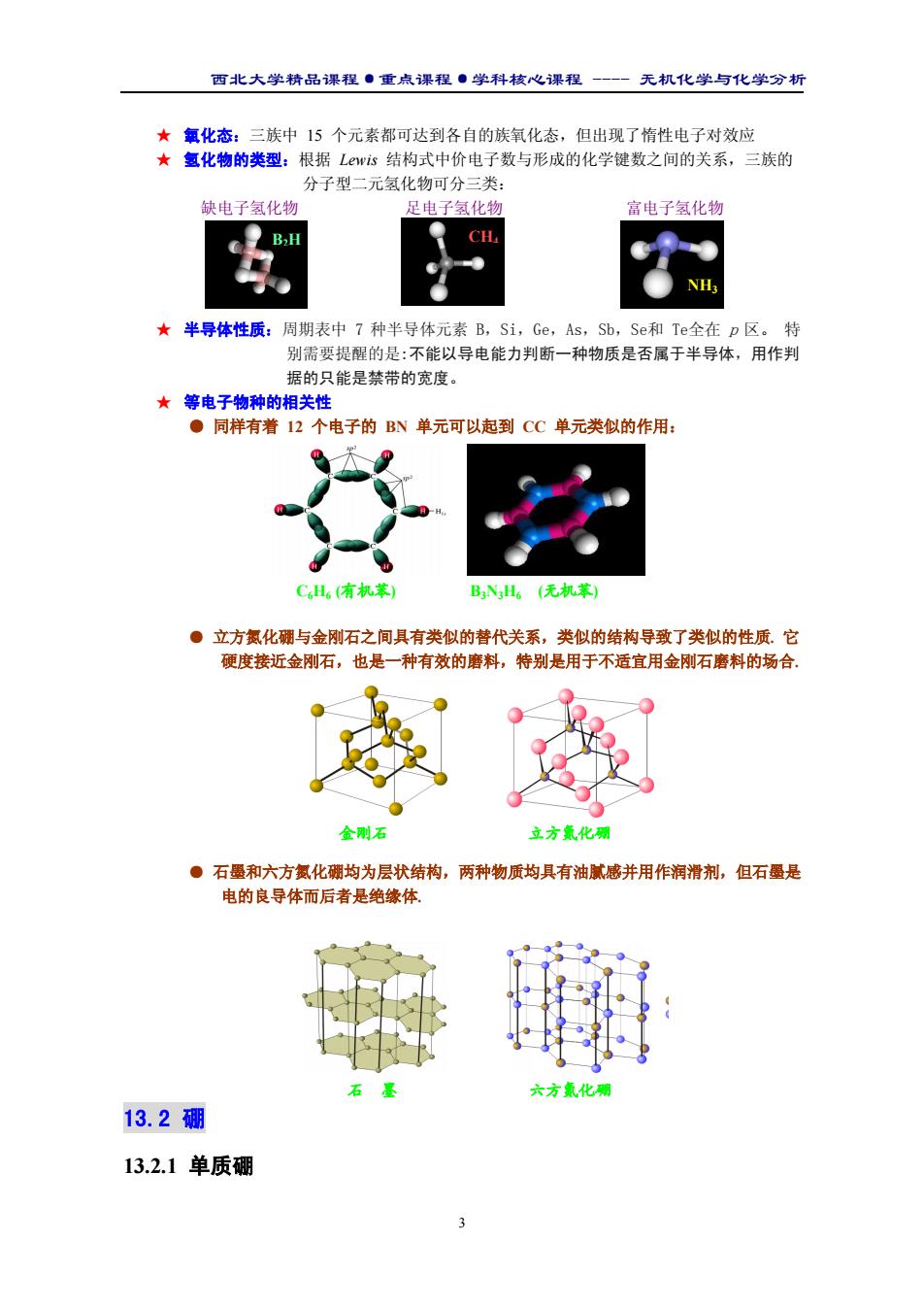
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 ★ 氧化态:三族中 15 个元素都可达到各自的族氧化态,但出现了惰性电子对效应 ★ 氢化物的类型:根据 Lewis 结构式中价电子数与形成的化学键数之间的关系,三族的 分子型二元氢化物可分三类: 缺电子氢化物 足电子氢化物 富电子氢化物 缺电子 ★ 半导体性质:周期表中 7 种半导体元素 B,Si,Ge,As,Sb,Se和 Te全在 p 区。 特 别需要提醒的是:不能以导电能力判断一种物质是否属于半导体,用作判 据的只能是禁带的宽度。 ★ 等电子物种的相关性 ● 同样有着 12 个电子的 BN 单元可以起到 CC 单元类似的作用: ● 立方氮化硼与金刚石之间具有类似的替代关系,类似的结构导致了类似的性质. 它 硬度接近金刚石,也是一种有效的磨料,特别是用于不适宜用金刚石磨料的场合. ● 石墨和六方氮化硼均为层状结构,两种物质均具有油腻感并用作润滑剂,但石墨是 电的良导体而后者是绝缘体. 13.2 硼 13.2.1 单质硼 B2H CH4 NH3 C6H6 (有机苯) B3N3H6 (无机苯) 金刚石 立方氮化硼 石 墨 六方氮化硼
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 ★ 氧化态:三族中 15 个元素都可达到各自的族氧化态,但出现了惰性电子对效应 ★ 氢化物的类型:根据 Lewis 结构式中价电子数与形成的化学键数之间的关系,三族的 分子型二元氢化物可分三类: 缺电子氢化物 足电子氢化物 富电子氢化物 缺电子 ★ 半导体性质:周期表中 7 种半导体元素 B,Si,Ge,As,Sb,Se和 Te全在 p 区。 特 别需要提醒的是:不能以导电能力判断一种物质是否属于半导体,用作判 据的只能是禁带的宽度。 ★ 等电子物种的相关性 ● 同样有着 12 个电子的 BN 单元可以起到 CC 单元类似的作用: ● 立方氮化硼与金刚石之间具有类似的替代关系,类似的结构导致了类似的性质. 它 硬度接近金刚石,也是一种有效的磨料,特别是用于不适宜用金刚石磨料的场合. ● 石墨和六方氮化硼均为层状结构,两种物质均具有油腻感并用作润滑剂,但石墨是 电的良导体而后者是绝缘体. 13.2 硼 13.2.1 单质硼 B2H CH4 NH3 C6H6 (有机苯) B3N3H6 (无机苯) 金刚石 立方氮化硼 石 墨 六方氮化硼

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 ★ 结构 单质硼有多种同素异形体,而基本结构单元则是 B12 二十面体。 各种不同类型的 晶形硼, 其差别仅在于二十面体连接方式的不同。 ★ 性质 无定形硼比较活泼,室温下即与 F2 反应,与 Cl2, Br2, O2, S 等反应则需加热。 浓 HNO3 或浓 H2SO4 都可以将硼氧化为 H3BO3,硼与碱反应生成偏硼酸盐放出 H2: B(s) + 3 HNO3(aq) H3BO3(aq) + 3 NO2(g) 2 B(s) + 2 NaOH(aq) + 2 H2O(l) 2 NaBO2(aq) + 3 H2(g) ★ 制备 用镁还原 B2O3 可制得单质硼; 将 H2与 BBr3(或 BCl3)的混合气体通过 1 500~1 700 K 的钨丝(或钽丝)可以制得高纯度硼: Δ B2O3(s) + 3 Mg(s) 2 B(s) + 3 MgO(s) 1 500~1 700 K BBr3(g) + 3 H2(g) 2 B(s) + 6 HBr(g) ★ 用途 无定形硼可用于生产硼钢. 硼钢主要用于制造喷气发动机和核反应堆的控制棒。 前一种用途基于其优良的抗冲击性能,后一种用途基于硼吸收中子的能力。 13.2.2 硼酸盐和硼酸 工业上最重要的硼酸盐是四硼酸钠, 它的十水合物(Na2B4O7·10H2O)叫硼砂。 硼酸钠盐的年 耗量约占总硼消耗量的 80%, 其中一半以上用于玻璃、陶瓷和搪瓷工业,其他应用领域包括洗涤 剂组分(过硼酸盐)、微量元素肥料、金属焊剂和纤维素材质的阻燃剂。 硼砂溶于水, 水解使溶液呈强碱性, 化学分析中用作标定标准酸溶液的基准物。 滴定反应 为: Na2B4O7(aq) + 2 HCl(aq) + 5 H2O(l) = 4 H3BO3(aq) + 2 NaCl(aq) 熔化了的硼砂能与某些金属氧化物反应, 生成金属的偏硼酸盐(习惯上叫作硼砂珠)。不同金 属氧化物使硼砂珠显示出不同的颜色, 分析化学应用该性质定性鉴定金属离子。 例如: CoO(s) + Na2B4O7(l) = Co(BO2)2(s, 蓝宝石色) + 2 NaBO2(s) B O O B O O O OH HO HO B B OH 2- B O H O O B O H O B H O B O O O H 2-
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 ★ 结构 单质硼有多种同素异形体,而基本结构单元则是 B12 二十面体。 各种不同类型的 晶形硼, 其差别仅在于二十面体连接方式的不同。 ★ 性质 无定形硼比较活泼,室温下即与 F2 反应,与 Cl2, Br2, O2, S 等反应则需加热。 浓 HNO3 或浓 H2SO4 都可以将硼氧化为 H3BO3,硼与碱反应生成偏硼酸盐放出 H2: B(s) + 3 HNO3(aq) H3BO3(aq) + 3 NO2(g) 2 B(s) + 2 NaOH(aq) + 2 H2O(l) 2 NaBO2(aq) + 3 H2(g) ★ 制备 用镁还原 B2O3 可制得单质硼; 将 H2与 BBr3(或 BCl3)的混合气体通过 1 500~1 700 K 的钨丝(或钽丝)可以制得高纯度硼: Δ B2O3(s) + 3 Mg(s) 2 B(s) + 3 MgO(s) 1 500~1 700 K BBr3(g) + 3 H2(g) 2 B(s) + 6 HBr(g) ★ 用途 无定形硼可用于生产硼钢. 硼钢主要用于制造喷气发动机和核反应堆的控制棒。 前一种用途基于其优良的抗冲击性能,后一种用途基于硼吸收中子的能力。 13.2.2 硼酸盐和硼酸 工业上最重要的硼酸盐是四硼酸钠, 它的十水合物(Na2B4O7·10H2O)叫硼砂。 硼酸钠盐的年 耗量约占总硼消耗量的 80%, 其中一半以上用于玻璃、陶瓷和搪瓷工业,其他应用领域包括洗涤 剂组分(过硼酸盐)、微量元素肥料、金属焊剂和纤维素材质的阻燃剂。 硼砂溶于水, 水解使溶液呈强碱性, 化学分析中用作标定标准酸溶液的基准物。 滴定反应 为: Na2B4O7(aq) + 2 HCl(aq) + 5 H2O(l) = 4 H3BO3(aq) + 2 NaCl(aq) 熔化了的硼砂能与某些金属氧化物反应, 生成金属的偏硼酸盐(习惯上叫作硼砂珠)。不同金 属氧化物使硼砂珠显示出不同的颜色, 分析化学应用该性质定性鉴定金属离子。 例如: CoO(s) + Na2B4O7(l) = Co(BO2)2(s, 蓝宝石色) + 2 NaBO2(s) B O O B O O O OH HO HO B B OH 2- B O H O O B O H O B H O B O O O H 2-

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 Cr2O3(s) + 3 Na2B4O7(l) = 2 Cr(BO2)3(s, 绿色) + 6 NaBO2(s) 与化学式 H3BO3 所暗示的不同, 硼酸在水中是个一元酸。 这是因为在 H3BO3 分子中, 未满 8 电子结构的 B 原子能接受 H2O 分子中 O 原子的孤对电子形成配位键,同时将这个 H2O 分子的 一个质子转移给一个溶剂 H2O 分子: B(OH)3(aq) + 2 H2O(l) = [B(OH)4] - (aq) + H3O+ (aq) pKa ○一 = 9.2 pKa ○一值表明 H3BO3 的酸性极弱,用 NaOH 直接滴定时很难观察到滴定终点. 如果滴定前加入多 羟基化合物(如甘露醇、甘油), H3BO3 则与这类化合物反应生成稳定的配合物, 并将 H3O+ 电离出 来,从而使滴定法可用于测定硼含量. OH HO-CH2 O-CH2 - ∕ ∣ ∕ ∣ HO-B + HO-CH2 O-B C(OH)H + H3O + H2O \ ∣ \ ∣ OH HO-CH2 O-CH2 有浓 H2SO4 存在时, H3BO3 与甲醇或乙醇反应生成挥发性硼酸酯. 硼酸酯燃烧发出的绿色火 焰用来鉴定硼酸根的存在. 3 C2H5OH(aq) + H3BO3(aq) = B(OC2H5)3(aq) + 3 H2O(l) H3BO3 在冷水中溶解度很小,在热水中却是易溶的。 这意味着, 可通过水溶液中重结晶的 方法提纯,也说明它含有氢键。 13.2.3 硼的三卤化物 三卤化硼是一类非常重要的化合物。 作为有代表性的路易斯酸, 我们曾经介绍过 BF3 这个 重要的有机反应催化剂。 三卤化硼都是熔点、沸点较低的共价化合物。 BF3 和 BCl3 在通常条 件下是气体,BBr3 和 BI3分别是挥发性液体和固体,性质的这种变化趋势与分子间色散力的变化 趋势相一致。 Some properties of boron halides, BX3 BX3 melting point, t/℃ boiling point, t/℃ △fG○一 m/kJ·mol-1 BF3 BCl3 BBr3 BI3 -127 -107 -46 49 -100 12 91 210 -1112 -339 -232 21 由表可知,除 BI3 以外, 其余 BX3 的△fG○一 m值均为负值. 这意味着, 这三种 BX3 可由卤素与元 素硼直接合成. 不过, BF3 的制备更多采用下述反应: B2O3(s) + 3 CaF2(s) + 6 H2SO4(l) = 2 BF3(g) + 3 [H3O]+ [HSO4] - (soln) + 3 CaSO4(s) 制备 BCl3 可采用元素硼与氯化氢的反应, 或者在还原剂存在下以 B2O3 为起始物的氯化反 应: △ 2 B(s) + 6 HCl(g) 2 BCl3(g) + 3 H2(g) △
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 Cr2O3(s) + 3 Na2B4O7(l) = 2 Cr(BO2)3(s, 绿色) + 6 NaBO2(s) 与化学式 H3BO3 所暗示的不同, 硼酸在水中是个一元酸。 这是因为在 H3BO3 分子中, 未满 8 电子结构的 B 原子能接受 H2O 分子中 O 原子的孤对电子形成配位键,同时将这个 H2O 分子的 一个质子转移给一个溶剂 H2O 分子: B(OH)3(aq) + 2 H2O(l) = [B(OH)4] - (aq) + H3O+ (aq) pKa ○一 = 9.2 pKa ○一值表明 H3BO3 的酸性极弱,用 NaOH 直接滴定时很难观察到滴定终点. 如果滴定前加入多 羟基化合物(如甘露醇、甘油), H3BO3 则与这类化合物反应生成稳定的配合物, 并将 H3O+ 电离出 来,从而使滴定法可用于测定硼含量. OH HO-CH2 O-CH2 - ∕ ∣ ∕ ∣ HO-B + HO-CH2 O-B C(OH)H + H3O + H2O \ ∣ \ ∣ OH HO-CH2 O-CH2 有浓 H2SO4 存在时, H3BO3 与甲醇或乙醇反应生成挥发性硼酸酯. 硼酸酯燃烧发出的绿色火 焰用来鉴定硼酸根的存在. 3 C2H5OH(aq) + H3BO3(aq) = B(OC2H5)3(aq) + 3 H2O(l) H3BO3 在冷水中溶解度很小,在热水中却是易溶的。 这意味着, 可通过水溶液中重结晶的 方法提纯,也说明它含有氢键。 13.2.3 硼的三卤化物 三卤化硼是一类非常重要的化合物。 作为有代表性的路易斯酸, 我们曾经介绍过 BF3 这个 重要的有机反应催化剂。 三卤化硼都是熔点、沸点较低的共价化合物。 BF3 和 BCl3 在通常条 件下是气体,BBr3 和 BI3分别是挥发性液体和固体,性质的这种变化趋势与分子间色散力的变化 趋势相一致。 Some properties of boron halides, BX3 BX3 melting point, t/℃ boiling point, t/℃ △fG○一 m/kJ·mol-1 BF3 BCl3 BBr3 BI3 -127 -107 -46 49 -100 12 91 210 -1112 -339 -232 21 由表可知,除 BI3 以外, 其余 BX3 的△fG○一 m值均为负值. 这意味着, 这三种 BX3 可由卤素与元 素硼直接合成. 不过, BF3 的制备更多采用下述反应: B2O3(s) + 3 CaF2(s) + 6 H2SO4(l) = 2 BF3(g) + 3 [H3O]+ [HSO4] - (soln) + 3 CaSO4(s) 制备 BCl3 可采用元素硼与氯化氢的反应, 或者在还原剂存在下以 B2O3 为起始物的氯化反 应: △ 2 B(s) + 6 HCl(g) 2 BCl3(g) + 3 H2(g) △

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 B2O3(s) + 3 Cl2(g) + 3 C(s) 2 BCl3(g) + 3 CO(g) 与本族其他元素的卤化物(例如 AlCl3, 见后)不同,BX3 在气态、液态和固态都不形成二聚体. BF3 在潮湿空气中发烟, 在水中只发生部分水解: 4 BF3(g) + 3 H2O(l) = H3BO3(aq) + 3 H[BF4](aq) BCl3,BBr3 和 BI3 遇 H2O 完全水解,以 BCl3 为例, 其水解反应为: BCl3(g) + 3 H2O(l) B(OH)3(aq) + 3 HCl(aq) 13.2.4 硼氢化合物 1. 简单硼氢化合物的性质和反应 硼氢化合物又叫硼烷(Borane)。 硼与氢不能直接化合。 斯托克(Stock A)通过硼化镁与酸的反应最先制备了硼氢化合物, 不过, 这种方法已被产率更高的 其他方法所代替。 例如, 在乙醚溶液中用三卤化硼与 LiEH4(E=B,Al)反应制备乙硼烷: 4 BF3(g) + 3 LiEH4(ether) 2 B2H6(g) + 3 LiEF4(ether) 这种方法叫氢负离子置换法,卤化硼中的卤素负离子(X- )与 LiEH4 中的氢负离子(H- )交换了 位置。 NaBH4 和 KBH4 与 LiBH4 同样都是非常有用的实验室试剂, 常用作温和的负氢离子源、 还原剂和制备许多硼氢化合物的前体。 斯托克当时只制备出 6 个硼氢化合物,其组成或者符合通式 BnHn+4, 或者符合通式 BnHn+6: B2H6 B4H10 B5H9 B5H11 B6H10 B10H14 乙硼烷(6) 丁硼烷(10) 戊硼烷(9) 戊硼烷(11) 己硼烷(10) 癸硼烷(14) 中译名中的“乙”、“丁”等表示硼原子的数目,括号中的数字表示 H 原子的数目。 所有的硼烷都可燃,相对分子质量较小的硼烷在空气中自燃并发出绿色闪光,最终反应产物 为硼的水合氧化物: B2H6(g) + 3 O2(g) 2 B(OH)3(s) △rH○一 m = -2 166 kJ·mol-1 由于反应中放出大量热,人们曾指望将硼烷用作火箭燃料。 但由于多种原因,这一设想未能成 为现实。 2. 三中心二电子键 克里斯托弗·朗古特-希金斯(Christopher Longuet-Higgins)提出的三中 心二电子键(“3c-2e 键”)概念,为 B2H6 提出了结构图, 其中 4 个 H 原子为端 H 原子, 另外两个 为桥 H 原子. 12 个键电子(6 个来自 B 原子, 6 个来自 H 原子)的分配方式为:4 个 B-H 端键用去
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 B2O3(s) + 3 Cl2(g) + 3 C(s) 2 BCl3(g) + 3 CO(g) 与本族其他元素的卤化物(例如 AlCl3, 见后)不同,BX3 在气态、液态和固态都不形成二聚体. BF3 在潮湿空气中发烟, 在水中只发生部分水解: 4 BF3(g) + 3 H2O(l) = H3BO3(aq) + 3 H[BF4](aq) BCl3,BBr3 和 BI3 遇 H2O 完全水解,以 BCl3 为例, 其水解反应为: BCl3(g) + 3 H2O(l) B(OH)3(aq) + 3 HCl(aq) 13.2.4 硼氢化合物 1. 简单硼氢化合物的性质和反应 硼氢化合物又叫硼烷(Borane)。 硼与氢不能直接化合。 斯托克(Stock A)通过硼化镁与酸的反应最先制备了硼氢化合物, 不过, 这种方法已被产率更高的 其他方法所代替。 例如, 在乙醚溶液中用三卤化硼与 LiEH4(E=B,Al)反应制备乙硼烷: 4 BF3(g) + 3 LiEH4(ether) 2 B2H6(g) + 3 LiEF4(ether) 这种方法叫氢负离子置换法,卤化硼中的卤素负离子(X- )与 LiEH4 中的氢负离子(H- )交换了 位置。 NaBH4 和 KBH4 与 LiBH4 同样都是非常有用的实验室试剂, 常用作温和的负氢离子源、 还原剂和制备许多硼氢化合物的前体。 斯托克当时只制备出 6 个硼氢化合物,其组成或者符合通式 BnHn+4, 或者符合通式 BnHn+6: B2H6 B4H10 B5H9 B5H11 B6H10 B10H14 乙硼烷(6) 丁硼烷(10) 戊硼烷(9) 戊硼烷(11) 己硼烷(10) 癸硼烷(14) 中译名中的“乙”、“丁”等表示硼原子的数目,括号中的数字表示 H 原子的数目。 所有的硼烷都可燃,相对分子质量较小的硼烷在空气中自燃并发出绿色闪光,最终反应产物 为硼的水合氧化物: B2H6(g) + 3 O2(g) 2 B(OH)3(s) △rH○一 m = -2 166 kJ·mol-1 由于反应中放出大量热,人们曾指望将硼烷用作火箭燃料。 但由于多种原因,这一设想未能成 为现实。 2. 三中心二电子键 克里斯托弗·朗古特-希金斯(Christopher Longuet-Higgins)提出的三中 心二电子键(“3c-2e 键”)概念,为 B2H6 提出了结构图, 其中 4 个 H 原子为端 H 原子, 另外两个 为桥 H 原子. 12 个键电子(6 个来自 B 原子, 6 个来自 H 原子)的分配方式为:4 个 B-H 端键用去

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 金属铝电解池 8 个; 每个桥 H 原子与两个 B 原子共用 2 个电子, 形成一个三中心二电子键, B2H6 中含两个 3c-2e 键。 13.3 铝 13.3.1 单质的提取、性质和用途 铝是地壳中丰度最大的元素之一, 仅次于氧和硅排第三位。 最有工业价值的矿物是铝土矿, 铝土矿是氧化铝的水合物(Al2O3·xH2O)。 从产量和耗量而言, 铝最重要的有色金属. 全世界每年生产的金属铝(不包括回收部分)在 1.5×107 t 以上。 工业上用电解 Al2O3 的方法生产金属铝。 电解槽的阳极和阴极都使用石墨材料, Al3+离子在阴极放电生成金属铝, O2-离子在阳极放电生成的 O2, 使石墨燃烧放出 CO 或 CO2. 电 解反应如下: 阴极: Al3+(l) + 3 e - Al(l) 阳极: C(s) + 2 O2-(l) CO2(g) + 4 e - 电解在 940℃~980℃的温度下进行。无水氧化铝的熔点在 2000℃以上, 不宜直接用作电解质. 通 常是将提纯了的 Al2O3 熔解在 冰晶石(Na3AlF6)中。 此外, 还 加入多种金属氟化物(如 AlF3, CaF2, LiF 和 MgF2)以增加熔体 的导电性、提高电流效率并减少 氟向环境的飞逸。下图为电解槽 示意图, 由于液态铝的密度大 于电解质熔体的密度, 生成的 金属收集在电解槽底部。 氢 键 氢 桥 结合力的类型 主要是静电作用 共价键(三中心二电子键) 键 能 小(与分子间力相近) 较大(小于正常共价键) H 连接的原子 电负性大,半径小的原子, 缺电子原子,主要是B 主要是F、O、N 与H相连的原子的对称性 不对称(除对称氢键外) 对 称
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 金属铝电解池 8 个; 每个桥 H 原子与两个 B 原子共用 2 个电子, 形成一个三中心二电子键, B2H6 中含两个 3c-2e 键。 13.3 铝 13.3.1 单质的提取、性质和用途 铝是地壳中丰度最大的元素之一, 仅次于氧和硅排第三位。 最有工业价值的矿物是铝土矿, 铝土矿是氧化铝的水合物(Al2O3·xH2O)。 从产量和耗量而言, 铝最重要的有色金属. 全世界每年生产的金属铝(不包括回收部分)在 1.5×107 t 以上。 工业上用电解 Al2O3 的方法生产金属铝。 电解槽的阳极和阴极都使用石墨材料, Al3+离子在阴极放电生成金属铝, O2-离子在阳极放电生成的 O2, 使石墨燃烧放出 CO 或 CO2. 电 解反应如下: 阴极: Al3+(l) + 3 e - Al(l) 阳极: C(s) + 2 O2-(l) CO2(g) + 4 e - 电解在 940℃~980℃的温度下进行。无水氧化铝的熔点在 2000℃以上, 不宜直接用作电解质. 通 常是将提纯了的 Al2O3 熔解在 冰晶石(Na3AlF6)中。 此外, 还 加入多种金属氟化物(如 AlF3, CaF2, LiF 和 MgF2)以增加熔体 的导电性、提高电流效率并减少 氟向环境的飞逸。下图为电解槽 示意图, 由于液态铝的密度大 于电解质熔体的密度, 生成的 金属收集在电解槽底部。 氢 键 氢 桥 结合力的类型 主要是静电作用 共价键(三中心二电子键) 键 能 小(与分子间力相近) 较大(小于正常共价键) H 连接的原子 电负性大,半径小的原子, 缺电子原子,主要是B 主要是F、O、N 与H相连的原子的对称性 不对称(除对称氢键外) 对 称

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 电解法制铝是炼铝工艺上的一次突破, 这次突破使铝由实验室珍品成为航空工业和建材工业中 重要的结构金属。 近些年来, 电解工艺的改进使生产 1 kg 铝的能耗降至 13~16 kW·h,但无疑 仍属高能耗工业。 ★ 铝是相当活泼的金属,在适当条件下可与许多非金属单质(如 O2,卤素,S,N2,P,C 等)以及与水、酸和碱起反应。 ★ 铝与氧的亲和力很高, 氧化铝的生成热比一般金属氧化物大得多: 2 Al(s) + (3/2) O2(g) Al2O3(s) △fH○一 m = -1 676 kJ·mol-1 铝的这一性质被用于冶金工业,例如, 将块铝加入钢水可以脱除其中的氧。 作为还原剂, 铝在高 温下可将许多金属氧化物还原为金属. ★ 铝的活泼性因某些动力学因素而受到限制,例如金属铝表面在空气中形成保护性氧化膜。 如果没有这种保护膜,铝的应用领域将会小得多。 13.3.2 铝的化合物 如果不考虑陶瓷和粘土产品(主要成分为铝硅酸盐),氧化铝及其水合物当算最重要的铝化合 物了。 其他重要铝化合物有硫酸铝、氯化铝、偏铝酸钠、氟化铝和冰晶石(Na3AlF6). 氧化铝及 其水合物主要用于电解生产金属铝;约 10%的总产量用于耐火材料、玻璃、搪瓷、塑料工业(阻 燃剂)以及磨料和抛光剂;活性氧化铝用作吸附剂、催化剂和催化剂载体。 无水 AlCl3 主要用作 有机化学工业的催化剂。 硫酸铝总产量的一半用于造纸工业,几乎同样的量消耗于水的净化(絮 凝剂)。 1. Al2O3和 Al(OH)3 铝土矿中含有 SiO2,Fe2O3和 TiO2 等杂质,用电解法生产金属铝时, Al2O3 必须预先提纯。 在高压釜或连续式管式反应器中以 NaOH 溶液(c=3~6 mol·dm-3, 120~250℃)浸渍铝土矿,水 合氧化铝在浸渍过程中溶解生成铝酸钠. Al2O3(s) + 2 NaOH(aq) + 3 H2O(l) 2 Na[Al(OH)4](aq) CaO 铝土矿 浸 渍 加热 NaOH 蒸 发 加热 沉 淀 冷却 澄 清 晶种 水 洗 泥 红泥 α Al(OH)3 洗 涤 水 煅 烧 αAl2O3
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 电解法制铝是炼铝工艺上的一次突破, 这次突破使铝由实验室珍品成为航空工业和建材工业中 重要的结构金属。 近些年来, 电解工艺的改进使生产 1 kg 铝的能耗降至 13~16 kW·h,但无疑 仍属高能耗工业。 ★ 铝是相当活泼的金属,在适当条件下可与许多非金属单质(如 O2,卤素,S,N2,P,C 等)以及与水、酸和碱起反应。 ★ 铝与氧的亲和力很高, 氧化铝的生成热比一般金属氧化物大得多: 2 Al(s) + (3/2) O2(g) Al2O3(s) △fH○一 m = -1 676 kJ·mol-1 铝的这一性质被用于冶金工业,例如, 将块铝加入钢水可以脱除其中的氧。 作为还原剂, 铝在高 温下可将许多金属氧化物还原为金属. ★ 铝的活泼性因某些动力学因素而受到限制,例如金属铝表面在空气中形成保护性氧化膜。 如果没有这种保护膜,铝的应用领域将会小得多。 13.3.2 铝的化合物 如果不考虑陶瓷和粘土产品(主要成分为铝硅酸盐),氧化铝及其水合物当算最重要的铝化合 物了。 其他重要铝化合物有硫酸铝、氯化铝、偏铝酸钠、氟化铝和冰晶石(Na3AlF6). 氧化铝及 其水合物主要用于电解生产金属铝;约 10%的总产量用于耐火材料、玻璃、搪瓷、塑料工业(阻 燃剂)以及磨料和抛光剂;活性氧化铝用作吸附剂、催化剂和催化剂载体。 无水 AlCl3 主要用作 有机化学工业的催化剂。 硫酸铝总产量的一半用于造纸工业,几乎同样的量消耗于水的净化(絮 凝剂)。 1. Al2O3和 Al(OH)3 铝土矿中含有 SiO2,Fe2O3和 TiO2 等杂质,用电解法生产金属铝时, Al2O3 必须预先提纯。 在高压釜或连续式管式反应器中以 NaOH 溶液(c=3~6 mol·dm-3, 120~250℃)浸渍铝土矿,水 合氧化铝在浸渍过程中溶解生成铝酸钠. Al2O3(s) + 2 NaOH(aq) + 3 H2O(l) 2 Na[Al(OH)4](aq) CaO 铝土矿 浸 渍 加热 NaOH 蒸 发 加热 沉 淀 冷却 澄 清 晶种 水 洗 泥 红泥 α Al(OH)3 洗 涤 水 煅 烧 αAl2O3

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 澄清后分离并洗涤含氧化铁的“红泥”,得到的滤液中比值 n(Na2O)/n(Al2O3)约为 1.5~1.8. 将滤液 搅拌、冷却并加入大量 Al(OH)3 晶种, 大部分氢氧化物以α-Al(OH)3 形式沉淀出来: Al(OH)4 - (aq) + H2O(l) α-Al(OH)3(s) + OH- (aq) 分离 Al(OH)3 后得到的滤液经蒸发浓缩后返回铝土矿浸渍设备。 在特定条件下将α-Al(OH)3 加热得到γ-Al(OH)3, 后者具有很高的比表面, 从而显示良好的 吸附性能和催化性能。 2. 铝的卤化物 无水氯化铝的生产主要采用金属直接氯化法。这种方法是将液态铝与氯 气在 600~700℃温度下在陶瓷衬内的反应器中反应。近些年, 人们开始采用氧化铝的还原氯化法, 这种方法的能耗比金属直接氯化法低得多。 800~900℃ Al2O3(s) + 3 C(s) + 3 Cl2(g) 2 AlCl3(s) + 3 CO(g) F- 离子体积小,AlF3 的熔点和升华焓较其他卤化物高得多。较高的晶格焓还导致了 AlF3 在大多数溶剂中具有较低的溶解度。 与氟化物不同,铝的其他卤化物易溶于多种极性溶剂,而且都是良好的路易斯酸。水 AlCl3 和AlBr3用作有机化学反应的催化剂, 主要基于其路易斯酸性. AlCl3以双聚分子Al2Cl6形式存在。 13.4 碳 碳与氧、氢形成的化合物构成生物圈的主体。自然界虽然存在着碳的单质, 但其主要形式则 是包括煤在内的化合物(煤是一种以碳为主体的复杂化合物)。 13.4.1 碳的三种同素异形体 1. 结构 富勒烯是美国的柯尔(Curl R F)和斯莫利(Smalley R E)以及英国的克罗托(Kroto H W)三位教 授于 1985 年发现的新同素异形体,他们因此而获得 1996 年诺贝尔化学奖。现富勒烯引起的轰动 曾经持续了好多年, 除了学术价值和应用前景方面的原因外,造成轰动的部分原因还在于人们本 α-Al2O3 β−Al2O3 低温、快速下加热 刚玉,硬度 大,不溶于 水、酸、碱 活性氧化铝,可 溶于酸、碱,可 作为催化剂载 体, 有些氧化 铝晶体透明,因 含有杂质而虽 现鲜明颜色. 红宝石(Cr3+) 蓝宝石(Fe3+,Cr3+) 黄玉/黄晶(Fe3+)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 澄清后分离并洗涤含氧化铁的“红泥”,得到的滤液中比值 n(Na2O)/n(Al2O3)约为 1.5~1.8. 将滤液 搅拌、冷却并加入大量 Al(OH)3 晶种, 大部分氢氧化物以α-Al(OH)3 形式沉淀出来: Al(OH)4 - (aq) + H2O(l) α-Al(OH)3(s) + OH- (aq) 分离 Al(OH)3 后得到的滤液经蒸发浓缩后返回铝土矿浸渍设备。 在特定条件下将α-Al(OH)3 加热得到γ-Al(OH)3, 后者具有很高的比表面, 从而显示良好的 吸附性能和催化性能。 2. 铝的卤化物 无水氯化铝的生产主要采用金属直接氯化法。这种方法是将液态铝与氯 气在 600~700℃温度下在陶瓷衬内的反应器中反应。近些年, 人们开始采用氧化铝的还原氯化法, 这种方法的能耗比金属直接氯化法低得多。 800~900℃ Al2O3(s) + 3 C(s) + 3 Cl2(g) 2 AlCl3(s) + 3 CO(g) F- 离子体积小,AlF3 的熔点和升华焓较其他卤化物高得多。较高的晶格焓还导致了 AlF3 在大多数溶剂中具有较低的溶解度。 与氟化物不同,铝的其他卤化物易溶于多种极性溶剂,而且都是良好的路易斯酸。水 AlCl3 和AlBr3用作有机化学反应的催化剂, 主要基于其路易斯酸性. AlCl3以双聚分子Al2Cl6形式存在。 13.4 碳 碳与氧、氢形成的化合物构成生物圈的主体。自然界虽然存在着碳的单质, 但其主要形式则 是包括煤在内的化合物(煤是一种以碳为主体的复杂化合物)。 13.4.1 碳的三种同素异形体 1. 结构 富勒烯是美国的柯尔(Curl R F)和斯莫利(Smalley R E)以及英国的克罗托(Kroto H W)三位教 授于 1985 年发现的新同素异形体,他们因此而获得 1996 年诺贝尔化学奖。现富勒烯引起的轰动 曾经持续了好多年, 除了学术价值和应用前景方面的原因外,造成轰动的部分原因还在于人们本 α-Al2O3 β−Al2O3 低温、快速下加热 刚玉,硬度 大,不溶于 水、酸、碱 活性氧化铝,可 溶于酸、碱,可 作为催化剂载 体, 有些氧化 铝晶体透明,因 含有杂质而虽 现鲜明颜色. 红宝石(Cr3+) 蓝宝石(Fe3+,Cr3+) 黄玉/黄晶(Fe3+)

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 未指望在非常熟悉的单质碳上再有重大新发现。不同于无限个原子组成的金刚石和石墨,富勒烯 是确定数目碳原子组成的聚集体。富勒烯中以 60 个碳原子组成得 C60 最稳定,其笼状结构酷似 足球,相当于一个由二十面体截顶而得的三十二面体. 32 个面中包括 12 个五边形面和 20 个六边 形面,每个五边形均与 5 个六边形共边,而六边形则将 12 个五边形彼此隔开. 与石墨相似,C60 分子中每个 C 原子与周围三个 C 原子形成 3 个σ键,剩余的 60 条轨道和电子共同组成离域π键. 三位科学家关于 C60 结构的设想受建筑学家富勒·布基明斯特为 1967 年蒙特利尔世界博览会设计 的薄壳建筑物(也由 12 个五边形和 20 个六边形构成)的启发,因而将包括 C60 在内的这类碳笼分 子叫作富勒烯(fullerenes), 有时也叫布基球(buckyballs)。 性 质 C原子构型 C-C-C键角/(°) 杂化轨道形式 密度/g·cm-3 C-C键长/pm 金刚石 四面体 109.5 Sp3 3.514 154.4 石 墨 三角形平面 120 Sp2 2.266 141.8 C60 近似球面 116(平均) Sp2.28 1.678 139.1(6/6); 145.5(6/5) 金刚石的合成 1.5分钟,FeS(熔剂,催化剂) 5×106 Pa ~ 10×106 Pa ,1500 ~ 2500 ∆Gm θ = 2.866 kJ · mol -1 C ● 溶剂热 ● CH4 混合气 微波(频率 2.45×106 s - ,功率 400 W) 33.7 kPa, < 1273 CCl4(l) + Na(s) 非晶碳的金刚石 Ni-Co-Mn合金催化剂 700℃
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 未指望在非常熟悉的单质碳上再有重大新发现。不同于无限个原子组成的金刚石和石墨,富勒烯 是确定数目碳原子组成的聚集体。富勒烯中以 60 个碳原子组成得 C60 最稳定,其笼状结构酷似 足球,相当于一个由二十面体截顶而得的三十二面体. 32 个面中包括 12 个五边形面和 20 个六边 形面,每个五边形均与 5 个六边形共边,而六边形则将 12 个五边形彼此隔开. 与石墨相似,C60 分子中每个 C 原子与周围三个 C 原子形成 3 个σ键,剩余的 60 条轨道和电子共同组成离域π键. 三位科学家关于 C60 结构的设想受建筑学家富勒·布基明斯特为 1967 年蒙特利尔世界博览会设计 的薄壳建筑物(也由 12 个五边形和 20 个六边形构成)的启发,因而将包括 C60 在内的这类碳笼分 子叫作富勒烯(fullerenes), 有时也叫布基球(buckyballs)。 性 质 C原子构型 C-C-C键角/(°) 杂化轨道形式 密度/g·cm-3 C-C键长/pm 金刚石 四面体 109.5 Sp3 3.514 154.4 石 墨 三角形平面 120 Sp2 2.266 141.8 C60 近似球面 116(平均) Sp2.28 1.678 139.1(6/6); 145.5(6/5) 金刚石的合成 1.5分钟,FeS(熔剂,催化剂) 5×106 Pa ~ 10×106 Pa ,1500 ~ 2500 ∆Gm θ = 2.866 kJ · mol -1 C ● 溶剂热 ● CH4 混合气 微波(频率 2.45×106 s - ,功率 400 W) 33.7 kPa, < 1273 CCl4(l) + Na(s) 非晶碳的金刚石 Ni-Co-Mn合金催化剂 700℃