
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 17 章 氢 Chapter 17 Hydrogen 教学要求 1.熟悉镧系元素电子结构、名称,镧系收缩概念及其产生原因和影响; 2.了解镧系元素的存在,制备及用途; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4.了解镧系元素的分离方法,特别注意溶剂萃取法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元素的相似性。 课时分配(4 学时) 1. 氢的存在、制备及用途: (2 学时) 2. 二元氢化物的分类:(1 学时) 3. 氢能源: (1 学时) 氢是周期表中唯一尚未找到确切位置的元素。 ☆ 有时将其放在碱金属元素上方(与碱金属原子相同,都只有一个介电子), 但不论化学性质还是物理性质都不像碱金属,特别是它毕竟不是金属(人 们预料在很高的压力下氢会显示金属性,但实验室尚达不到这样的压力条 件)。 ☆ 有人主张将其放在卤素上方的格子内,理由是像卤素一样加合一个电子好 可达到稳定的稀有气体电子组态。氢的确显示出某些相似于卤素的性质, 但由 I2 至 F2 活泼性依次增高的性质显然不能延伸至 H2 分子。 17.1 存在、制备和用途 ★ 存在 氢是宇宙中丰度最高的元素,在地球上的丰度排在第 15 位。某些矿物(例如 石油、天然气)和水是氢的主要资源,大气中 H2 的含量很低是因为它太轻而容易脱离地球 引力场。 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 17 章 氢 Chapter 17 Hydrogen 教学要求 1.熟悉镧系元素电子结构、名称,镧系收缩概念及其产生原因和影响; 2.了解镧系元素的存在,制备及用途; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4.了解镧系元素的分离方法,特别注意溶剂萃取法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元素的相似性。 课时分配(4 学时) 1. 氢的存在、制备及用途: (2 学时) 2. 二元氢化物的分类:(1 学时) 3. 氢能源: (1 学时) 氢是周期表中唯一尚未找到确切位置的元素。 ☆ 有时将其放在碱金属元素上方(与碱金属原子相同,都只有一个介电子), 但不论化学性质还是物理性质都不像碱金属,特别是它毕竟不是金属(人 们预料在很高的压力下氢会显示金属性,但实验室尚达不到这样的压力条 件)。 ☆ 有人主张将其放在卤素上方的格子内,理由是像卤素一样加合一个电子好 可达到稳定的稀有气体电子组态。氢的确显示出某些相似于卤素的性质, 但由 I2 至 F2 活泼性依次增高的性质显然不能延伸至 H2 分子。 17.1 存在、制备和用途 ★ 存在 氢是宇宙中丰度最高的元素,在地球上的丰度排在第 15 位。某些矿物(例如 石油、天然气)和水是氢的主要资源,大气中 H2 的含量很低是因为它太轻而容易脱离地球 引力场。 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z 10 20 30 40 50 60 70 80 90 8 6 4 2 0 –2 Pb Bi Pb Th Xe Sc Fe O 原子序数 log(相 对 丰 度) 偶数Z 奇数Z
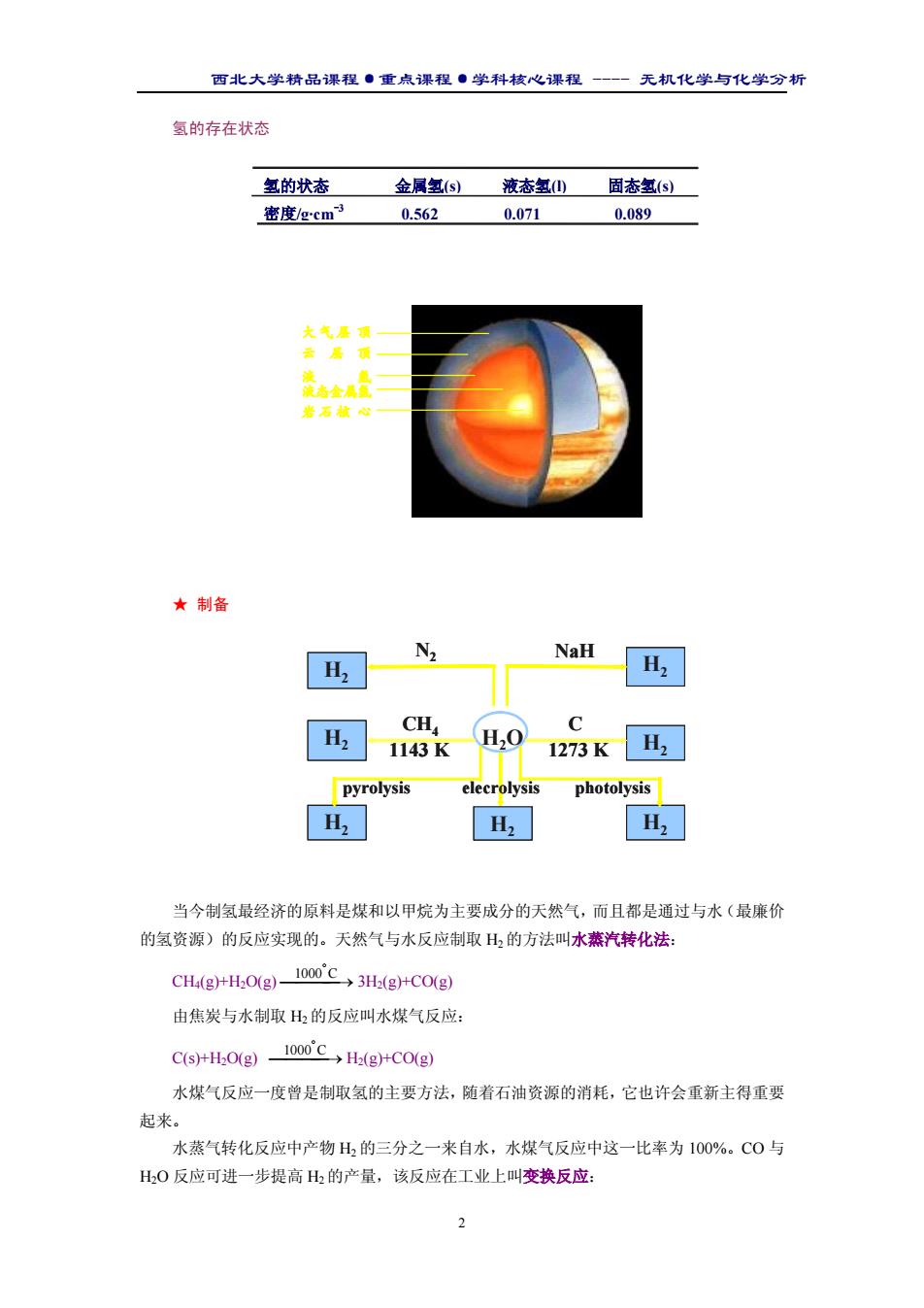
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 氢的存在状态 ★ 制备 当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而且都是通过与水(最廉价 的氢资源)的反应实现的。天然气与水反应制取 H2 的方法叫水蒸汽转化法: CH4(g)+H2O(g) → ° 1000 C 3H2(g)+CO(g) 由焦炭与水制取 H2 的反应叫水煤气反应: C(s)+H2O(g) → ° 1000 C H2(g)+CO(g) 水煤气反应一度曾是制取氢的主要方法,随着石油资源的消耗,它也许会重新主得重要 起来。 水蒸气转化反应中产物 H2 的三分之一来自水,水煤气反应中这一比率为 100%。CO 与 H2O 反应可进一步提高 H2 的产量,该反应在工业上叫变换反应: 氢的状态 金属氢(s) 液态氢(l) 固态氢(s) 密度/g·cm-3 0.562 0.071 0.089 大气层 顶 云层顶 液 氢 液态金属氢 岩石核 心 H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 氢的存在状态 ★ 制备 当今制氢最经济的原料是煤和以甲烷为主要成分的天然气,而且都是通过与水(最廉价 的氢资源)的反应实现的。天然气与水反应制取 H2 的方法叫水蒸汽转化法: CH4(g)+H2O(g) → ° 1000 C 3H2(g)+CO(g) 由焦炭与水制取 H2 的反应叫水煤气反应: C(s)+H2O(g) → ° 1000 C H2(g)+CO(g) 水煤气反应一度曾是制取氢的主要方法,随着石油资源的消耗,它也许会重新主得重要 起来。 水蒸气转化反应中产物 H2 的三分之一来自水,水煤气反应中这一比率为 100%。CO 与 H2O 反应可进一步提高 H2 的产量,该反应在工业上叫变换反应: 氢的状态 金属氢(s) 液态氢(l) 固态氢(s) 密度/g·cm-3 0.562 0.071 0.089 大气层 顶 云层顶 液 氢 液态金属氢 岩石核 心 H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis H2O H2 H2 H2 H2 H2 H2 H2 N2 NaH C 1273 K CH4 1143 K pyrolysis photolysis elecrolysis
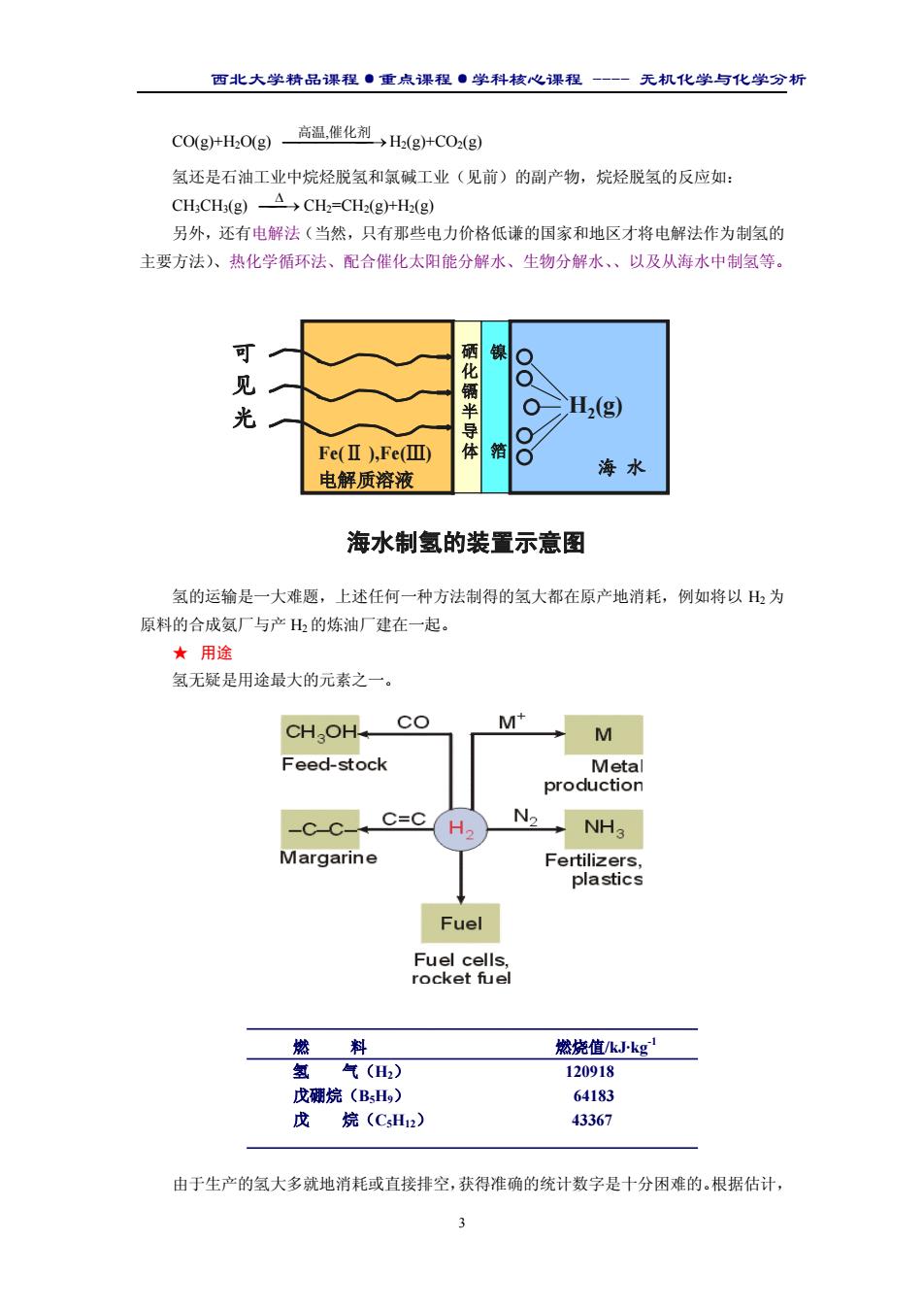
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 CO(g)+H2O(g) → 高温,催化剂 H2(g)+CO2(g) 氢还是石油工业中烷烃脱氢和氯碱工业(见前)的副产物,烷烃脱氢的反应如: CH3CH3(g) → ∆ CH2=CH2(g)+H2(g) 另外,还有电解法(当然,只有那些电力价格低谦的国家和地区才将电解法作为制氢的 主要方法)、热化学循环法、配合催化太阳能分解水、生物分解水、以及从海水中制氢等。 氢的运输是一大难题,上述任何一种方法制得的氢大都在原产地消耗,例如将以 H2 为 原料的合成氨厂与产 H2 的炼油厂建在一起。 ★ 用途 氢无疑是用途最大的元素之一。 由于生产的氢大多就地消耗或直接排空,获得准确的统计数字是十分困难的。根据估计, 燃 料 燃烧值/kJ·kg-1 氢 气(H2) 120918 戊硼烷(B5H9) 64183 戊 烷(C5H12) 43367 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 CO(g)+H2O(g) → 高温,催化剂 H2(g)+CO2(g) 氢还是石油工业中烷烃脱氢和氯碱工业(见前)的副产物,烷烃脱氢的反应如: CH3CH3(g) → ∆ CH2=CH2(g)+H2(g) 另外,还有电解法(当然,只有那些电力价格低谦的国家和地区才将电解法作为制氢的 主要方法)、热化学循环法、配合催化太阳能分解水、生物分解水、以及从海水中制氢等。 氢的运输是一大难题,上述任何一种方法制得的氢大都在原产地消耗,例如将以 H2 为 原料的合成氨厂与产 H2 的炼油厂建在一起。 ★ 用途 氢无疑是用途最大的元素之一。 由于生产的氢大多就地消耗或直接排空,获得准确的统计数字是十分困难的。根据估计, 燃 料 燃烧值/kJ·kg-1 氢 气(H2) 120918 戊硼烷(B5H9) 64183 戊 烷(C5H12) 43367 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图 H2(g) 海 水 Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液 硒 化 镉 半 导 体 镍 箔 可 见 光 海水制氢的装置示意图

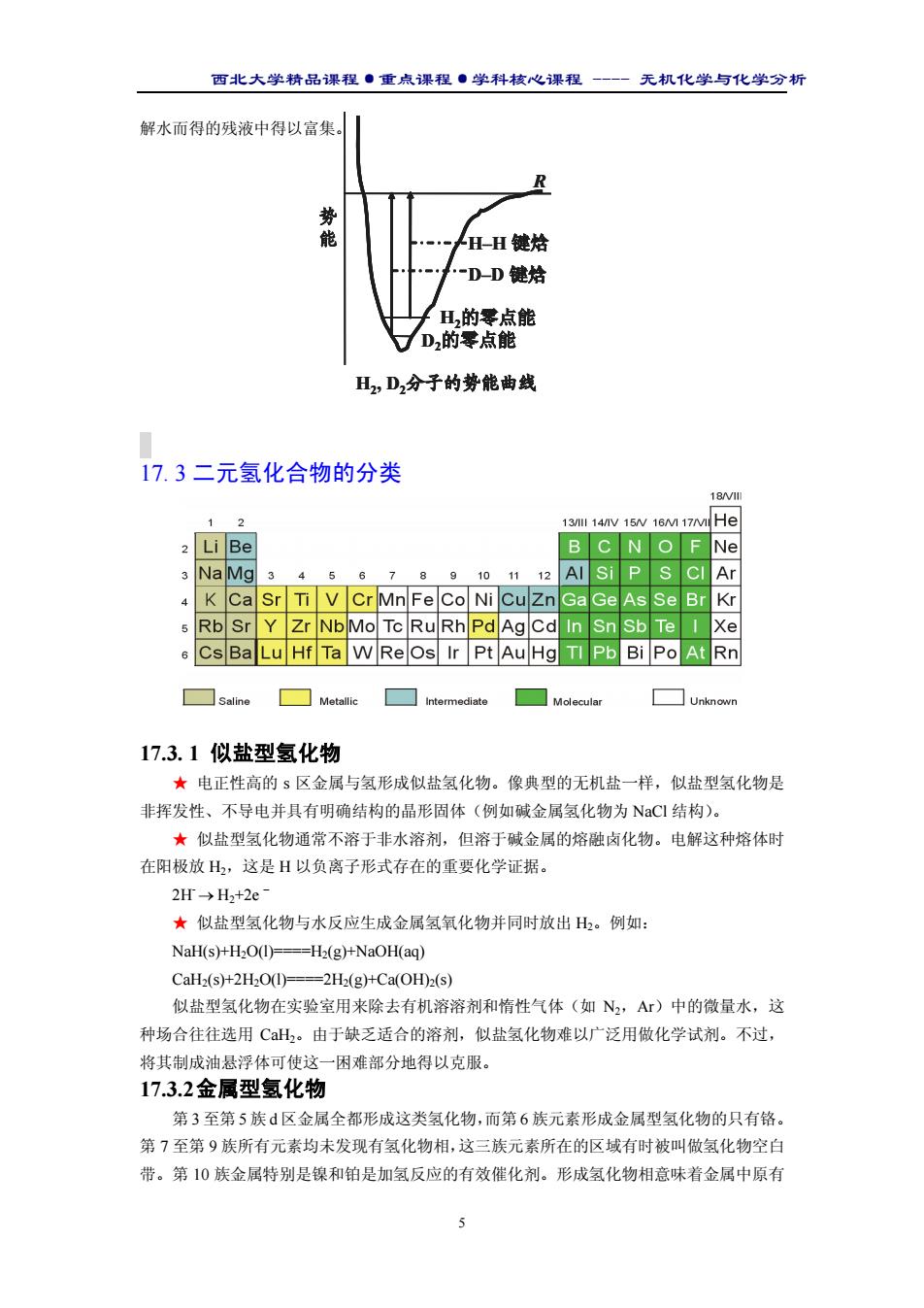
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 全世界每年一产的氢接近 500×109 m 3 。 较低的质量和高燃烧焓使氢成为大型火箭的理想 燃料。20 世纪 70 年代初石油价格猛涨的那段时间内, 科学家严肃地论证过用氢做普通燃料的前景,并提出 了“氢经济学”(hdrogen economy)设想方案。方案 之一是利用太阳能获得谦价的电力电解水,实际是贮 存并利用太阳能的一种方式。虽然“氢经济学”方案 目前不可行(由石油、天然气和煤制取氢的成本要低 得多),但社会对氢能源的注意力仍然不减。世界氢能 源会议从 20 世纪 70 年代中期开始每两年举行一次,吸 引着众多科学家与会。 17.2 核性质 ★ 同位素 氢有三种同位素,它们的质是数分别为 1,2 和 3。 与氢以水的形式存在相似,重氢以重水(D2O)形式存在于天然水中。各种天然水中重 氢的丰度不尽相同,平均约占氢原子总数的 0.016%。 ★ 制备 氚在表面水中的丰度极低,每 1021 个 H 氢原子中才有 1 个氚原子。核聚变反 应中用的氚是从中子轰击锂靶的裂变反应堆中合成的: n Li He H3 1 4 2 6 3 1 0 + → + ★ 同位素效应 一般情况下不同同位素形成的同型分子表现出极为相似的物理和化学 性质,例如 10BF3 与 11BF3 的键焓、蒸气压和路易斯酸性几乎相等。然而,质量相对差特大 的氢同位素物种却出现另一种情况。 D2O 的沸点明显高于 H2O,这是由于前者形成的氢键(O.D—O)比后者(O.H—O) 更强些。相同化学环境下 E—D 键焓高于 E—H 键焓的现象在很大程度上是由零点能的差别 引起的。第 2 章介绍过类似的势能曲线,这里同时示出了零点能。零点能低时键焓相对比较 高,而零点能高时键焓相对比较低。氢同位素造成的性质差别大得足以找到某些实际应用。 例如由于 D2O 中 D—O 键的键焓相对比较高,电解速率应当低于 H2O,其结果是 D2O 在电 ★氢燃烧速率快,反应完全. 氢能源是清洁能源,没有环 境污染,能保持生态平衡. ★ 目前,已实验成功用氢作动力的汽车,有望不久能投入 实用 氢作为航天飞机的燃料已经成为现实,有的航天飞机的 液态氢储罐存有近 1 800 m3 的液态氢 ★氢能源研究面临的三大问题: 氢气的发生(降低生产成本) 氢气的储 存
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 全世界每年一产的氢接近 500×109 m 3 。 较低的质量和高燃烧焓使氢成为大型火箭的理想 燃料。20 世纪 70 年代初石油价格猛涨的那段时间内, 科学家严肃地论证过用氢做普通燃料的前景,并提出 了“氢经济学”(hdrogen economy)设想方案。方案 之一是利用太阳能获得谦价的电力电解水,实际是贮 存并利用太阳能的一种方式。虽然“氢经济学”方案 目前不可行(由石油、天然气和煤制取氢的成本要低 得多),但社会对氢能源的注意力仍然不减。世界氢能 源会议从 20 世纪 70 年代中期开始每两年举行一次,吸 引着众多科学家与会。 17.2 核性质 ★ 同位素 氢有三种同位素,它们的质是数分别为 1,2 和 3。 与氢以水的形式存在相似,重氢以重水(D2O)形式存在于天然水中。各种天然水中重 氢的丰度不尽相同,平均约占氢原子总数的 0.016%。 ★ 制备 氚在表面水中的丰度极低,每 1021 个 H 氢原子中才有 1 个氚原子。核聚变反 应中用的氚是从中子轰击锂靶的裂变反应堆中合成的: n Li He H3 1 4 2 6 3 1 0 + → + ★ 同位素效应 一般情况下不同同位素形成的同型分子表现出极为相似的物理和化学 性质,例如 10BF3 与 11BF3 的键焓、蒸气压和路易斯酸性几乎相等。然而,质量相对差特大 的氢同位素物种却出现另一种情况。 D2O 的沸点明显高于 H2O,这是由于前者形成的氢键(O.D—O)比后者(O.H—O) 更强些。相同化学环境下 E—D 键焓高于 E—H 键焓的现象在很大程度上是由零点能的差别 引起的。第 2 章介绍过类似的势能曲线,这里同时示出了零点能。零点能低时键焓相对比较 高,而零点能高时键焓相对比较低。氢同位素造成的性质差别大得足以找到某些实际应用。 例如由于 D2O 中 D—O 键的键焓相对比较高,电解速率应当低于 H2O,其结果是 D2O 在电 ★氢燃烧速率快,反应完全. 氢能源是清洁能源,没有环 境污染,能保持生态平衡. ★ 目前,已实验成功用氢作动力的汽车,有望不久能投入 实用 氢作为航天飞机的燃料已经成为现实,有的航天飞机的 液态氢储罐存有近 1 800 m3 的液态氢 ★氢能源研究面临的三大问题: 氢气的发生(降低生产成本) 氢气的储 存
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 解水而得的残液中得以富集。 17. 3 二元氢化合物的分类 17.3. 1 似盐型氢化物 ★ 电正性高的 s 区金属与氢形成似盐氢化物。像典型的无机盐一样,似盐型氢化物是 非挥发性、不导电并具有明确结构的晶形固体(例如碱金属氢化物为 NaCl 结构)。 ★ 似盐型氢化物通常不溶于非水溶剂,但溶于碱金属的熔融卤化物。电解这种熔体时 在阳极放 H2,这是 H 以负离子形式存在的重要化学证据。 2H- → H2+2e – ★ 似盐型氢化物与水反应生成金属氢氧化物并同时放出 H2。例如: NaH(s)+H2O(l)====H2(g)+NaOH(aq) CaH2(s)+2H2O(l)====2H2(g)+Ca(OH)2(s) 似盐型氢化物在实验室用来除去有机溶溶剂和惰性气体(如 N2,Ar)中的微量水,这 种场合往往选用 CaH2。由于缺乏适合的溶剂,似盐氢化物难以广泛用做化学试剂。不过, 将其制成油悬浮体可使这一困难部分地得以克服。 17.3.2 金属型氢化物 第 3 至第 5 族 d 区金属全都形成这类氢化物,而第 6 族元素形成金属型氢化物的只有铬。 第 7 至第 9 族所有元素均未发现有氢化物相,这三族元素所在的区域有时被叫做氢化物空白 带。第 10 族金属特别是镍和铂是加氢反应的有效催化剂。形成氢化物相意味着金属中原有 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 解水而得的残液中得以富集。 17. 3 二元氢化合物的分类 17.3. 1 似盐型氢化物 ★ 电正性高的 s 区金属与氢形成似盐氢化物。像典型的无机盐一样,似盐型氢化物是 非挥发性、不导电并具有明确结构的晶形固体(例如碱金属氢化物为 NaCl 结构)。 ★ 似盐型氢化物通常不溶于非水溶剂,但溶于碱金属的熔融卤化物。电解这种熔体时 在阳极放 H2,这是 H 以负离子形式存在的重要化学证据。 2H- → H2+2e – ★ 似盐型氢化物与水反应生成金属氢氧化物并同时放出 H2。例如: NaH(s)+H2O(l)====H2(g)+NaOH(aq) CaH2(s)+2H2O(l)====2H2(g)+Ca(OH)2(s) 似盐型氢化物在实验室用来除去有机溶溶剂和惰性气体(如 N2,Ar)中的微量水,这 种场合往往选用 CaH2。由于缺乏适合的溶剂,似盐氢化物难以广泛用做化学试剂。不过, 将其制成油悬浮体可使这一困难部分地得以克服。 17.3.2 金属型氢化物 第 3 至第 5 族 d 区金属全都形成这类氢化物,而第 6 族元素形成金属型氢化物的只有铬。 第 7 至第 9 族所有元素均未发现有氢化物相,这三族元素所在的区域有时被叫做氢化物空白 带。第 10 族金属特别是镍和铂是加氢反应的有效催化剂。形成氢化物相意味着金属中原有 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R 势 能 H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R H–H 键焓 D–D 键焓 H2的零点能 D2的零点能 H2, D2分子的势能曲线 R
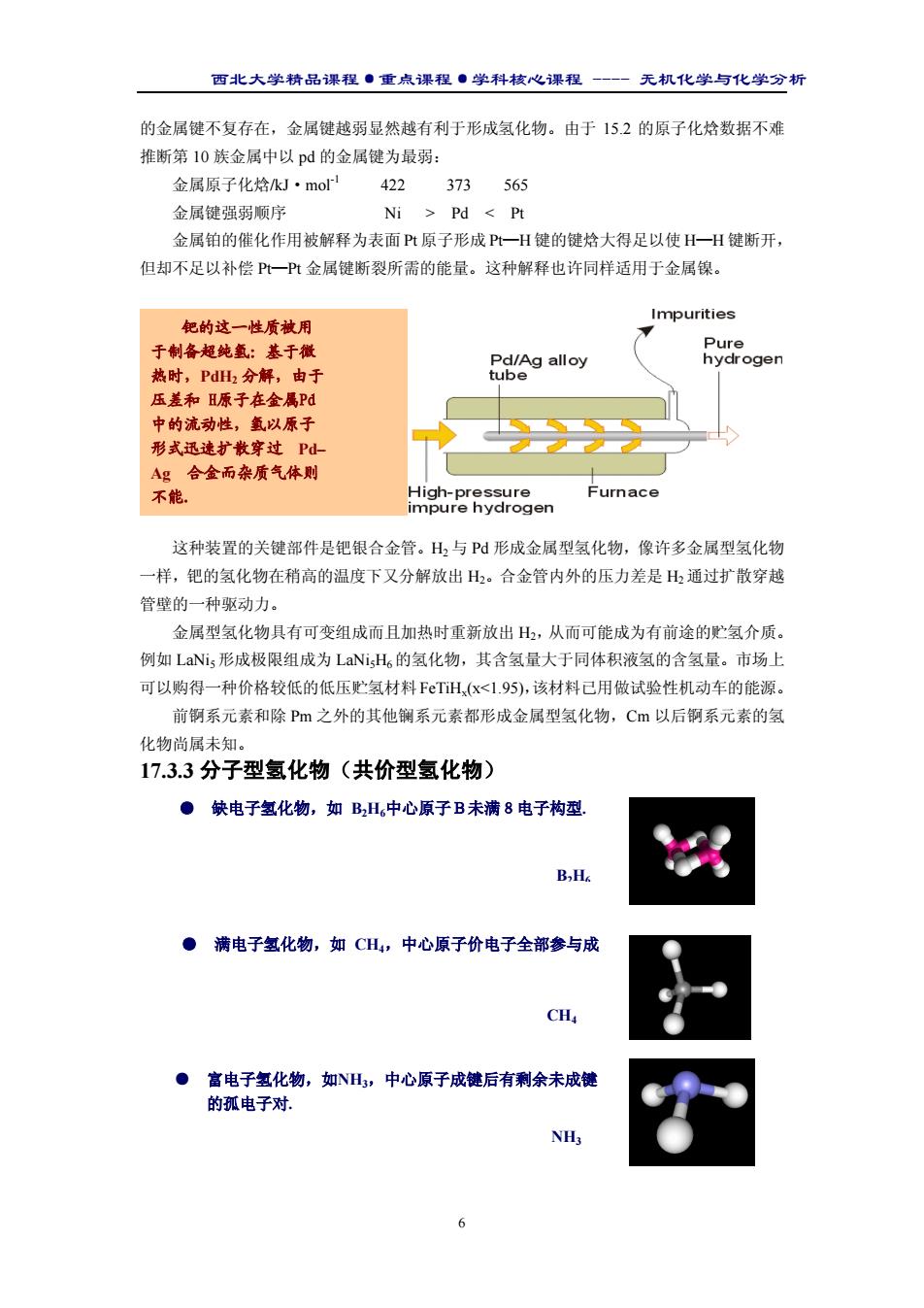
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 的金属键不复存在,金属键越弱显然越有利于形成氢化物。由于 15.2 的原子化焓数据不难 推断第 10 族金属中以 pd 的金属键为最弱: 金属原子化焓/kJ·mol-1 422 373 565 金属键强弱顺序 Ni > Pd < Pt 金属铂的催化作用被解释为表面 Pt 原子形成 Pt—H 键的键焓大得足以使 H—H 键断开, 但却不足以补偿 Pt—Pt 金属键断裂所需的能量。这种解释也许同样适用于金属镍。 这种装置的关键部件是钯银合金管。H2 与 Pd 形成金属型氢化物,像许多金属型氢化物 一样,钯的氢化物在稍高的温度下又分解放出 H2。合金管内外的压力差是 H2 通过扩散穿越 管壁的一种驱动力。 金属型氢化物具有可变组成而且加热时重新放出 H2,从而可能成为有前途的贮氢介质。 例如 LaNi5 形成极限组成为 LaNi5H6的氢化物,其含氢量大于同体积液氢的含氢量。市场上 可以购得一种价格较低的低压贮氢材料FeTiHx(x<1.95),该材料已用做试验性机动车的能源。 前锕系元素和除 Pm 之外的其他镧系元素都形成金属型氢化物,Cm 以后锕系元素的氢 化物尚属未知。 17.3.3 分子型氢化物(共价型氢化物) 钯的这一性质被用 于制备超纯氢:基于微 热时,PdH2 分解,由于 压差和 H原子在金属Pd 中的流动性,氢以原子 形式迅速扩散穿过 Pd– Ag 合金而杂质气体则 不能. ● 缺电子氢化物,如 B2H6中心原子B未满8电子构型. B2H6 ● 满电子氢化物,如 CH4,中心原子价电子全部参与成 CH4 ● 富电子氢化物,如NH3,中心原子成键后有剩余未成键 的孤电子对. NH3
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 的金属键不复存在,金属键越弱显然越有利于形成氢化物。由于 15.2 的原子化焓数据不难 推断第 10 族金属中以 pd 的金属键为最弱: 金属原子化焓/kJ·mol-1 422 373 565 金属键强弱顺序 Ni > Pd < Pt 金属铂的催化作用被解释为表面 Pt 原子形成 Pt—H 键的键焓大得足以使 H—H 键断开, 但却不足以补偿 Pt—Pt 金属键断裂所需的能量。这种解释也许同样适用于金属镍。 这种装置的关键部件是钯银合金管。H2 与 Pd 形成金属型氢化物,像许多金属型氢化物 一样,钯的氢化物在稍高的温度下又分解放出 H2。合金管内外的压力差是 H2 通过扩散穿越 管壁的一种驱动力。 金属型氢化物具有可变组成而且加热时重新放出 H2,从而可能成为有前途的贮氢介质。 例如 LaNi5 形成极限组成为 LaNi5H6的氢化物,其含氢量大于同体积液氢的含氢量。市场上 可以购得一种价格较低的低压贮氢材料FeTiHx(x<1.95),该材料已用做试验性机动车的能源。 前锕系元素和除 Pm 之外的其他镧系元素都形成金属型氢化物,Cm 以后锕系元素的氢 化物尚属未知。 17.3.3 分子型氢化物(共价型氢化物) 钯的这一性质被用 于制备超纯氢:基于微 热时,PdH2 分解,由于 压差和 H原子在金属Pd 中的流动性,氢以原子 形式迅速扩散穿过 Pd– Ag 合金而杂质气体则 不能. ● 缺电子氢化物,如 B2H6中心原子B未满8电子构型. B2H6 ● 满电子氢化物,如 CH4,中心原子价电子全部参与成 CH4 ● 富电子氢化物,如NH3,中心原子成键后有剩余未成键 的孤电子对. NH3

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 17.4 氢的性质和反应 氢在标准状况下稳定形式为 H2。H2 的名称为“二氢”(dihydrogen),通常非正式地称 做“氢”。 H2 分子间的色散力极弱,常压下的液化温度低达 20K。H—H 键的键焓很高 (436kJ·mol-1)而且核间距很小(74pm),因而平常状态下的反应活性并不高。 稀薄的氢气在高压放电条件下发生解离、电离以及物种之间的重新结合形成等离子体, 其中含有光谱上可以检测出的 H,H+ 和 H3 + 。H3 + 是 H+ 与 H2 结合而成的,光谱数据表明它具 有等边三角形结构,该物种应是三中心二电子键最简单的例子。 17.4.1 H2反应热力学 二元氢化合物的标准生成自由能(ΛfGm θ )是判断氢与其他元素直接化合反应的重要判 据。自然,标准生成自由能为正值的氢化合物都不能由单质之间的反应合成。 S 区金属在室温下大都可以与 H2 直接反应形成热力学上稳定的氢化物,也许只有铍例 外(表中 BeH2 的标准生成自由能数据不甚可靠)。第 13 族ΛfGm θ 值变化不规则,似乎只有 AlH3 的形成是放能过程,第 14 至第 17 族第一个元素与 H2 形成氢化合物时都是放能过程, 同族氢化合物由上而下越来越变得不稳定。稳定性的这种变化趋势可由下列平均键焓(单位 为 kJ·mol-1)数据作解释: CH4 NH3 H2O HF 402 391 463 568 SiH4 PH3 H2S HCl 323 321 368 432 GeH4 AsH3 H2Se HBr 289 297 312 366 SnH4 SbH3 H2Te HI 253 257 267 351
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 17.4 氢的性质和反应 氢在标准状况下稳定形式为 H2。H2 的名称为“二氢”(dihydrogen),通常非正式地称 做“氢”。 H2 分子间的色散力极弱,常压下的液化温度低达 20K。H—H 键的键焓很高 (436kJ·mol-1)而且核间距很小(74pm),因而平常状态下的反应活性并不高。 稀薄的氢气在高压放电条件下发生解离、电离以及物种之间的重新结合形成等离子体, 其中含有光谱上可以检测出的 H,H+ 和 H3 + 。H3 + 是 H+ 与 H2 结合而成的,光谱数据表明它具 有等边三角形结构,该物种应是三中心二电子键最简单的例子。 17.4.1 H2反应热力学 二元氢化合物的标准生成自由能(ΛfGm θ )是判断氢与其他元素直接化合反应的重要判 据。自然,标准生成自由能为正值的氢化合物都不能由单质之间的反应合成。 S 区金属在室温下大都可以与 H2 直接反应形成热力学上稳定的氢化物,也许只有铍例 外(表中 BeH2 的标准生成自由能数据不甚可靠)。第 13 族ΛfGm θ 值变化不规则,似乎只有 AlH3 的形成是放能过程,第 14 至第 17 族第一个元素与 H2 形成氢化合物时都是放能过程, 同族氢化合物由上而下越来越变得不稳定。稳定性的这种变化趋势可由下列平均键焓(单位 为 kJ·mol-1)数据作解释: CH4 NH3 H2O HF 402 391 463 568 SiH4 PH3 H2S HCl 323 321 368 432 GeH4 AsH3 H2Se HBr 289 297 312 366 SnH4 SbH3 H2Te HI 253 257 267 351
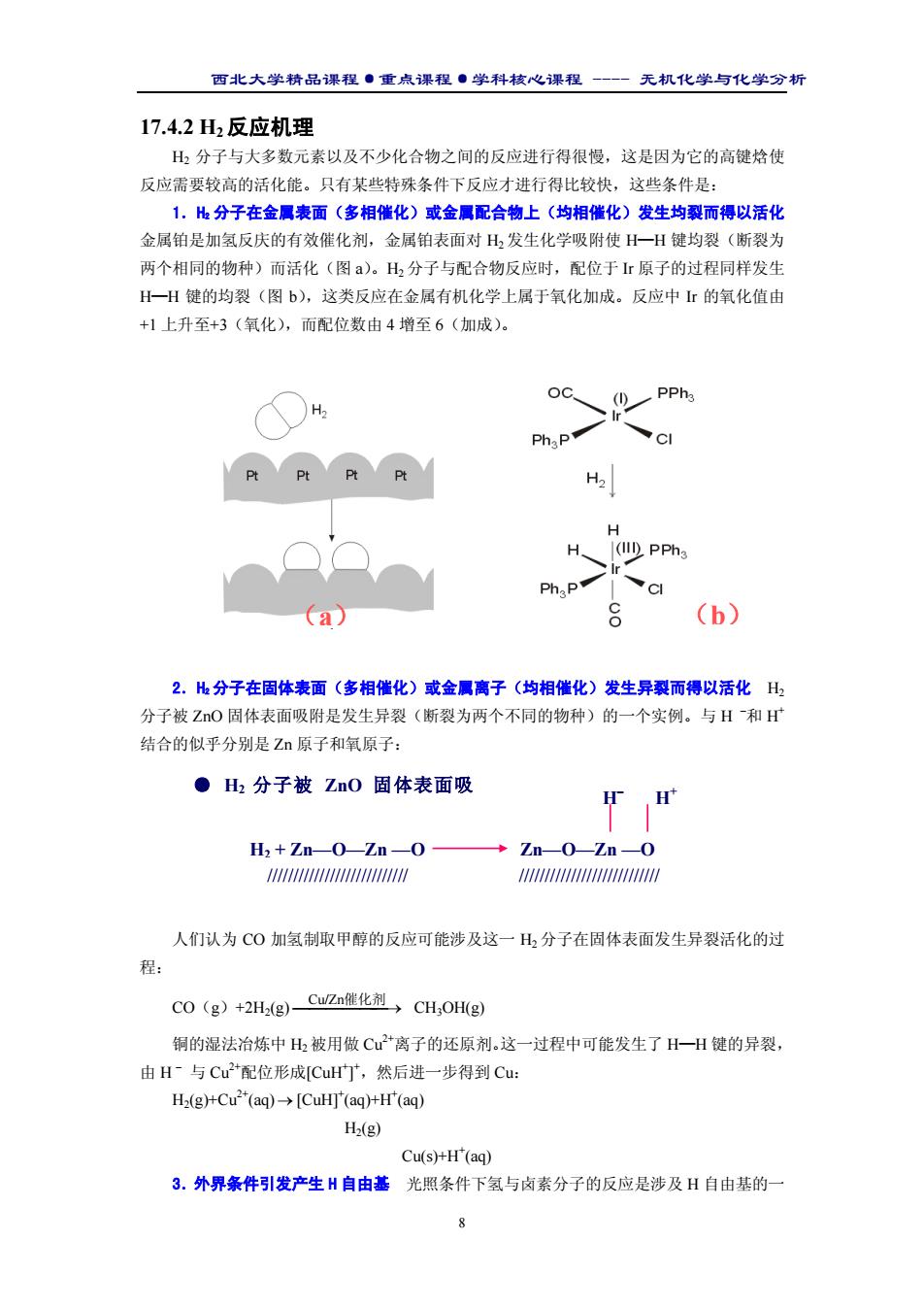
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 17.4.2 H2反应机理 H2 分子与大多数元素以及不少化合物之间的反应进行得很慢,这是因为它的高键焓使 反应需要较高的活化能。只有某些特殊条件下反应才进行得比较快,这些条件是: 1.H2 分子在金属表面(多相催化)或金属配合物上(均相催化)发生均裂而得以活化 金属铂是加氢反庆的有效催化剂,金属铂表面对 H2 发生化学吸附使 H—H 键均裂(断裂为 两个相同的物种)而活化(图 a)。H2 分子与配合物反应时,配位于 Ir 原子的过程同样发生 H—H 键的均裂(图 b),这类反应在金属有机化学上属于氧化加成。反应中 Ir 的氧化值由 +1 上升至+3(氧化),而配位数由 4 增至 6(加成)。 2.H2 分子在固体表面(多相催化)或金属离子(均相催化)发生异裂而得以活化 H2 分子被 ZnO 固体表面吸附是发生异裂(断裂为两个不同的物种)的一个实例。与 H – 和 H+ 结合的似乎分别是 Zn 原子和氧原子: 人们认为 CO 加氢制取甲醇的反应可能涉及这一 H2 分子在固体表面发生异裂活化的过 程: CO(g)+2H2(g) → Cu/Zn催化剂 CH3OH(g) 铜的湿法冶炼中 H2 被用做 Cu2+离子的还原剂。这一过程中可能发生了 H—H 键的异裂, 由 H – 与 Cu2+配位形成[CuH+ ] + ,然后进一步得到 Cu: H2(g)+Cu2+(aq)→ [CuH]+ (aq)+H+ (aq) H2(g) Cu(s)+H+ (aq) 3.外界条件引发产生 H 自由基 光照条件下氢与卤素分子的反应是涉及 H 自由基的一 (a) (b) ● H2 分子被 ZnO 固体表面吸 H2 + Zn—O—Zn —O Zn—O—Zn —O H– H+ /////////////////////////// ///////////////////////////
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 17.4.2 H2反应机理 H2 分子与大多数元素以及不少化合物之间的反应进行得很慢,这是因为它的高键焓使 反应需要较高的活化能。只有某些特殊条件下反应才进行得比较快,这些条件是: 1.H2 分子在金属表面(多相催化)或金属配合物上(均相催化)发生均裂而得以活化 金属铂是加氢反庆的有效催化剂,金属铂表面对 H2 发生化学吸附使 H—H 键均裂(断裂为 两个相同的物种)而活化(图 a)。H2 分子与配合物反应时,配位于 Ir 原子的过程同样发生 H—H 键的均裂(图 b),这类反应在金属有机化学上属于氧化加成。反应中 Ir 的氧化值由 +1 上升至+3(氧化),而配位数由 4 增至 6(加成)。 2.H2 分子在固体表面(多相催化)或金属离子(均相催化)发生异裂而得以活化 H2 分子被 ZnO 固体表面吸附是发生异裂(断裂为两个不同的物种)的一个实例。与 H – 和 H+ 结合的似乎分别是 Zn 原子和氧原子: 人们认为 CO 加氢制取甲醇的反应可能涉及这一 H2 分子在固体表面发生异裂活化的过 程: CO(g)+2H2(g) → Cu/Zn催化剂 CH3OH(g) 铜的湿法冶炼中 H2 被用做 Cu2+离子的还原剂。这一过程中可能发生了 H—H 键的异裂, 由 H – 与 Cu2+配位形成[CuH+ ] + ,然后进一步得到 Cu: H2(g)+Cu2+(aq)→ [CuH]+ (aq)+H+ (aq) H2(g) Cu(s)+H+ (aq) 3.外界条件引发产生 H 自由基 光照条件下氢与卤素分子的反应是涉及 H 自由基的一 (a) (b) ● H2 分子被 ZnO 固体表面吸 H2 + Zn—O—Zn —O Zn—O—Zn —O H– H+ /////////////////////////// ///////////////////////////

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 个实例(第 14 章),H2 与 O2 生成 H2O 反应 2H2(g)+O2(g)===2H2O(l) 也涉及 H 自由基。该反应也许是学生最早学到的化学反应,但他们当时肯定不会相到反应 过程的复杂性。这种复杂性的外在现象之一是,爆鸣气(气体 H2与 O2以 2:1 体积比构成 的混合物)在某种恒定温度下的反应速率随太力增大发生不规则变化。例如 500℃时的反应 速率随压力增高两次经过平缓反应区和爆炸反应区: 人们将这种复杂性归画面于链反应机理。H2(g)与 O2(g)之间的反应既涉及简单链增殖 (即一个自由基引发产生一个自由基): ·OH+H2→ H2O+·H 也涉及分支链增殖(即一个自由基引发科生一个以上自由基): ·H+O2→ ·OH+·O· ·O·+H2→ ·OH+H· 如果自由基增殖速率大于淬灭(自由基通过与器壁或其他反应物种碰撞而消失)速率即 导致爆炸,相反的情况下则反应平缓。不同的温度和压力条件对增殖速率和淬灭速率的影响 不同,从而导致反应速率的不规则变化。混合气体中两种气体的相对含量也影响反应速成率 的特征,H2 的体积百分数ф94%时体系不发生爆炸,这两个数值分别称做“爆炸 低限”和“爆炸高限”。H2 与空气混合物的爆炸低限和爆炸高限分别为ф=4.1%和ф=74%。 17.4.3 H2分子配合物 上述机理毫无例外地涉及 H—H 键的断裂,是否存在 H—H 键在反应中被活化而不断裂 的情况呢? 1985 年发现了第一个以 H2 分子为配体的配合物 W(CO)3[P(C3H7)3]2(η2 —H2),这一 发现强烈暗示存在这种可能性
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 个实例(第 14 章),H2 与 O2 生成 H2O 反应 2H2(g)+O2(g)===2H2O(l) 也涉及 H 自由基。该反应也许是学生最早学到的化学反应,但他们当时肯定不会相到反应 过程的复杂性。这种复杂性的外在现象之一是,爆鸣气(气体 H2与 O2以 2:1 体积比构成 的混合物)在某种恒定温度下的反应速率随太力增大发生不规则变化。例如 500℃时的反应 速率随压力增高两次经过平缓反应区和爆炸反应区: 人们将这种复杂性归画面于链反应机理。H2(g)与 O2(g)之间的反应既涉及简单链增殖 (即一个自由基引发产生一个自由基): ·OH+H2→ H2O+·H 也涉及分支链增殖(即一个自由基引发科生一个以上自由基): ·H+O2→ ·OH+·O· ·O·+H2→ ·OH+H· 如果自由基增殖速率大于淬灭(自由基通过与器壁或其他反应物种碰撞而消失)速率即 导致爆炸,相反的情况下则反应平缓。不同的温度和压力条件对增殖速率和淬灭速率的影响 不同,从而导致反应速率的不规则变化。混合气体中两种气体的相对含量也影响反应速成率 的特征,H2 的体积百分数ф94%时体系不发生爆炸,这两个数值分别称做“爆炸 低限”和“爆炸高限”。H2 与空气混合物的爆炸低限和爆炸高限分别为ф=4.1%和ф=74%。 17.4.3 H2分子配合物 上述机理毫无例外地涉及 H—H 键的断裂,是否存在 H—H 键在反应中被活化而不断裂 的情况呢? 1985 年发现了第一个以 H2 分子为配体的配合物 W(CO)3[P(C3H7)3]2(η2 —H2),这一 发现强烈暗示存在这种可能性
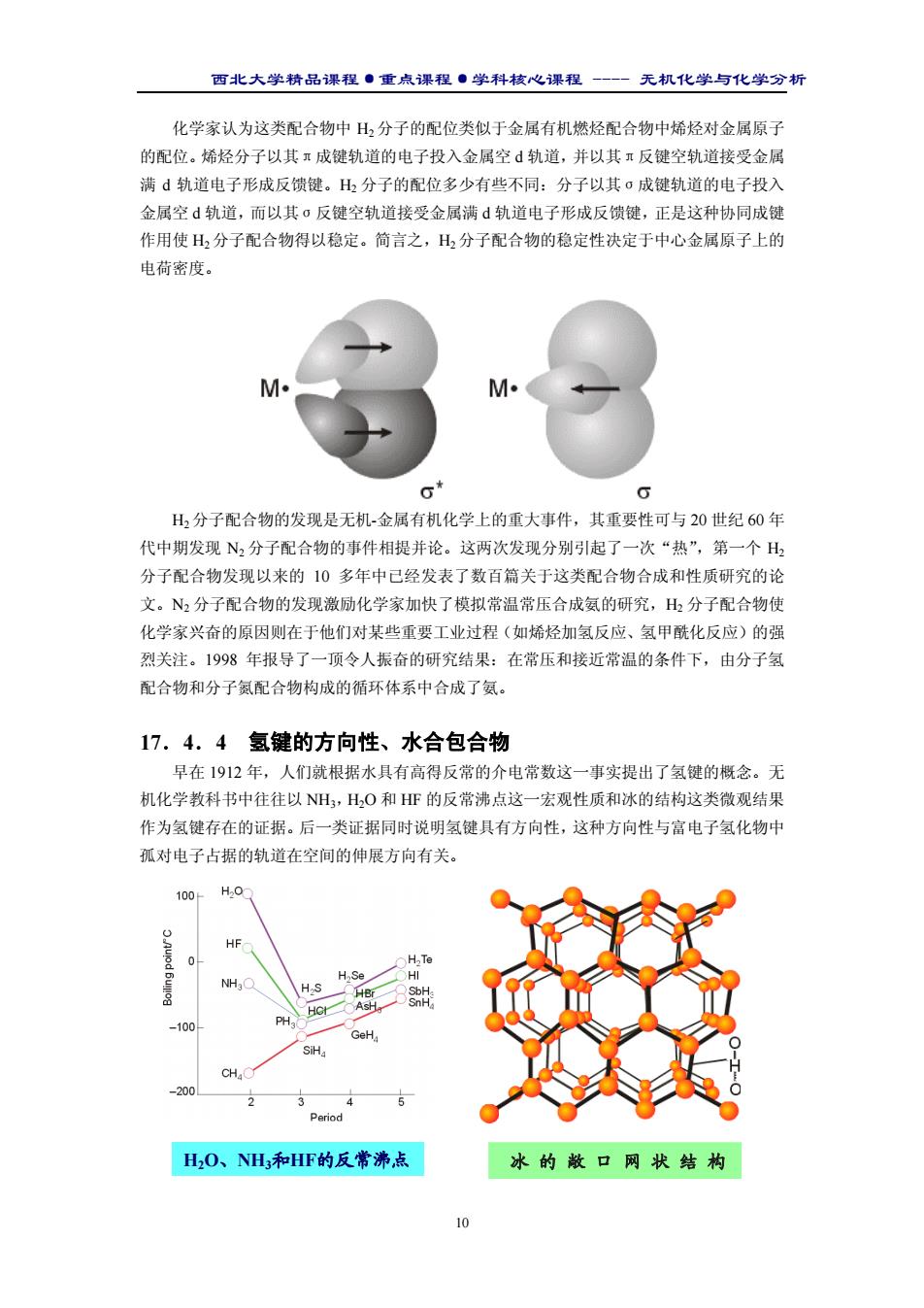
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 化学家认为这类配合物中 H2 分子的配位类似于金属有机燃烃配合物中烯烃对金属原子 的配位。烯烃分子以其π成键轨道的电子投入金属空 d 轨道,并以其π反键空轨道接受金属 满 d 轨道电子形成反馈键。H2 分子的配位多少有些不同:分子以其σ成键轨道的电子投入 金属空 d 轨道,而以其σ反键空轨道接受金属满 d 轨道电子形成反馈键,正是这种协同成键 作用使 H2 分子配合物得以稳定。简言之,H2 分子配合物的稳定性决定于中心金属原子上的 电荷密度。 H2 分子配合物的发现是无机-金属有机化学上的重大事件,其重要性可与 20 世纪 60 年 代中期发现 N2 分子配合物的事件相提并论。这两次发现分别引起了一次“热”,第一个 H2 分子配合物发现以来的 10 多年中已经发表了数百篇关于这类配合物合成和性质研究的论 文。N2 分子配合物的发现激励化学家加快了模拟常温常压合成氨的研究,H2 分子配合物使 化学家兴奋的原因则在于他们对某些重要工业过程(如烯烃加氢反应、氢甲酰化反应)的强 烈关注。1998 年报导了一顶令人振奋的研究结果:在常压和接近常温的条件下,由分子氢 配合物和分子氮配合物构成的循环体系中合成了氨。 17.4.4 氢键的方向性、水合包合物 早在 1912 年,人们就根据水具有高得反常的介电常数这一事实提出了氢键的概念。无 机化学教科书中往往以 NH3,H2O 和 HF 的反常沸点这一宏观性质和冰的结构这类微观结果 作为氢键存在的证据。后一类证据同时说明氢键具有方向性,这种方向性与富电子氢化物中 孤对电子占据的轨道在空间的伸展方向有关。 H2O、NH3和HF的反常沸点 冰 的 敞 口 网 状 结 构
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 化学家认为这类配合物中 H2 分子的配位类似于金属有机燃烃配合物中烯烃对金属原子 的配位。烯烃分子以其π成键轨道的电子投入金属空 d 轨道,并以其π反键空轨道接受金属 满 d 轨道电子形成反馈键。H2 分子的配位多少有些不同:分子以其σ成键轨道的电子投入 金属空 d 轨道,而以其σ反键空轨道接受金属满 d 轨道电子形成反馈键,正是这种协同成键 作用使 H2 分子配合物得以稳定。简言之,H2 分子配合物的稳定性决定于中心金属原子上的 电荷密度。 H2 分子配合物的发现是无机-金属有机化学上的重大事件,其重要性可与 20 世纪 60 年 代中期发现 N2 分子配合物的事件相提并论。这两次发现分别引起了一次“热”,第一个 H2 分子配合物发现以来的 10 多年中已经发表了数百篇关于这类配合物合成和性质研究的论 文。N2 分子配合物的发现激励化学家加快了模拟常温常压合成氨的研究,H2 分子配合物使 化学家兴奋的原因则在于他们对某些重要工业过程(如烯烃加氢反应、氢甲酰化反应)的强 烈关注。1998 年报导了一顶令人振奋的研究结果:在常压和接近常温的条件下,由分子氢 配合物和分子氮配合物构成的循环体系中合成了氨。 17.4.4 氢键的方向性、水合包合物 早在 1912 年,人们就根据水具有高得反常的介电常数这一事实提出了氢键的概念。无 机化学教科书中往往以 NH3,H2O 和 HF 的反常沸点这一宏观性质和冰的结构这类微观结果 作为氢键存在的证据。后一类证据同时说明氢键具有方向性,这种方向性与富电子氢化物中 孤对电子占据的轨道在空间的伸展方向有关。 H2O、NH3和HF的反常沸点 冰 的 敞 口 网 状 结 构