
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 第十二章 s 区元素 Chapter 12 s Block 教学要求 1.了解 s 区元素的物理性质和化学性质,能够解释 Li 的标准电极电势为什么最低,能解释 碱金属与水、醇和液氨反应的不同; 2.了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同; 3.了解 s 区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化规律; 4.了解 s 区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释; 5.会用离子极化理论解释碳酸盐分解规律; 6.了解对角线规则和锂、铍的特殊性。 课时分配(4 学时) 1. 概述和单质:2 学时 2. 化合物:2 学时 3. 对角线规则:1 学时 12.1 概述 alkaline metals alkaline earth matals lithium beryllium sodium magnesium potassium calcium rubidium strontium caesium barium francium radium 注意它们在周期表中的位置。所有性质的产生和变化规律皆由此而来。 s 区属元素最外层电子组态分别为 ns 1和 ns 2 ,由于受到内层电子的强烈屏蔽, 核对最外层电 子的控制较松弛。因而单质的化学性质都非常活泼, 容易失去各自的 ns 电子分别形成+1 价和+2 价阳离子, 其氧化态与各自的族号相对应。 12.2 单质 12.2.1 物理和化学性质
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 第十二章 s 区元素 Chapter 12 s Block 教学要求 1.了解 s 区元素的物理性质和化学性质,能够解释 Li 的标准电极电势为什么最低,能解释 碱金属与水、醇和液氨反应的不同; 2.了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同; 3.了解 s 区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化规律; 4.了解 s 区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释; 5.会用离子极化理论解释碳酸盐分解规律; 6.了解对角线规则和锂、铍的特殊性。 课时分配(4 学时) 1. 概述和单质:2 学时 2. 化合物:2 学时 3. 对角线规则:1 学时 12.1 概述 alkaline metals alkaline earth matals lithium beryllium sodium magnesium potassium calcium rubidium strontium caesium barium francium radium 注意它们在周期表中的位置。所有性质的产生和变化规律皆由此而来。 s 区属元素最外层电子组态分别为 ns 1和 ns 2 ,由于受到内层电子的强烈屏蔽, 核对最外层电 子的控制较松弛。因而单质的化学性质都非常活泼, 容易失去各自的 ns 电子分别形成+1 价和+2 价阳离子, 其氧化态与各自的族号相对应。 12.2 单质 12.2.1 物理和化学性质
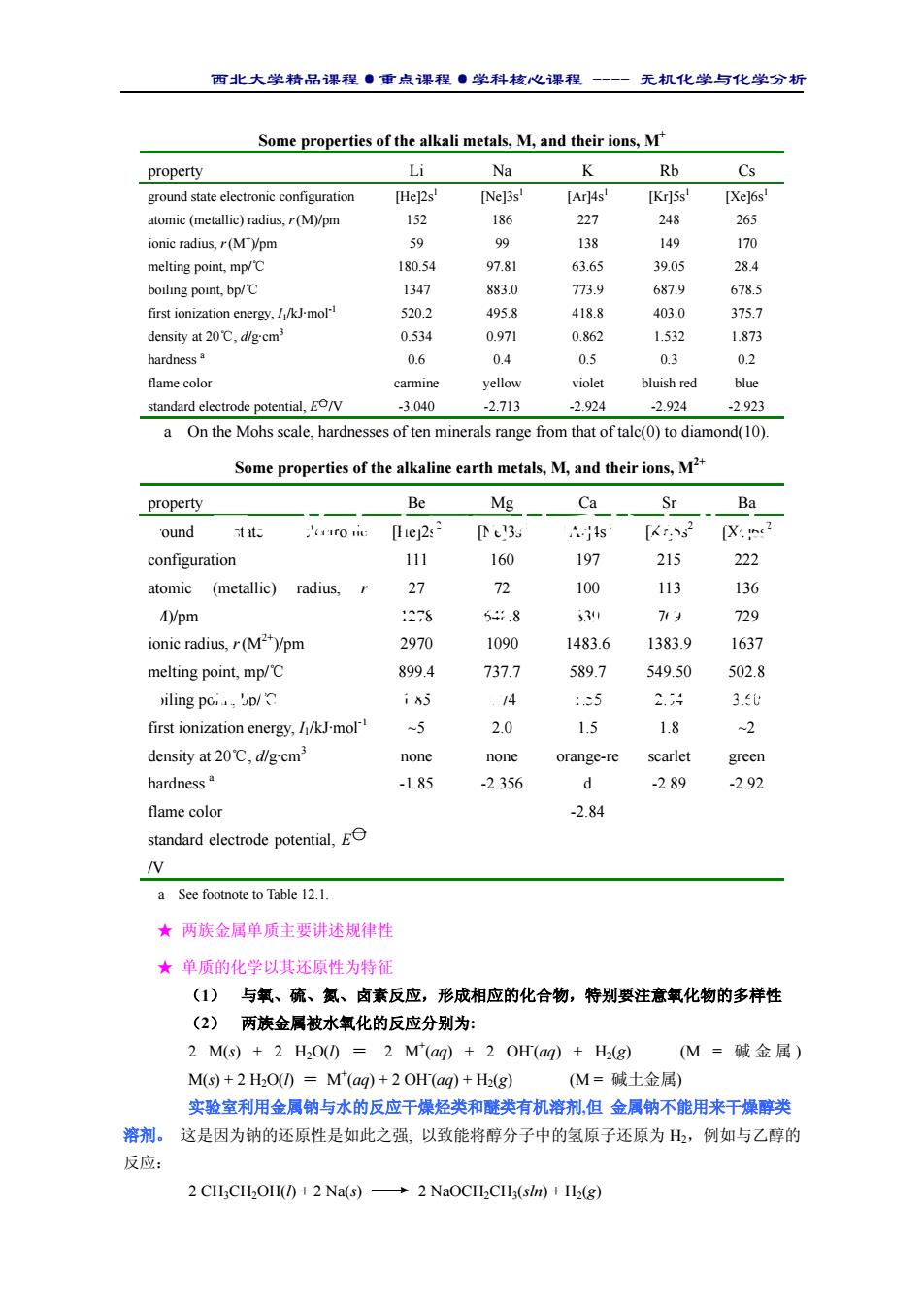
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Some properties of the alkali metals, M, and their ions, M+ property Li Na K Rb Cs ground state electronic configuration atomic (metallic) radius, r(M)/pm ionic radius, r(M+ )/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一/V [He]2s1 152 59 180.54 1347 520.2 0.534 0.6 carmine -3.040 [Ne]3s1 186 99 97.81 883.0 495.8 0.971 0.4 yellow -2.713 [Ar]4s1 227 138 63.65 773.9 418.8 0.862 0.5 violet -2.924 [Kr]5s1 248 149 39.05 687.9 403.0 1.532 0.3 bluish red -2.924 [Xe]6s1 265 170 28.4 678.5 375.7 1.873 0.2 blue -2.923 a On the Mohs scale, hardnesses of ten minerals range from that of talc(0) to diamond(10). Some properties of the alkaline earth metals, M, and their ions, M2+ property Be Mg Ca Sr Ba ground state electronic configuration atomic (metallic) radius, r (M)/pm ionic radius, r(M2+)/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一 /V [He]2s2 111 27 1278 2970 899.4 1.85 ~5 none -1.85 [Ne]3s2 160 72 648.8 1090 737.7 1.74 2.0 none -2.356 [Ar]4s2 197 100 839 1483.6 589.7 1.55 1.5 orange-re d -2.84 [Kr]5s2 215 113 769 1383.9 549.50 2.54 1.8 scarlet -2.89 [Xe]6s2 222 136 729 1637 502.8 3.60 ~2 green -2.92 a See footnote to Table 12.1. ★ 两族金属单质主要讲述规律性 ★ 单质的化学以其还原性为特征 (1) 与氧、硫、氮、卤素反应,形成相应的化合物,特别要注意氧化物的多样性 (2) 两族金属被水氧化的反应分别为: 2 M(s) + 2 H2O(l) = 2 M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱金属 ) M(s) + 2 H2O(l) = M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱土金属) 实验室利用金属钠与水的反应干燥烃类和醚类有机溶剂,但 金属钠不能用来干燥醇类 溶剂。 这是因为钠的还原性是如此之强, 以致能将醇分子中的氢原子还原为 H2,例如与乙醇的 反应: 2 CH3CH2OH(l) + 2 Na(s) 2 NaOCH2CH3(sln) + H2(g) ● 形成的化合物大多是离子型的 ● 通常只有一种稳定的氧化态 ● 同一族自上而下性质的变化有规律
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Some properties of the alkali metals, M, and their ions, M+ property Li Na K Rb Cs ground state electronic configuration atomic (metallic) radius, r(M)/pm ionic radius, r(M+ )/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一/V [He]2s1 152 59 180.54 1347 520.2 0.534 0.6 carmine -3.040 [Ne]3s1 186 99 97.81 883.0 495.8 0.971 0.4 yellow -2.713 [Ar]4s1 227 138 63.65 773.9 418.8 0.862 0.5 violet -2.924 [Kr]5s1 248 149 39.05 687.9 403.0 1.532 0.3 bluish red -2.924 [Xe]6s1 265 170 28.4 678.5 375.7 1.873 0.2 blue -2.923 a On the Mohs scale, hardnesses of ten minerals range from that of talc(0) to diamond(10). Some properties of the alkaline earth metals, M, and their ions, M2+ property Be Mg Ca Sr Ba ground state electronic configuration atomic (metallic) radius, r (M)/pm ionic radius, r(M2+)/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I1/kJ·mol-1 density at 20℃, d/g·cm3 hardness a flame color standard electrode potential, E○一 /V [He]2s2 111 27 1278 2970 899.4 1.85 ~5 none -1.85 [Ne]3s2 160 72 648.8 1090 737.7 1.74 2.0 none -2.356 [Ar]4s2 197 100 839 1483.6 589.7 1.55 1.5 orange-re d -2.84 [Kr]5s2 215 113 769 1383.9 549.50 2.54 1.8 scarlet -2.89 [Xe]6s2 222 136 729 1637 502.8 3.60 ~2 green -2.92 a See footnote to Table 12.1. ★ 两族金属单质主要讲述规律性 ★ 单质的化学以其还原性为特征 (1) 与氧、硫、氮、卤素反应,形成相应的化合物,特别要注意氧化物的多样性 (2) 两族金属被水氧化的反应分别为: 2 M(s) + 2 H2O(l) = 2 M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱金属 ) M(s) + 2 H2O(l) = M+ (aq) + 2 OH- (aq) + H2(g) (M = 碱土金属) 实验室利用金属钠与水的反应干燥烃类和醚类有机溶剂,但 金属钠不能用来干燥醇类 溶剂。 这是因为钠的还原性是如此之强, 以致能将醇分子中的氢原子还原为 H2,例如与乙醇的 反应: 2 CH3CH2OH(l) + 2 Na(s) 2 NaOCH2CH3(sln) + H2(g) ● 形成的化合物大多是离子型的 ● 通常只有一种稳定的氧化态 ● 同一族自上而下性质的变化有规律

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 金属钠与卤代溶剂发生的反应十分猛烈, 因而也不能用来干燥这类溶剂。 例如, 与 CCl4 发生的反应为: CCl4(l) + 4 Na(s) 4 NaCl(s) + C(s) △rG○一 m = -249 kJ·mol-1 (3)两族元素的单质都是强还原剂。 以热化学循环讲述。 (4) 属钠与液氨之间发生非常独特的反应。 钠溶于液氨的反应如下: Na(s) + x NH3(l) Na+ (am) + e - (am) 水合电子 Selected reactions of the alkali metals M3 M3N (M = M MNH2 + MOH + 汞 MX (X = 卤 M2O (M = Li, M2C M+ (am) + e - M2 M2O2 (M = Na, K, MO2 (M = K, Rb, P N MH3(溶液或气 H2 M X S 液 有 Fe H O O2 + C
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 金属钠与卤代溶剂发生的反应十分猛烈, 因而也不能用来干燥这类溶剂。 例如, 与 CCl4 发生的反应为: CCl4(l) + 4 Na(s) 4 NaCl(s) + C(s) △rG○一 m = -249 kJ·mol-1 (3)两族元素的单质都是强还原剂。 以热化学循环讲述。 (4) 属钠与液氨之间发生非常独特的反应。 钠溶于液氨的反应如下: Na(s) + x NH3(l) Na+ (am) + e - (am) 水合电子 Selected reactions of the alkali metals M3 M3N (M = M MNH2 + MOH + 汞 MX (X = 卤 M2O (M = Li, M2C M+ (am) + e - M2 M2O2 (M = Na, K, MO2 (M = K, Rb, P N MH3(溶液或气 H2 M X S 液 有 Fe H O O2 + C

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Selected reactions of the alkaline earth metals 12.2.2 矿物资源和金属单质制备 由于对水和氧的高度活泼性, s 区金属元素只能以化合物形式存在于自然界。 其中有些元素 在地壳中的丰度相当高,例如钙、钠、镁、钾的丰度分别排在第 5,第 6,第 7 和第 8 位。 ★ 金属锂、金属钠和占总产量 80%的金属镁用熔盐电解法生产。 电解反应如下: 阳极: 2 Cl- Cl2 + 2 e - 阴极: 2 Li+ + 2 e - 2 Li 总反应: 2 LiCl 2 Li + Cl2 ★ 热还原法用来生产金属钾和金属钙。 MO2 (M = Ba), MO MH2 (M = Ca, Sr, Ba) M(NH2)2 + H2 HMO2 - + H2 (M = Be) N H2O 水蒸气 M O2 NH3 MX2 NaOH M3N2 (M = Mg) M(OH)2 + H2 (M = Ca, Sr, Ba) MO + H2 (M = Be, Mg)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Selected reactions of the alkaline earth metals 12.2.2 矿物资源和金属单质制备 由于对水和氧的高度活泼性, s 区金属元素只能以化合物形式存在于自然界。 其中有些元素 在地壳中的丰度相当高,例如钙、钠、镁、钾的丰度分别排在第 5,第 6,第 7 和第 8 位。 ★ 金属锂、金属钠和占总产量 80%的金属镁用熔盐电解法生产。 电解反应如下: 阳极: 2 Cl- Cl2 + 2 e - 阴极: 2 Li+ + 2 e - 2 Li 总反应: 2 LiCl 2 Li + Cl2 ★ 热还原法用来生产金属钾和金属钙。 MO2 (M = Ba), MO MH2 (M = Ca, Sr, Ba) M(NH2)2 + H2 HMO2 - + H2 (M = Be) N H2O 水蒸气 M O2 NH3 MX2 NaOH M3N2 (M = Mg) M(OH)2 + H2 (M = Ca, Sr, Ba) MO + H2 (M = Be, Mg)
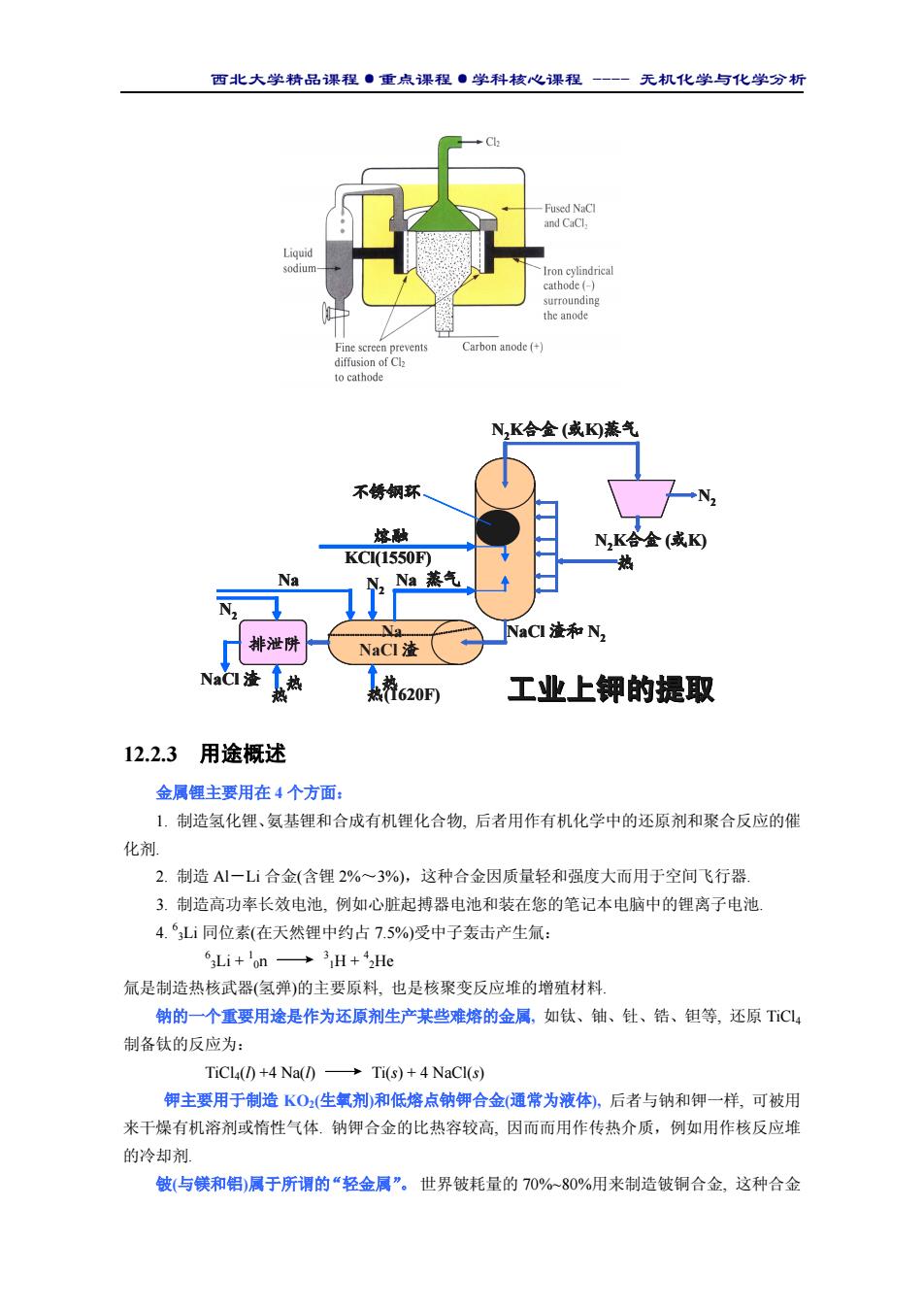
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 12.2.3 用途概述 金属锂主要用在 4 个方面: 1. 制造氢化锂、氨基锂和合成有机锂化合物, 后者用作有机化学中的还原剂和聚合反应的催 化剂. 2. 制造 Al-Li 合金(含锂 2%~3%),这种合金因质量轻和强度大而用于空间飞行器. 3. 制造高功率长效电池, 例如心脏起搏器电池和装在您的笔记本电脑中的锂离子电池. 4. 6 3Li 同位素(在天然锂中约占 7.5%)受中子轰击产生氚: 6 3Li + 1 0n 3 1H + 4 2He 氚是制造热核武器(氢弹)的主要原料, 也是核聚变反应堆的增殖材料. 钠的一个重要用途是作为还原剂生产某些难熔的金属, 如钛、铀、钍、锆、钽等, 还原 TiCl4 制备钛的反应为: TiCl4(l) +4 Na(l) Ti(s) + 4 NaCl(s) 钾主要用于制造 KO2(生氧剂)和低熔点钠钾合金(通常为液体), 后者与钠和钾一样, 可被用 来干燥有机溶剂或惰性气体. 钠钾合金的比热容较高, 因而而用作传热介质,例如用作核反应堆 的冷却剂. 铍(与镁和铝)属于所谓的“轻金属”。 世界铍耗量的 70%~80%用来制造铍铜合金, 这种合金 热 热(1620F) 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热热 热热(1620F) 工业上钾的提取 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 热 工业上钾的提取
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 12.2.3 用途概述 金属锂主要用在 4 个方面: 1. 制造氢化锂、氨基锂和合成有机锂化合物, 后者用作有机化学中的还原剂和聚合反应的催 化剂. 2. 制造 Al-Li 合金(含锂 2%~3%),这种合金因质量轻和强度大而用于空间飞行器. 3. 制造高功率长效电池, 例如心脏起搏器电池和装在您的笔记本电脑中的锂离子电池. 4. 6 3Li 同位素(在天然锂中约占 7.5%)受中子轰击产生氚: 6 3Li + 1 0n 3 1H + 4 2He 氚是制造热核武器(氢弹)的主要原料, 也是核聚变反应堆的增殖材料. 钠的一个重要用途是作为还原剂生产某些难熔的金属, 如钛、铀、钍、锆、钽等, 还原 TiCl4 制备钛的反应为: TiCl4(l) +4 Na(l) Ti(s) + 4 NaCl(s) 钾主要用于制造 KO2(生氧剂)和低熔点钠钾合金(通常为液体), 后者与钠和钾一样, 可被用 来干燥有机溶剂或惰性气体. 钠钾合金的比热容较高, 因而而用作传热介质,例如用作核反应堆 的冷却剂. 铍(与镁和铝)属于所谓的“轻金属”。 世界铍耗量的 70%~80%用来制造铍铜合金, 这种合金 热 热(1620F) 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热热 热热(1620F) 工业上钾的提取 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 N2K合金 (或K) N2 N2K合金 (或K)蒸气 排泄阱 Na NaCl 渣和 N2 NaCl 渣 KCl(1550F) 熔融 不锈钢环 NaCl 渣 N Na 蒸气 2 N2 Na 热 热 工业上钾的提取

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 主要用在各种电器设备上。 镁是最轻的一种结构金属,也是用途最大的碱土金属。 20 世纪 90 年代初期, 全世界镁耗量 估计高达 400×103 t,其 70%用于制造各种合金。 除了质轻和机械强度高之外, 镁合金还有其他 许多优良性能,因而广泛应用于航空和宇航工业。目前发射到空间轨道上的飞行器中, 镁比其他 任何金属都要多。 全世界钙的年产量不到镁的 1% ,金属钙很少用于制合金,在某些特殊金属(如锆、钍、铀、 镧系金属)和钐钴永磁合金(SmCo5)的制造中用做还原剂. 12.3 化合物 12.3.1 与氧的二元化合物 碱金属和碱土金属在通常条件下与氧形成的二元化合物可分为四大类,其通式是: 碱金属 碱土金属 氧化物 M2O (M = Li,Na) MO (M = Be, Mg, Ca, Sr, Ba) 过氧化物 M2O2 (M = Na,K,Rb,Cs) MO2 (M = Ba) 超氧化物 MO2 (M = K,Rb,Cs) 臭氧化物 MO3 (M = K,Rb,Cs) 在四类化合物中, 金属都处于各自的族氧化态. 氧的存在形式分别为 O2-, O2 2-, O2 - 和 O3 - 离 子。 原子半径最小的两个金属(Li 和 Be)显示出它们的个性, 与氧直接化合只生成氧化物。 这里 遇到一个有趣的现象:体积较大的过氧阴离子、超氧阴离子和臭氧阴离子更易被体积较大的金属 阳离子所稳定。这里体现了适用于离子型化合物的一条规律: 大阳离子稳定大阴离子, 小阳离子 稳定小阴离子。 氧化物与水反应生成各自对应的碱. 过氧化物与水或稀酸反应生成 H2O2, 例如: Na2O2 (s) + 2 H2O(l) = H2O2(aq) + 2 NaOH(aq) Na2O2(s) + H2SO4(aq) = H2O2(aq) + Na2SO4(aq) 超氧化物与水反应生成 H2O2 的同时放出 O2: 2 MO2 (s)+ 2 H2O(l) = H2O2(aq) + O2 (g)+ 2 MOH(aq) (M = K,Rb,Cs) 臭氧化物则不同,与水反应不生成 H2O2: 4 KO3 (s) + 2 H2O(l) = 4 KOH(aq) + 5 O2(g) 碱金属、碱土金属过氧化物中以 Na2O2 最重要. 它被用作高空飞行、潜水作业和地下采掘人 员的供氧剂, 这一用途的依据是, Na2O2 与人体呼出的 CO2 之间发生如下反应: 2 Na2O2 (s) + 2 CO2 (g) = O2 (g) + 2 Na2CO3 (s) 分析化学中常用 Na2O2 与矿石一起熔融使矿物氧化分解, 例如与铬铁矿一起共熔, 可将 Cr(III)氧化为 Cr(VI): 2FeO·Cr2O3(s) + 7 Na2O2(l) = Fe2O3(s) + 4 Na2CrO4(s) + 3 NaO(s) 用水浸取时, Na2CrO4 便进入溶液. Na2O2 与软锰矿共熔时, 将 MnO2 转化为可溶性的锰酸盐(Mn 氧化态为+6): MnO2(s) + Na2O2(l) = Na2MnO4(s)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 主要用在各种电器设备上。 镁是最轻的一种结构金属,也是用途最大的碱土金属。 20 世纪 90 年代初期, 全世界镁耗量 估计高达 400×103 t,其 70%用于制造各种合金。 除了质轻和机械强度高之外, 镁合金还有其他 许多优良性能,因而广泛应用于航空和宇航工业。目前发射到空间轨道上的飞行器中, 镁比其他 任何金属都要多。 全世界钙的年产量不到镁的 1% ,金属钙很少用于制合金,在某些特殊金属(如锆、钍、铀、 镧系金属)和钐钴永磁合金(SmCo5)的制造中用做还原剂. 12.3 化合物 12.3.1 与氧的二元化合物 碱金属和碱土金属在通常条件下与氧形成的二元化合物可分为四大类,其通式是: 碱金属 碱土金属 氧化物 M2O (M = Li,Na) MO (M = Be, Mg, Ca, Sr, Ba) 过氧化物 M2O2 (M = Na,K,Rb,Cs) MO2 (M = Ba) 超氧化物 MO2 (M = K,Rb,Cs) 臭氧化物 MO3 (M = K,Rb,Cs) 在四类化合物中, 金属都处于各自的族氧化态. 氧的存在形式分别为 O2-, O2 2-, O2 - 和 O3 - 离 子。 原子半径最小的两个金属(Li 和 Be)显示出它们的个性, 与氧直接化合只生成氧化物。 这里 遇到一个有趣的现象:体积较大的过氧阴离子、超氧阴离子和臭氧阴离子更易被体积较大的金属 阳离子所稳定。这里体现了适用于离子型化合物的一条规律: 大阳离子稳定大阴离子, 小阳离子 稳定小阴离子。 氧化物与水反应生成各自对应的碱. 过氧化物与水或稀酸反应生成 H2O2, 例如: Na2O2 (s) + 2 H2O(l) = H2O2(aq) + 2 NaOH(aq) Na2O2(s) + H2SO4(aq) = H2O2(aq) + Na2SO4(aq) 超氧化物与水反应生成 H2O2 的同时放出 O2: 2 MO2 (s)+ 2 H2O(l) = H2O2(aq) + O2 (g)+ 2 MOH(aq) (M = K,Rb,Cs) 臭氧化物则不同,与水反应不生成 H2O2: 4 KO3 (s) + 2 H2O(l) = 4 KOH(aq) + 5 O2(g) 碱金属、碱土金属过氧化物中以 Na2O2 最重要. 它被用作高空飞行、潜水作业和地下采掘人 员的供氧剂, 这一用途的依据是, Na2O2 与人体呼出的 CO2 之间发生如下反应: 2 Na2O2 (s) + 2 CO2 (g) = O2 (g) + 2 Na2CO3 (s) 分析化学中常用 Na2O2 与矿石一起熔融使矿物氧化分解, 例如与铬铁矿一起共熔, 可将 Cr(III)氧化为 Cr(VI): 2FeO·Cr2O3(s) + 7 Na2O2(l) = Fe2O3(s) + 4 Na2CrO4(s) + 3 NaO(s) 用水浸取时, Na2CrO4 便进入溶液. Na2O2 与软锰矿共熔时, 将 MnO2 转化为可溶性的锰酸盐(Mn 氧化态为+6): MnO2(s) + Na2O2(l) = Na2MnO4(s)

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 熔矿时要使用铁或镍制坩埚. 不能使用陶瓷、石英和铂制坩埚, 它们容易被腐蚀。 熔融的 Na2O2 遇到棉花、硫粉、铝粉等还原性物质会爆炸, 使用时要倍加小心! 12.3.2 氢氧化物 1. 除 Be(OH)2 为两性外, 其他化合物都是碱性化合物。 同一族元素的氢氧化物由上而下 碱性增大, 碱金属氢氧化物的碱性大于同周期的碱土金属元素. 2.除 LiOH 外,其他碱金属氢氧化物在水中溶解度都较大. 293K 时, 碱土金属氢氧化物在 水中的溶解度(mol·dm-1)如下: Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 8×10-6 5×10-4 1.8×10-2 6.7×10-2 2×10-1 适用性很广的一条溶解度规律是:阴、阳离子半径相差较大的离子型化合物在水中溶解度比 较大;在水中溶解度较小的离子化合物往往是阴、阳离子半径相近的化合物。 或者说,组成离 子间体积的显著差别有利于化合物在水中溶解。 12.3.3 碱金属的盐类化合物 学习过程中需要注意掌握以下要点: 1. 键型和晶型 绝大多数的碱金属形成离子型化合物,只有锂的某些盐(例如 LiCl)具有一 定程度的共价性。 2. 热稳定性 碱金属盐类通常具有较高的热稳定性, 唯有硝酸盐的热稳定性比较低, 加 热分解的过程过程中产生 O2. 这一性质使 KNO3 成为火药的一种成分: 940K 2 KNO3(s) 2 KNO2(s) + O2(g) 3. 火焰的颜色 所有碱金属元素在气化过程中都显示各自特征的火焰颜色。 例如, 将蘸 有 NaCl 的铂丝放在火焰中加热, NaCl 的离子对首先被转化为气态原子. 基态 Na(g)原子([Ne]3s 1 ) 被激发至较高能级的激发态([Ne]3p 1 ), 激发态回到基态的过程中, 发射出波长为 589nm 的黄光。 Na+ Cl- (g) Na(g) + Cl(g) Na(g) Na*(g) Na*(g) Na(g) + hν 其他碱金属元素的颜色为: Li,梅红色;K,紫色;Rb,红紫色;Cs,蓝色. 火焰颜色被用 于这些离子的定性检出, 也是原子吸收光谱法测定这些元素含量的基础
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 熔矿时要使用铁或镍制坩埚. 不能使用陶瓷、石英和铂制坩埚, 它们容易被腐蚀。 熔融的 Na2O2 遇到棉花、硫粉、铝粉等还原性物质会爆炸, 使用时要倍加小心! 12.3.2 氢氧化物 1. 除 Be(OH)2 为两性外, 其他化合物都是碱性化合物。 同一族元素的氢氧化物由上而下 碱性增大, 碱金属氢氧化物的碱性大于同周期的碱土金属元素. 2.除 LiOH 外,其他碱金属氢氧化物在水中溶解度都较大. 293K 时, 碱土金属氢氧化物在 水中的溶解度(mol·dm-1)如下: Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 8×10-6 5×10-4 1.8×10-2 6.7×10-2 2×10-1 适用性很广的一条溶解度规律是:阴、阳离子半径相差较大的离子型化合物在水中溶解度比 较大;在水中溶解度较小的离子化合物往往是阴、阳离子半径相近的化合物。 或者说,组成离 子间体积的显著差别有利于化合物在水中溶解。 12.3.3 碱金属的盐类化合物 学习过程中需要注意掌握以下要点: 1. 键型和晶型 绝大多数的碱金属形成离子型化合物,只有锂的某些盐(例如 LiCl)具有一 定程度的共价性。 2. 热稳定性 碱金属盐类通常具有较高的热稳定性, 唯有硝酸盐的热稳定性比较低, 加 热分解的过程过程中产生 O2. 这一性质使 KNO3 成为火药的一种成分: 940K 2 KNO3(s) 2 KNO2(s) + O2(g) 3. 火焰的颜色 所有碱金属元素在气化过程中都显示各自特征的火焰颜色。 例如, 将蘸 有 NaCl 的铂丝放在火焰中加热, NaCl 的离子对首先被转化为气态原子. 基态 Na(g)原子([Ne]3s 1 ) 被激发至较高能级的激发态([Ne]3p 1 ), 激发态回到基态的过程中, 发射出波长为 589nm 的黄光。 Na+ Cl- (g) Na(g) + Cl(g) Na(g) Na*(g) Na*(g) Na(g) + hν 其他碱金属元素的颜色为: Li,梅红色;K,紫色;Rb,红紫色;Cs,蓝色. 火焰颜色被用 于这些离子的定性检出, 也是原子吸收光谱法测定这些元素含量的基础
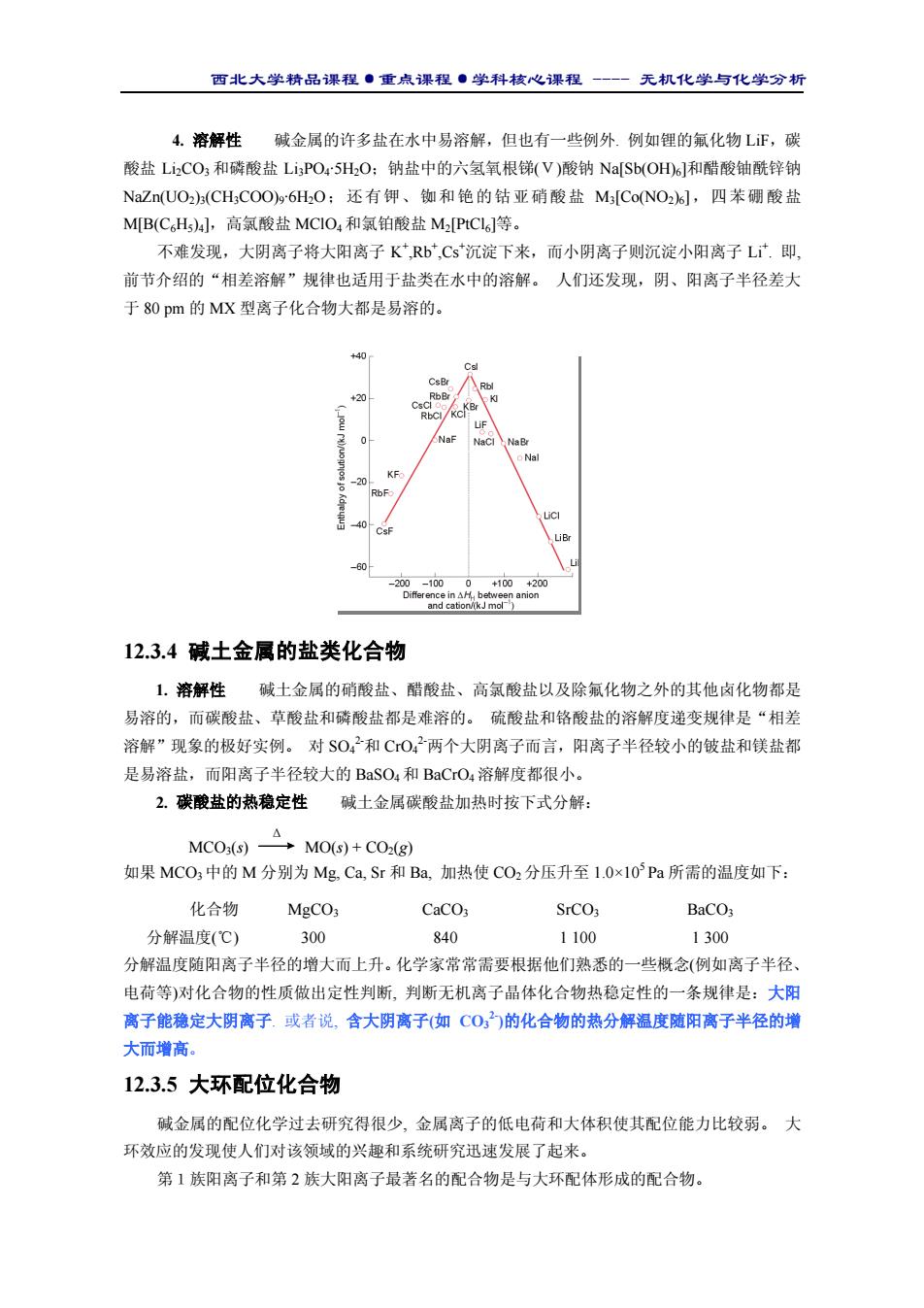
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4. 溶解性 碱金属的许多盐在水中易溶解,但也有一些例外. 例如锂的氟化物 LiF,碳 酸盐 Li2CO3 和磷酸盐 Li3PO4·5H2O;钠盐中的六氢氧根锑(V)酸钠 Na[Sb(OH)6]和醋酸铀酰锌钠 NaZn(UO2)3(CH3COO)9·6H2O;还有钾、铷和铯的钴亚硝酸盐 M3[Co(NO2)6],四苯硼酸盐 M[B(C6H5)4],高氯酸盐 MClO4 和氯铂酸盐 M2[PtCl6]等。 不难发现,大阴离子将大阳离子 K+ ,Rb+ ,Cs+ 沉淀下来,而小阴离子则沉淀小阳离子 Li+ . 即, 前节介绍的“相差溶解”规律也适用于盐类在水中的溶解。 人们还发现,阴、阳离子半径差大 于 80 pm 的 MX 型离子化合物大都是易溶的。 12.3.4 碱土金属的盐类化合物 1. 溶解性 碱土金属的硝酸盐、醋酸盐、高氯酸盐以及除氟化物之外的其他卤化物都是 易溶的,而碳酸盐、草酸盐和磷酸盐都是难溶的。 硫酸盐和铬酸盐的溶解度递变规律是“相差 溶解”现象的极好实例。 对 SO4 2-和 CrO4 2-两个大阴离子而言,阳离子半径较小的铍盐和镁盐都 是易溶盐,而阳离子半径较大的 BaSO4 和 BaCrO4 溶解度都很小。 2. 碳酸盐的热稳定性 碱土金属碳酸盐加热时按下式分解: Δ MCO3(s) MO(s) + CO2(g) 如果 MCO3 中的 M 分别为 Mg, Ca, Sr 和 Ba, 加热使 CO2 分压升至 1.0×105 Pa 所需的温度如下: 化合物 MgCO3 CaCO3 SrCO3 BaCO3 分解温度(℃) 300 840 1 100 1 300 分解温度随阳离子半径的增大而上升。化学家常常需要根据他们熟悉的一些概念(例如离子半径、 电荷等)对化合物的性质做出定性判断, 判断无机离子晶体化合物热稳定性的一条规律是:大阳 离子能稳定大阴离子. 或者说, 含大阴离子(如 CO3 2-)的化合物的热分解温度随阳离子半径的增 大而增高。 12.3.5 大环配位化合物 碱金属的配位化学过去研究得很少, 金属离子的低电荷和大体积使其配位能力比较弱。 大 环效应的发现使人们对该领域的兴趣和系统研究迅速发展了起来。 第1族阳离子和第 2 族大阳离子最著名的配合物是与大环配体形成的配合物
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4. 溶解性 碱金属的许多盐在水中易溶解,但也有一些例外. 例如锂的氟化物 LiF,碳 酸盐 Li2CO3 和磷酸盐 Li3PO4·5H2O;钠盐中的六氢氧根锑(V)酸钠 Na[Sb(OH)6]和醋酸铀酰锌钠 NaZn(UO2)3(CH3COO)9·6H2O;还有钾、铷和铯的钴亚硝酸盐 M3[Co(NO2)6],四苯硼酸盐 M[B(C6H5)4],高氯酸盐 MClO4 和氯铂酸盐 M2[PtCl6]等。 不难发现,大阴离子将大阳离子 K+ ,Rb+ ,Cs+ 沉淀下来,而小阴离子则沉淀小阳离子 Li+ . 即, 前节介绍的“相差溶解”规律也适用于盐类在水中的溶解。 人们还发现,阴、阳离子半径差大 于 80 pm 的 MX 型离子化合物大都是易溶的。 12.3.4 碱土金属的盐类化合物 1. 溶解性 碱土金属的硝酸盐、醋酸盐、高氯酸盐以及除氟化物之外的其他卤化物都是 易溶的,而碳酸盐、草酸盐和磷酸盐都是难溶的。 硫酸盐和铬酸盐的溶解度递变规律是“相差 溶解”现象的极好实例。 对 SO4 2-和 CrO4 2-两个大阴离子而言,阳离子半径较小的铍盐和镁盐都 是易溶盐,而阳离子半径较大的 BaSO4 和 BaCrO4 溶解度都很小。 2. 碳酸盐的热稳定性 碱土金属碳酸盐加热时按下式分解: Δ MCO3(s) MO(s) + CO2(g) 如果 MCO3 中的 M 分别为 Mg, Ca, Sr 和 Ba, 加热使 CO2 分压升至 1.0×105 Pa 所需的温度如下: 化合物 MgCO3 CaCO3 SrCO3 BaCO3 分解温度(℃) 300 840 1 100 1 300 分解温度随阳离子半径的增大而上升。化学家常常需要根据他们熟悉的一些概念(例如离子半径、 电荷等)对化合物的性质做出定性判断, 判断无机离子晶体化合物热稳定性的一条规律是:大阳 离子能稳定大阴离子. 或者说, 含大阴离子(如 CO3 2-)的化合物的热分解温度随阳离子半径的增 大而增高。 12.3.5 大环配位化合物 碱金属的配位化学过去研究得很少, 金属离子的低电荷和大体积使其配位能力比较弱。 大 环效应的发现使人们对该领域的兴趣和系统研究迅速发展了起来。 第1族阳离子和第 2 族大阳离子最著名的配合物是与大环配体形成的配合物

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 一类叫作冠醚(crown ether)的配位体是美国化学家佩德森(Pederson C J)于 1967 年首次报导 的, 这类具有大环结构的聚醚化合物因形似皇冠而得名。结构图.1 给出的一个例子叫 18-冠-6, 18 和 6 分别表示环原子数和环氧原子数,距离最近的 O 原子间以-CH2-CH2-相桥联。 冠醚与 碱金属离子形成相对稳定的配合物,碱金属 18-冠-6 配合物在非水溶液中几乎能无限期稳定存在。 法国化学家莱恩(Lehn J M)报道了另一类大环化合物,结构图 2 给出了一个例子. 这类化合 物中含有 O 和 N 两种杂原子,由于分子结构形似地穴,因而取名穴醚(cryptant). 碱金属阳离子 的穴醚配合物比冠醚配合物更稳定,甚至能存在于水溶液中。这显然与穴醚更接近于实现对金属 离子的完全包封有关。 作为配位体的冠醚和穴醚显示一种十分有趣的性质,即不同大小、不同形状的穴腔对碱金 属离子具有选择性。 穴醚几乎能够实现对 K+ 和 Na+ 离子的完全分离, 选择性可高达 105 :1。 对 Na+ /K+ 的选择性具有非常重要的意义,许多生理功能是靠这种选择性支持的。 大环化学的发展导致一个化学新领域的诞生,即美国化学家克拉姆(Cram D J)提出的“主- 客体化学”(host-guest chemistry). 上述大环配体和金属离子分别是“主体”和“客体”,主体根 据客体的大小、分子构型等性质对客体进行“识别”(即选择配位)形成“主-客体配合物”. 主- 客体之间这种像锁钥一样的专属性被化学家用来模拟生物体中酶与底物之间的作用 1987 年诺贝 尔化学奖授予佩德森、莱恩和克拉姆这三位化学家,以表彰他们在大环配位化学领域进行的开创 C.Pedersen 美国化学家 首次报道“冠醚” J.M.Lehn 法国生物化学家 首次报道 “ 穴 醚
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 一类叫作冠醚(crown ether)的配位体是美国化学家佩德森(Pederson C J)于 1967 年首次报导 的, 这类具有大环结构的聚醚化合物因形似皇冠而得名。结构图.1 给出的一个例子叫 18-冠-6, 18 和 6 分别表示环原子数和环氧原子数,距离最近的 O 原子间以-CH2-CH2-相桥联。 冠醚与 碱金属离子形成相对稳定的配合物,碱金属 18-冠-6 配合物在非水溶液中几乎能无限期稳定存在。 法国化学家莱恩(Lehn J M)报道了另一类大环化合物,结构图 2 给出了一个例子. 这类化合 物中含有 O 和 N 两种杂原子,由于分子结构形似地穴,因而取名穴醚(cryptant). 碱金属阳离子 的穴醚配合物比冠醚配合物更稳定,甚至能存在于水溶液中。这显然与穴醚更接近于实现对金属 离子的完全包封有关。 作为配位体的冠醚和穴醚显示一种十分有趣的性质,即不同大小、不同形状的穴腔对碱金 属离子具有选择性。 穴醚几乎能够实现对 K+ 和 Na+ 离子的完全分离, 选择性可高达 105 :1。 对 Na+ /K+ 的选择性具有非常重要的意义,许多生理功能是靠这种选择性支持的。 大环化学的发展导致一个化学新领域的诞生,即美国化学家克拉姆(Cram D J)提出的“主- 客体化学”(host-guest chemistry). 上述大环配体和金属离子分别是“主体”和“客体”,主体根 据客体的大小、分子构型等性质对客体进行“识别”(即选择配位)形成“主-客体配合物”. 主- 客体之间这种像锁钥一样的专属性被化学家用来模拟生物体中酶与底物之间的作用 1987 年诺贝 尔化学奖授予佩德森、莱恩和克拉姆这三位化学家,以表彰他们在大环配位化学领域进行的开创 C.Pedersen 美国化学家 首次报道“冠醚” J.M.Lehn 法国生物化学家 首次报道 “ 穴 醚

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 性研究工作。 D. Cram 美国有机化学家 提出“主-客体化学” (host-guest chemistry)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 性研究工作。 D. Cram 美国有机化学家 提出“主-客体化学” (host-guest chemistry)