
全程设计 第二节 离子反应 第1课时 电解质的电离
第二节 离子反应 第1课时 电解质的电离
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练
素养·目标定位 课前·基础认知 课堂·重难突破 随 堂 训 练

导期 素养·目标定位 目标素养 1.能根据电解质溶液的导电现象,学会从宏观现象辨识物质, 了解电解质的概念。 2.通过对离子产生的途径的学习,认识电解质导电的微观本质, 初步学会电离方程式的书写,并能够从电离的角度认识酸、 碱、盐
导航 目标素养 1.能根据电解质溶液的导电现象,学会从宏观现象辨识物质, 了解电解质的概念。 2.通过对离子产生的途径的学习,认识电解质导电的微观本质, 初步学会电离方程式的书写,并能够从电离的角度认识酸、 碱、盐。 素养·目标定位

导航 3通过氯化钡溶液与硫酸钠溶液的反应现象,从微观角度分析 反应实质,认识离子反应的本质,培养科学探究的能力,并学会 离子方程式的书写方法。 4.认识复分解型离子反应及置换反应型离子反应发生的条件; 能据此判断溶液中的离子能否大量共存
导航 3.通过氯化钡溶液与硫酸钠溶液的反应现象,从微观角度分析 反应实质,认识离子反应的本质,培养科学探究的能力,并学会 离子方程式的书写方法。 4.认识复分解型离子反应及置换反应型离子反应发生的条件; 能据此判断溶液中的离子能否大量共存
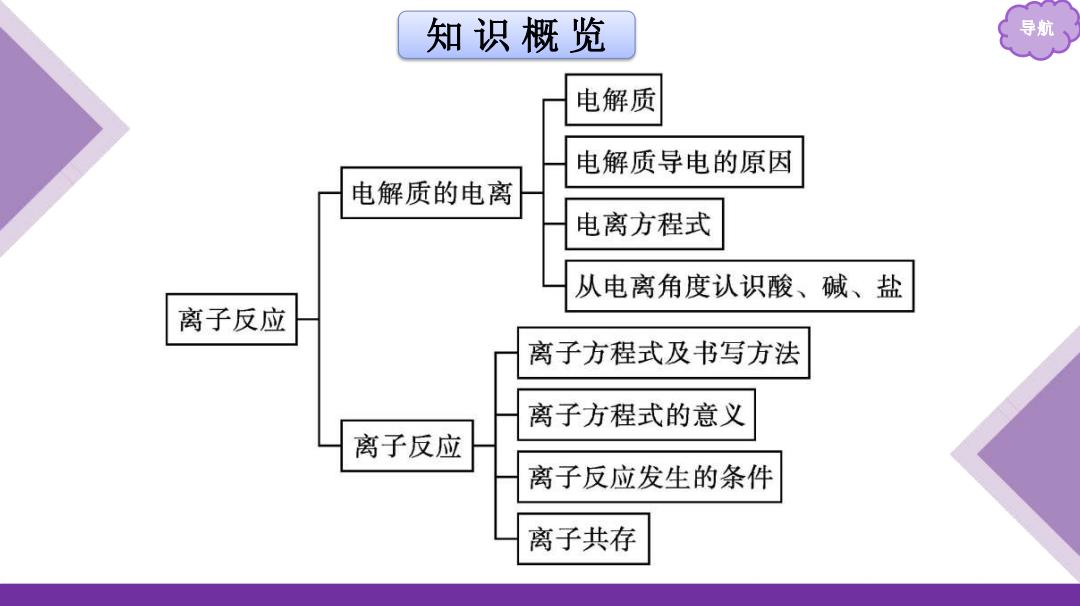
知识概览 导航 电解质 电解质导电的原因 电解质的电离 电离方程式 从电离角度认识酸、碱、盐 离子反应 离子方程式及书写方法 离子方程式的意义 离子反应 离子反应发生的条件 离子共存
知 识 概 览 导航
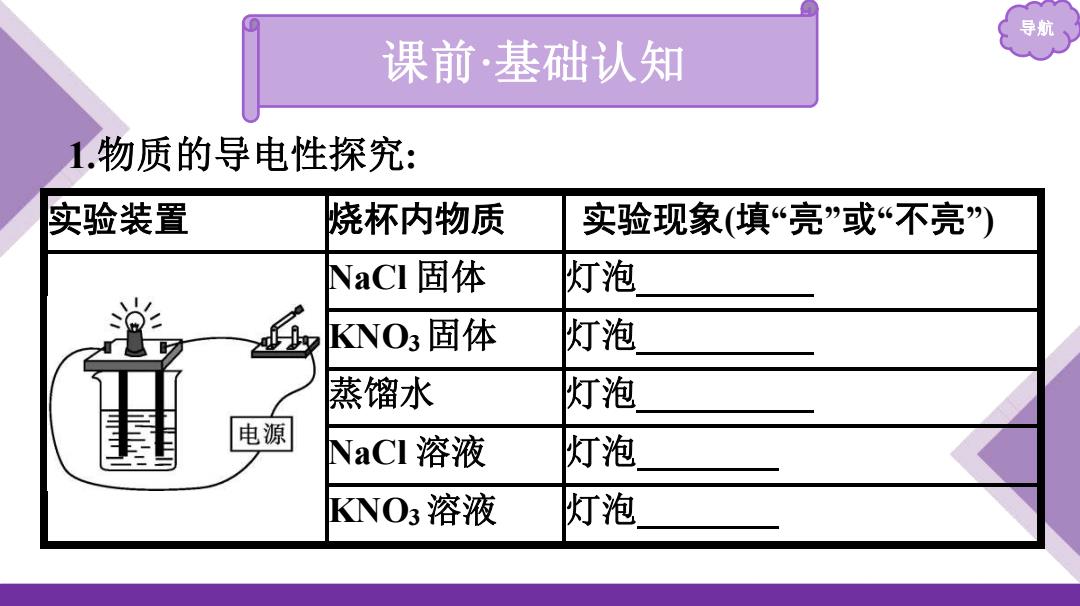
导航 课前·基础认知 1.物质的导电性探究: 实验装置 烧杯内物质 实验现象(填“亮”或“不亮”) NaCI固体 灯泡 KNO3固体 灯泡 蒸馏水 灯泡 电源 NaCI溶液 灯泡 NO3溶液 灯泡
导航 1 .物质的导电性探究 : 实验装置 烧杯内物质 实验现象(填 “ 亮 ” 或 “不亮 ”) NaCl 固体 灯泡 不亮 KNO 3固体 灯泡 不亮 蒸馏水 灯泡 不亮 NaCl 溶液 灯泡 亮 KNO 3溶液 灯泡 亮 课前 ·基础认知

导航 实验装置 烧杯内物质 实验现象(填“亮”或“不亮) 干燥的NaCI固体、KNO3固体 结论 蒸馏水也几乎不导电;NaCI溶液、KNO3溶液
导航 实验装置 烧杯内物质 实验现象(填“亮”或“不亮”) 结论 干燥的 NaCl 固体、KNO3固体 不导电 ; 蒸馏水也几乎不导电;NaCl 溶液、KNO3溶液 导电

导航 2.将NaCl、KNO3、NaOH等固体加热至熔化,它们 导电。 3.电解质:在 或 能够导电的化 合物叫做电解质
导航 2.将NaCl、KNO3、NaOH等固体加热至熔化,它们 能 导电。 3.电解质:在 水溶液里 或 熔融状态下 能够导电的化 合物叫做电解质

导航 4.电解质的导电性。 (1)氯化钠溶液导电的原因:在水分子的作用下,Na+和C脱 离NaC固体的表面,进入水中,形成能够自由移动的 和 (2)熔融氯化钠导电的原因:离子的运动随温度升高而加快, 克服了离子间的相互作用,产生了能够自由移动的 和
导航 4.电解质的导电性。 (1)氯化钠溶液导电的原因:在水分子的作用下,Na+和Cl-脱 离NaCl固体的表面,进入水中,形成能够自由移动的 Na+ 和 Cl- 。 (2)熔融氯化钠导电的原因:离子的运动随温度升高而加快, 克服了离子间的相互作用,产生了能够自由移动的 Na+ 和 Cl-

微判断1(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是 电解质。(×) (2)液态HSO4固态NaCl均不导电,所以H2SO4、NaCl均不 是电解质。(× 3)NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解 质。(X) (4)蔗糖溶于水和熔融时都不导电,蔗糖不是电解质。(√) (⑤)BaS04在水溶液中难导电,但熔融状态下能导电,所以 BaSO4是电解质。(√) (6)NaCI固体不能导电,是因为其不含离子。(×)
微判断 导航 1(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是 电解质。( ) (2)液态H2SO4、固态NaCl均不导电,所以H2SO4、NaCl均不 是电解质。( ) (3)NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解 质。( ) (4)蔗糖溶于水和熔融时都不导电,蔗糖不是电解质。( ) (5)BaSO4在水溶液中难导电,但熔融状态下能导电,所以 BaSO4是电解质。( ) (6)NaCl固体不能导电,是因为其不含离子。( ) × × × √ √ ×