
全程设计 第一节 铁及其化合物 第2课时 铁的氢氧化物、铁盐和亚铁盐
第一节 铁及其化合物 第2课时 铁的氢氧化物、铁盐和亚铁盐

课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随 堂 训 练
导航 课前·基础认知 铁的氢氧化物 NaOH 1.铁的氢氧化物的制备。 溶液 实验室制备氢氧化铁和氢氧 NaOH 溶液 化亚铁的方法如下图所示: FeCl3 FeSO 溶液 溶液 甲 乙
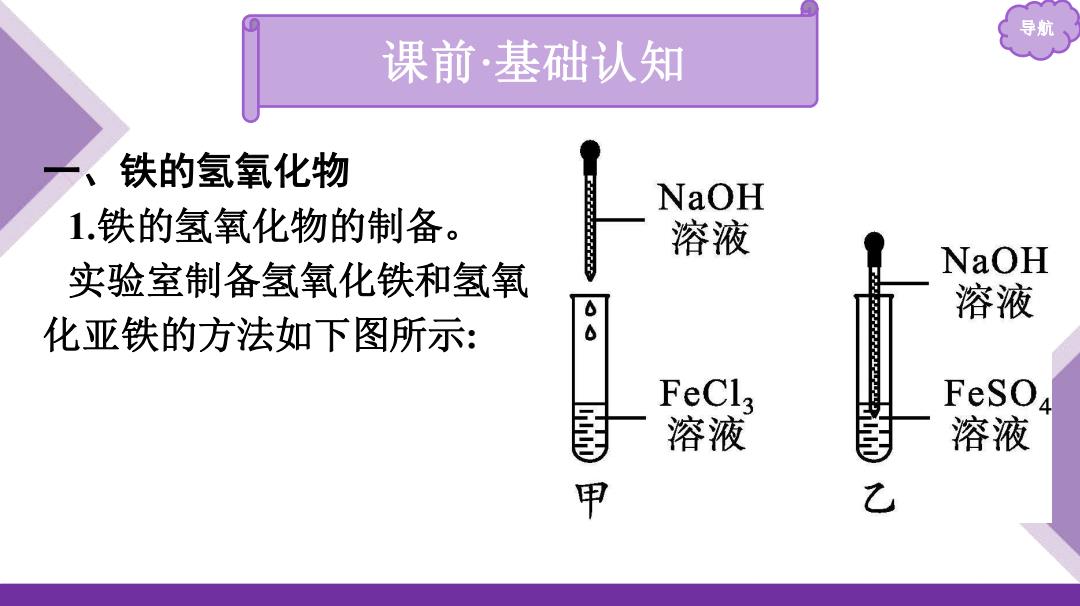
导航 一、铁的氢氧化物 1.铁的氢氧化物的制备。 实验室制备氢氧化铁和氢氧 化亚铁的方法如下图所示: 课前·基础认知

导航、 )图甲实验中观察到的现象是 反应的离子方程式是 (2)图乙实验中先观察到有 生成,迅速变成 色,最后变成 色,反应的化学方程式是
导航 (1)图甲实验中观察到的现象是 有红褐色沉淀生成 。 反应的离子方程式是 Fe3++3OH-═Fe(OH)3↓ 。 (2)图乙实验中先观察到有 白色沉淀 生成,迅速变成 灰绿 色,最后变成 红褐 色,反应的化学方程式是 FeSO4+2NaOH═Fe(OH)2↓+Na2SO4 , 4Fe(OH)2+O2+2H2O═4Fe(OH)3

导航、 2.铁的氢氧化物的性质。 (1)物理性质。 氢氧化物 Fe(OH)2 Fe(OH)3 颜色、状态 固体 固体 溶解性 溶于水
导航 2.铁的氢氧化物的性质。 (1)物理性质。 氢氧化物 Fe(OH) 2 Fe(OH) 3 颜色、状态 白色 固体 红褐色 固体 溶解性 不 溶于水

导航 (2)化学性质。 氢氧化物 Fe(OH)2 Fe(OH)3 不稳定,受热易分解,化学 稳定性 不稳定,易被02氧化 方程式为
导航 (2)化学性质 。 氢氧化物 Fe(OH) 2 Fe(OH)3 稳定性 不稳定,易被 O 2氧化 不稳定,受热易分解,化学 方程式为 2Fe(OH)3 Fe 2 O3+3H 2 O
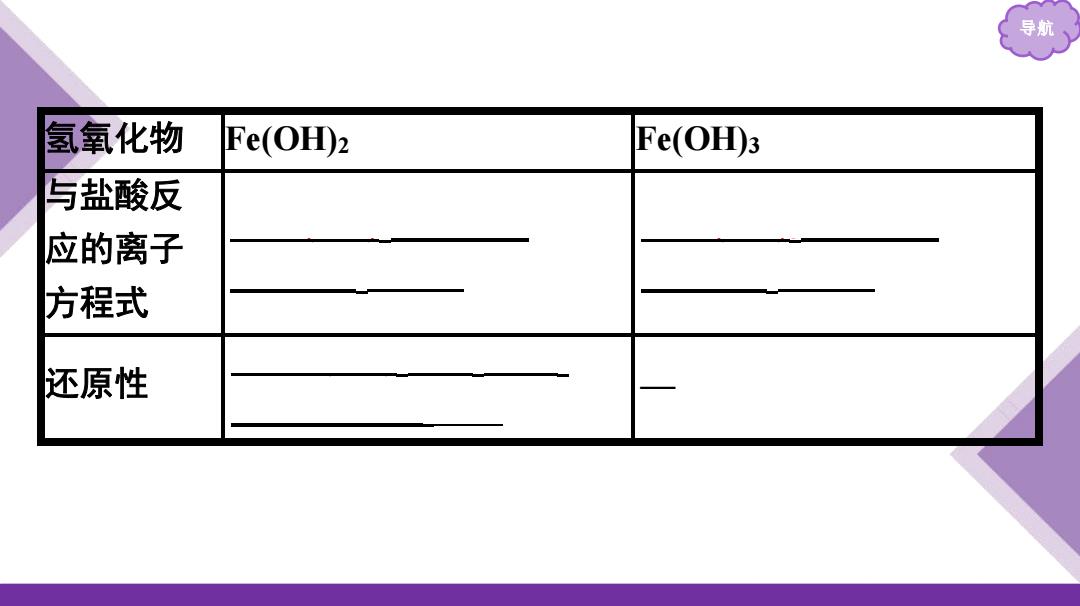
导航、 氢氧化物 Fe(OH)2 Fe(OH3 与盐酸反 应的离子 方程式 还原性
导航 氢氧化物 Fe(OH)2 Fe(OH)3 与盐酸反 应的离子 方程式 Fe(OH)2+2H+ Fe2++2H2O Fe(OH)3+3H+ Fe3++3H2O 还原性 4Fe(OH)2+2H2O+O2 4Fe(OH)3 —

导航 微判断1(1)向氯化铁溶液中滴加氢氧化钠溶液可得到红褐 色胶体。(×) (2)F(OHD2属于碱,在空气中易与C02反应而变质。(X) (3)Fe(OHD)2、Fe(OHD3都必须通过复分解反应制得。(× ) (4)Fe(OH)2、Fe(OHD3均为不溶性碱,可与盐酸反应。(√)
导航 微判断1(1)向氯化铁溶液中滴加氢氧化钠溶液可得到红褐 色胶体。( ) (2)Fe(OH)2属于碱,在空气中易与CO2反应而变质。( ) (3)Fe(OH)2、Fe(OH)3都必须通过复分解反应制得。( ) (4)Fe(OH)2、Fe(OH)3均为不溶性碱,可与盐酸反应。( ) × × × √

导航、 二、铁盐和亚铁盐 1.常见的铁盐有 等,常见的亚铁盐有 等
导航 二、铁盐和亚铁盐 1.常见的铁盐有 Fe2 (SO4 )3、FeCl3 等,常见的亚铁盐有 FeSO4、FeCl2 等
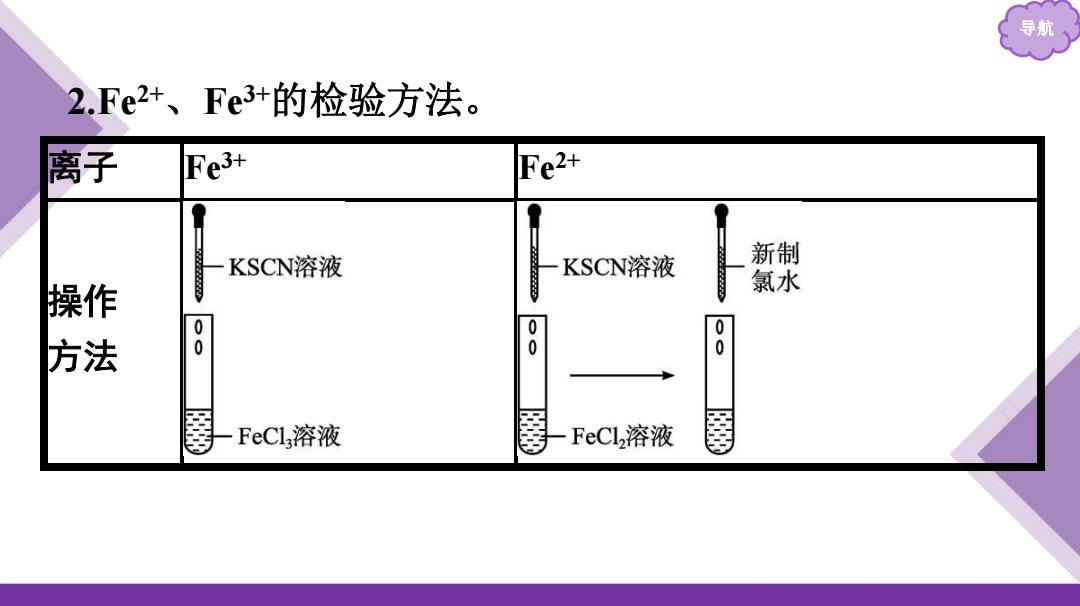
导航 2.Fe2+、Fe3+的检验方法。 离子 Fe3+ Fe2+ KSCN溶液 KSCN溶液 新制 操作 氯水 方法 8 0 8 FeCl,溶液 FeCl,溶液
导航 2.Fe 2 + 、Fe3+的检验方法。 离子 Fe3+ Fe2+ 操作 方法