
全程设计 第一节 原子结构与元素周期表 第3课时 原子结构与元素的性质
第一节 原子结构与元素周期表 第3课时 原子结构与元素的性质

课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随 堂 训 练

导航 课前·基础认知 原子结构与元素性质的关系 1.金属元素:原子最外层电子一般少于个,在化学反应 中容易 ,具有 2.非金属元素:原子最外层电子一般多于个,在化学反 应中容易 ,具有
导航 一、原子结构与元素性质的关系 1.金属元素:原子最外层电子一般少于 4 个,在化学反应 中容易 失去电子 ,具有 金属性 。 2.非金属元素:原子最外层电子一般多于 4 个,在化学反 应中容易 得到电子 ,具有 非金属性 。 课前·基础认知

二、碱金属元素 导航 1.碱金属元素的原子结构。 最外 元素 核电 电子 原子半 族 原子结构示意图 符号 层电 荷数 层数 径/mm 子数 碱金属元素 锂 0.152
二、碱金属元素 导航 1.碱金属元素的原子结构。 族 元素 名称 元素 符号 核电 荷数 原子结构示意图 最外 层电 子数 电子 层数 原子半 径/nm 碱金属元素 锂 Li 3 1 2 0 .152

导航 最外 族 素 核电 电子 原子半 原子结构示意图 层电 荷数 层数 径/nm 子数 碱金属元素 钠 0.186 钾 0.227
导航 族 元素 名称 元素 符号 核电 荷数 原子结构示意图 最外 层电 子数 电子 层数 原子半 径/nm 碱 金 属 元 素 钠 Na 11 1 3 0 .186 钾 K 19 1 4 0 .227
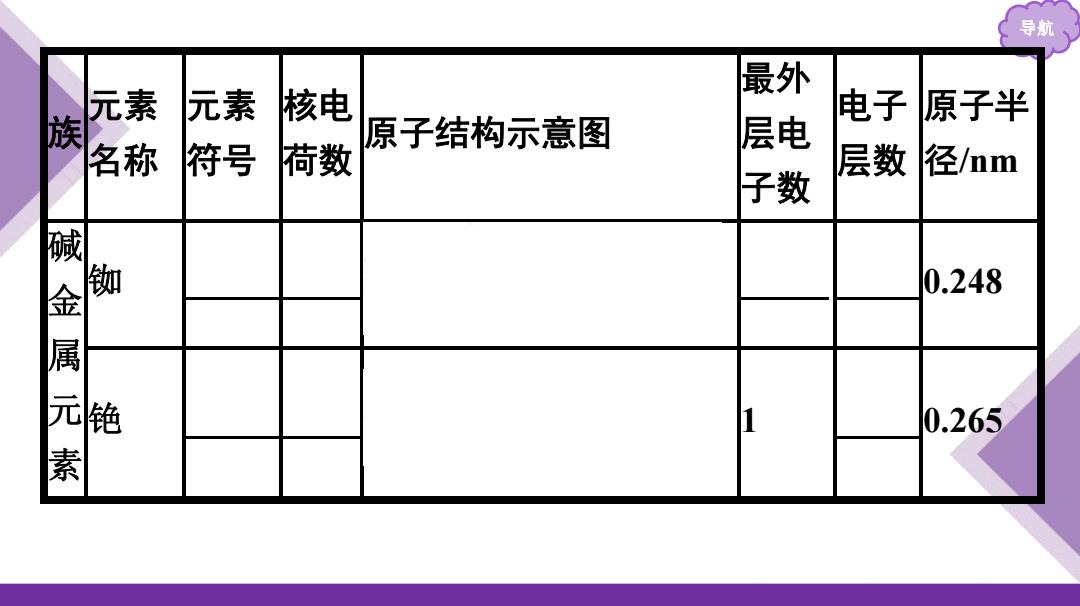
导航、 最外 森 元素 核电 电子 原子半 族 原子结构示意图 符号 层电 荷数 层数 径mm 子数 碱金属元素 铷 0.248 铯 1 0.265
导航 族 元素 名称 元素 符号 核电 荷数 原子结构示意图 最外 层电 子数 电子 层数 原子半 径/nm 碱 金 属 元 素 铷 Rb 37 1 5 0 .248 铯 Cs 55 1 6 0 .265

结论:碱金属元素原子结构的共同点是 ,不同点是 ,其变化规律是随 着核电荷数的增加,电子层数逐渐 ,原子半径逐渐 微判断1(1)碱金属元素原子的次外层电子数都是8。(×) (2)碱金属元素的原子半径随核电荷数的增大而增大。 (√) (3)碱金属元素原子的最外层电子数都是1。(√)
导航 结论:碱金属元素原子结构的共同点是 最外层电子数均为 1 ,不同点是 电子层数和原子半径不同 ,其变化规律是随 着核电荷数的增加,电子层数逐渐 增多 ,原子半径逐渐 增大 。 微判断1(1)碱金属元素原子的次外层电子数都是8。( ) (2)碱金属元素的原子半径随核电荷数的增大而增大。 ( ) (3)碱金属元素原子的最外层电子数都是1。( ) × √ √

导 2.碱金属的化学性质。 )钠、钾与氧气反应的比较。 ①钠与氧气反应:常温下钠可被氧气氧化生成 加热时钠可在空气中燃烧发出黄色火焰,生成 色粉 末Na202。反应的化学方程式分别为 ②钾与氧气反应: 钾在空气中燃烧比钠更剧烈,产生紫色火焰,产物也比过氧 化物复杂
导航 2.碱金属的化学性质。 (1)钠、钾与氧气反应的比较。 ①钠与氧气反应:常温下钠可被氧气氧化生成 氧化钠 ; 加热时钠可在空气中燃烧发出黄色火焰,生成 淡黄 色粉 末Na2O2。反应的化学方程式分别为 4Na+O2 ═2Na2O , 2Na+O2 Na2O2 。 ②钾与氧气反应: 钾在空气中燃烧比钠更剧烈,产生紫色火焰,产物也比过氧 化物复杂
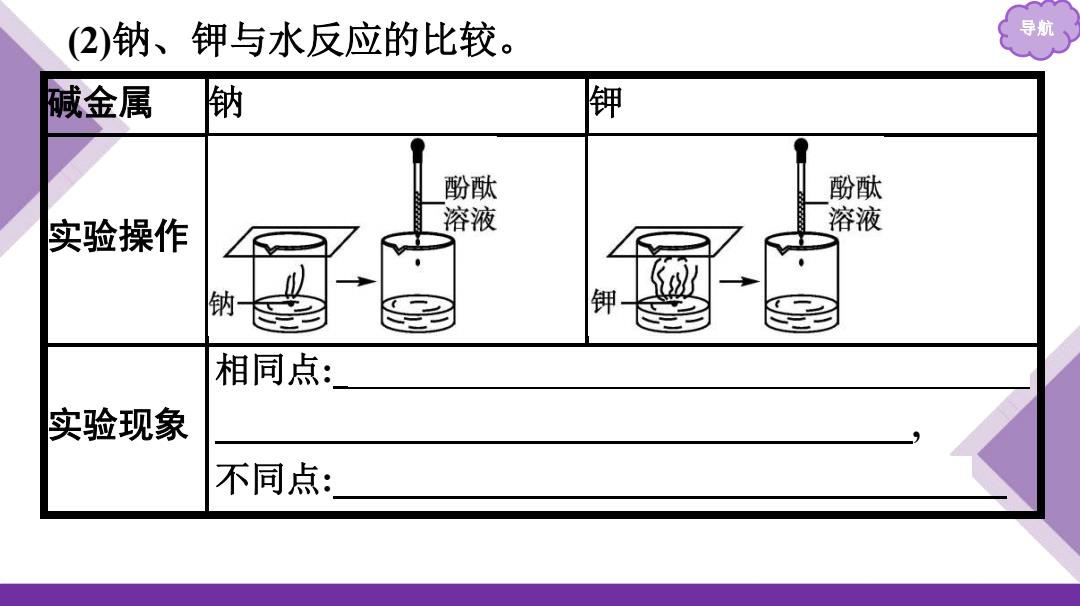
(2)钠、钾与水反应的比较。 导航 碱金属 钠 钾 酚酞 酚酞 实验操作 溶液 溶液 钠 钾 相同点: 实验现象 不同点:
导航 (2)钠、钾与水反应的比较。 碱金属 钠 钾 实验操作 实验现象 相同点: 金属浮在水面上;熔成闪亮的小球;小球四处 游动;发出嘶嘶的响声;反应后的溶液呈红色 , 不同点: 钾与水的反应有轻微爆炸声并着火燃烧

导航 碱金属钠 钾 2Na+2H20 2K+2H20 实验原理 与水反应的剧烈程度:KNa; 实验结论 金属活动性:KNa
导航 碱金属 钠 钾 实验原理 2Na+2H2O 2NaOH+H2↑ 2K+2H2O 2KOH+H2↑ 实验结论 与水反应的剧烈程度:K > Na; 金属活动性:K > Na