
全程设计 第3课时 硝酸1 酸雨及防治
第3课时 硝酸 酸雨及防治

课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随 堂 训 练

导航 课前·基础认知 一、硝酸 1.硝酸的物理性质。 颜色 状态 气味 特性 色 易
导航 一、硝酸 1.硝酸的物理性质。 颜色 状态 气味 特性 无 色 液态 有刺激性 易 挥发 课前·基础认知

导航 2.硝酸的化学性质。 )酸的通性。 电离方程式为 (2)不稳定性。 ①不稳定性: 浓硝酸受热或见光易分解,化学方程式为 ②保存方法:保存在 试剂瓶里,放置在
导航 2.硝酸的化学性质。 (1)酸的通性。 电离方程式为 HNO3 H+ +N𝐎𝟑 - 。 (2)不稳定性。 ①不稳定性: 浓硝酸受热或见光易分解,化学方程式为 4HNO3 4NO2↑+O2↑+2H2O 。 ②保存方法:保存在 棕色 试剂瓶里,放置在 阴凉处
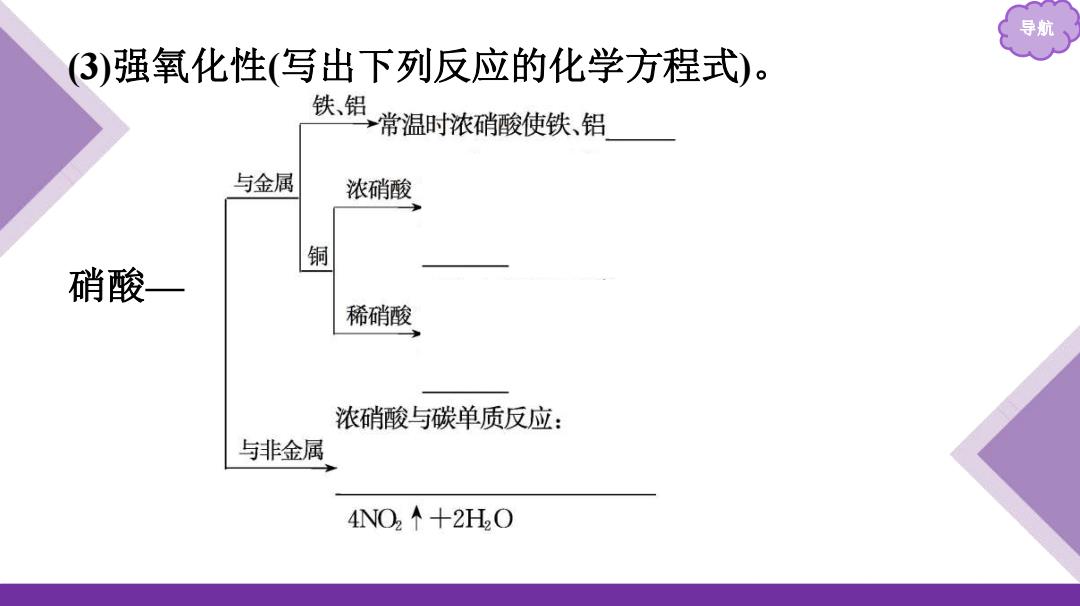
导航 (3)强氧化性(写出下列反应的化学方程式)。 铁、铝 常温时浓硝酸使铁、铝 与金属 浓硝酸 铜 硝酸— 稀硝酸 浓硝酸与碳单质反应: 与非金属 4NO2个+2HO
导航 (3)强氧化性(写出下列反应的化学方程式)。 硝酸—
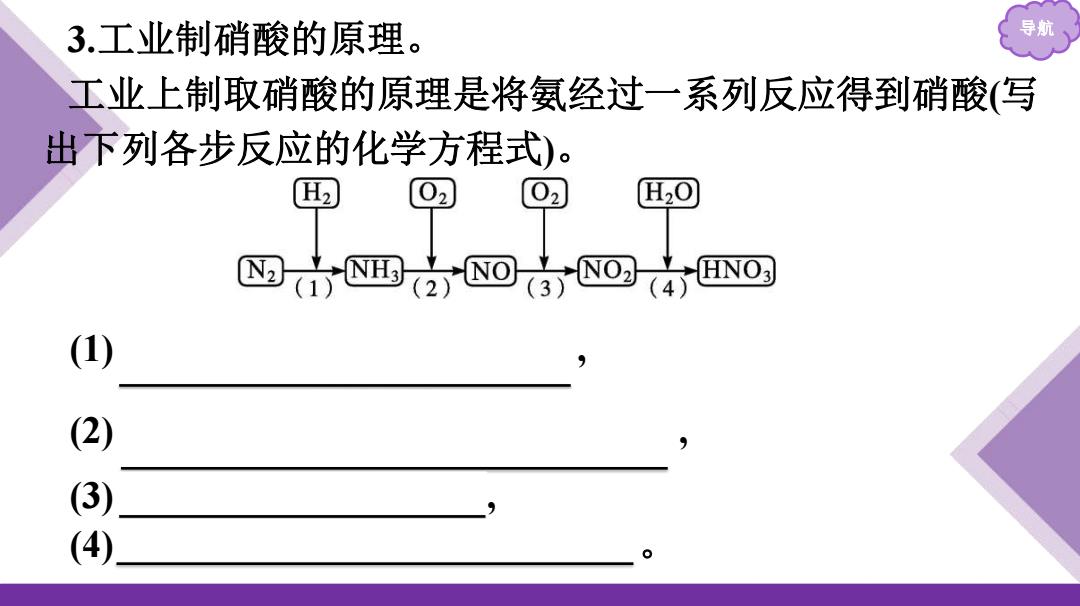
3.工业制硝酸的原理。 导航 工业上制取硝酸的原理是将氨经过一系列反应得到硝酸(写 出下列各步反应的化学方程式)。 H2 02 02 H20 HNO3 1) 2) (3) (4)
导航 3.工业制硝酸的原理。 工业上制取硝酸的原理是将氨经过一系列反应得到硝酸(写 出下列各步反应的化学方程式)。 (1) N2+3H2 2NH3 , (2) 4NH3+5O2 4NO+6H2O , (3) 2NO+O2 2NO2 , (4) 3NO2+H2O 2HNO3+NO

微训练1下列关于硝酸的叙述正确的是( 导则 A.常温下,浓硝酸可以使金属镁钝化 B.稀硝酸与活泼金属反应主要放出氢气 C.浓硝酸和稀硝酸都是强氧化剂 D.室温下,铜能与浓硝酸反应,不能与稀硝酸反应 答案:C 解析:常温下,浓硝酸可以使铁、铝发生钝化,而不能使镁钝 化,A项错误;稀硝酸具有强氧化性,与活泼金属反应的主要还 原产物为含氨元素的物质,不能得到氢气,B项错误;浓硝酸和 稀硝酸都是强氧化剂,C项正确;室温下,铜与浓硝酸、稀硝酸 均反应,只是反应的快慢及还原产物不同D项错误
微训练1下列关于硝酸的叙述正确的是( )。 导航 A.常温下,浓硝酸可以使金属镁钝化 B.稀硝酸与活泼金属反应主要放出氢气 C.浓硝酸和稀硝酸都是强氧化剂 D.室温下,铜能与浓硝酸反应,不能与稀硝酸反应 答案:C 解析:常温下,浓硝酸可以使铁、铝发生钝化,而不能使镁钝 化,A项错误;稀硝酸具有强氧化性,与活泼金属反应的主要还 原产物为含氮元素的物质,不能得到氢气,B项错误;浓硝酸和 稀硝酸都是强氧化剂,C项正确;室温下,铜与浓硝酸、稀硝酸 均反应,只是反应的快慢及还原产物不同,D项错误

导 二、酸雨及防治 1酸雨的形成。 二氧化硫、氮氧化物以及它们在大气中发生反应后的生成 物溶于雨水会形成酸雨。酸雨的pH 2.酸雨的危害。 (1)直接损伤农作物。 (2)破坏森林和草原。 3)使土壤、湖泊酸化。 (4)加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀
导航 二、酸雨及防治 1.酸雨的形成。 二氧化硫、氮氧化物以及它们在大气中发生反应后的生成 物溶于雨水会形成酸雨。酸雨的pH 小于5.6 。 2.酸雨的危害。 (1)直接损伤农作物。 (2)破坏森林和草原。 (3)使土壤、湖泊酸化。 (4)加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀

导航 3.酸雨的防治。 (1)减少化石燃料的燃烧。 (2)对二氧化硫和氮氧化物的排放加以控制
导航 3.酸雨的防治。 (1)减少化石燃料的燃烧。 (2)对二氧化硫和氮氧化物的排放加以控制

微训练2下列说法错误的是()。 A.空气中的S0,溶于水,最终形成酸雨 B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化 物 C.工业废水任意排放是造成酸雨的主要原因 D.为了减少酸雨的形成,必须减少S02的排放量,对燃料进行 脱硫处理 答案:C 解析:工业废水任意排放会引起江河湖泊污染,而酸雨是由 于S02和N02溶于雨水引起的
微训练 导航 2下列说法错误的是( )。 A.空气中的SO2溶于水,最终形成酸雨 B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化 物 C.工业废水任意排放是造成酸雨的主要原因 D.为了减少酸雨的形成,必须减少SO2的排放量,对燃料进行 脱硫处理 答案:C 解析:工业废水任意排放会引起江河湖泊污染,而酸雨是由 于SO2和NO2溶于雨水引起的