
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
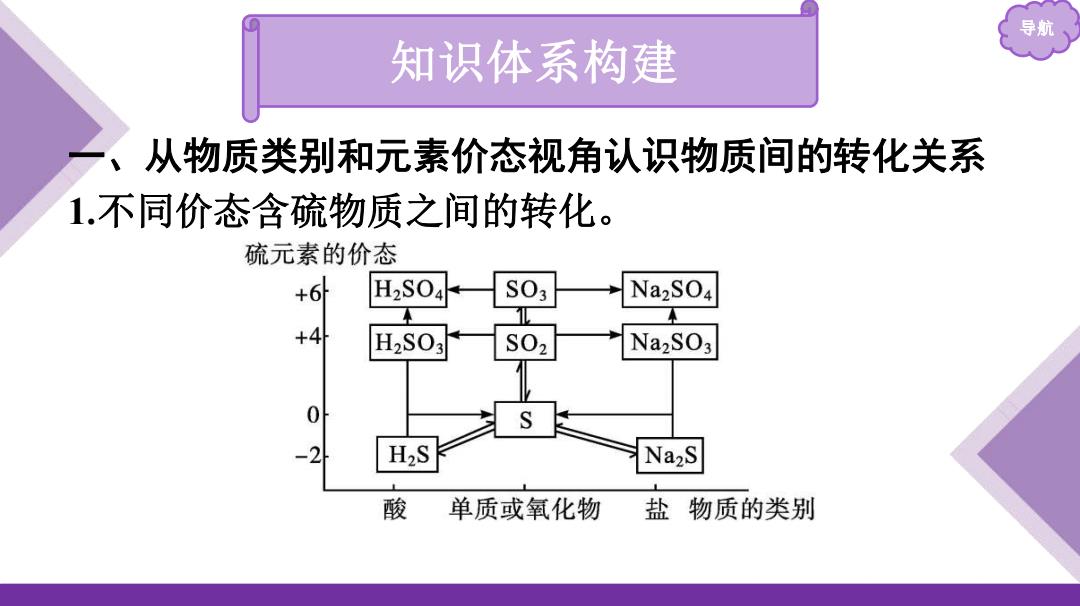
导航 知识体系构建 从物质类别和元素价态视角认识物质间的转化关系 1.不同价态含疏物质之间的转化。 硫元素的价态 H2S04 S03 Na2SO4 +4 H2S03 S02 Na2SO3 0 H2S Na2S 酸 单质或氧化物 盐物质的类别
导航 知识体系构建 一、从物质类别和元素价态视角认识物质间的转化关系 1.不同价态含硫物质之间的转化

导航 2.不同价态含氮物质之间的转化。 氮元素的价态 +5 +4 +2 0 -3 NH3 NH.CI 气态 单质 氧化物 酸 盐物质的类别 氢化物
导航 2.不同价态含氮物质之间的转化
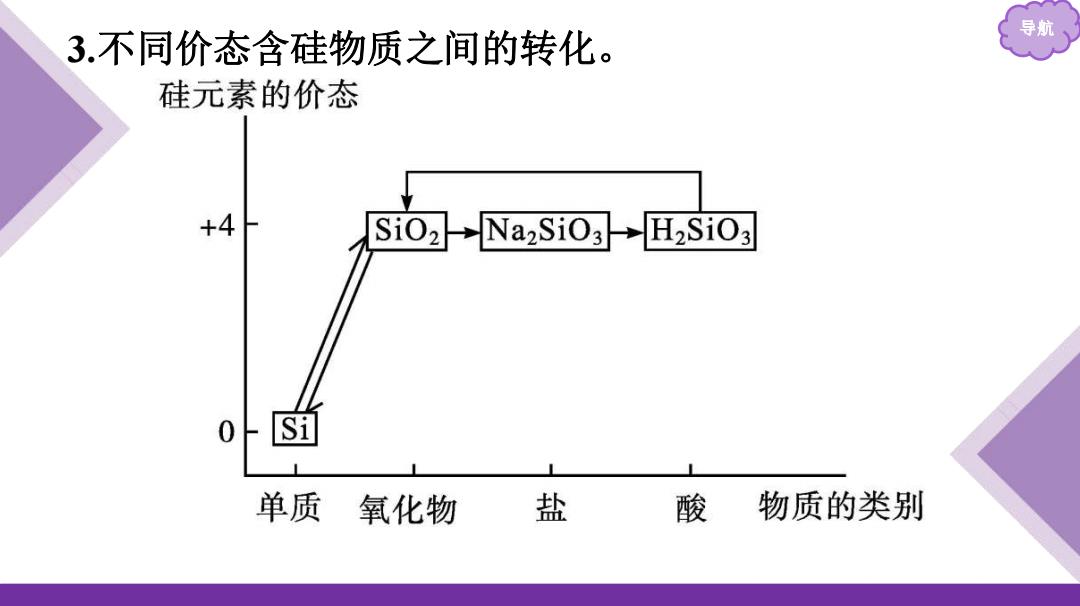
导航 3.不同价态含硅物质之间的转化。 硅元素的价态 +4 Si02→Na2Si03→H2Si03 0 单质 氧化物 盐 酸 物质的类别
导航 3.不同价态含硅物质之间的转化
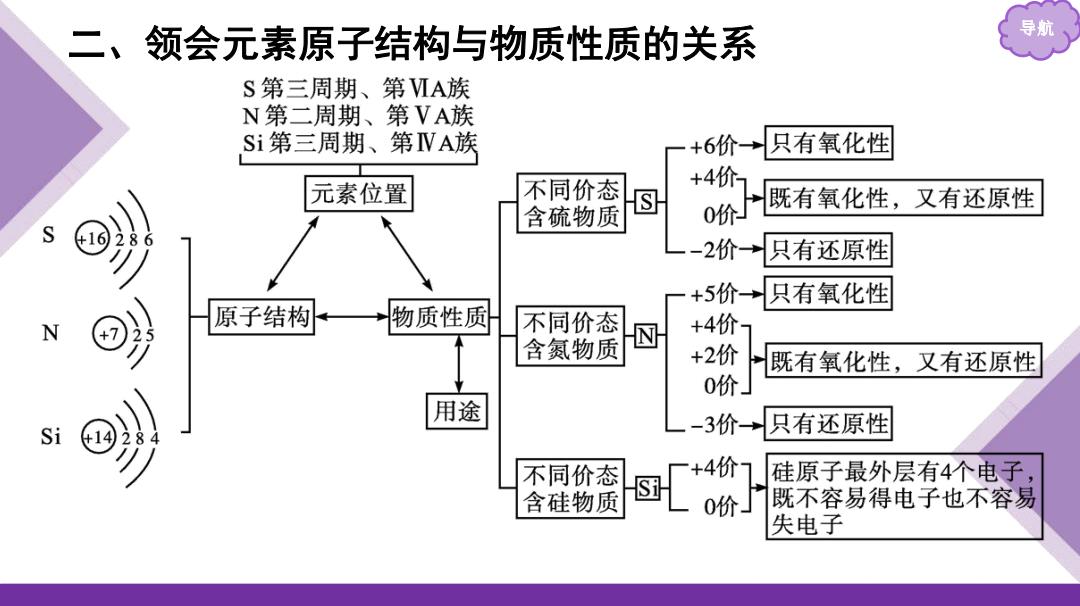
二、领会元素原子结构与物质性质的关系 导航 S第三周期、第MA族 N第二周期、第VA族 Si第三周期、第VA族 +6价→只有氧化性 +4价7 元素位置 不同价态 含硫物质 0价「 既有氧化性,又有还原性 2价→只有还原性 +5价→只有氧化性 原子结构 物质性质 不同价态 +4价7 含氨物质 +2价 既有氧化性,又有还原性 0价」 用途 Si 3价只有还原性 不同价态 +4价1 团 硅原子最外层有4个电子, 含硅物质 0价」 既不容易得电子也不容易 失电子
导航 二、领会元素原子结构与物质性质的关系

导则 三、基于性质了解实验室制取物质的方法 1.物质制备流程(以氨制备为例)。 反应原理 2NH4CI+Ca(OH) 2NH3+CaCl2+2H2O 反应物状态及反应条件反应装置 固体+固体台气体(与用KC103和MnO2或KMn04 制02的装置相同) 气体及杂质的性质净化装置 ·用碱石灰干燥 收集装置 ·向下排空气法 气体的性质 ①用湿润的红色石蕊试纸放在试管口,试纸变蓝色 验满方法 ②将蘸有浓盐酸的玻璃棒放在试管口,有白烟产生 收集时,一般在管口塞一团用水浸湿的棉花球,可 根据气体的性质选择吸收剂尾气处理 减小NH3与空气的对流速度,既能收集到纯净的NH3, 又能吸收多余的NH3
导航 三、基于性质了解实验室制取物质的方法 1.物质制备流程 (以氨制备为例 )

导航 2.实验操作流程。 仪器连接→检查气密性→填装试剂→防倒吸、防氧化措施 →实验过程→仪器拆卸
导航 2.实验操作流程。 仪器连接→检查气密性→填装试剂→防倒吸、防氧化措施 →实验过程→仪器拆卸

导航 专题归纳突破 专题一常见非金属及其化合物的性质和应用 1.非金属及其化合物的特殊性质。 (1)Si、SiO,均能与氢氟酸反应。 (2)S02具有漂白性、氧化性和较强的还原性,可被氯水、溴 水、酸性KMnO,溶液氧化
导航 专题归纳突破 专题一常见非金属及其化合物的性质和应用 1.非金属及其化合物的特殊性质。 (1)Si、SiO2均能与氢氟酸反应。 (2)SO2具有漂白性、氧化性和较强的还原性,可被氯水、溴 水、酸性KMnO4溶液氧化

(3)浓硫酸具有三大特性:吸水性、脱水性、强氧化性。注 意浓度不同时,反应情况不同: ①Zn与浓硫酸反应时,若Z过量,随着硫酸浓度的减小,当浓 硫酸变为稀硫酸时,Zn与稀硫酸反应生成H2,最后得到SO2和 H,的混合气体。 ②Cu与浓硫酸反应时,若Cu过量,随着硫酸浓度的减小,当浓 硫酸变为稀硫酸时,两者不再反应。 ③常温下浓硫酸能使Fε、A发生钝化,若加热或将浓硫酸稀 释,则可以继续反应
导航 (3)浓硫酸具有三大特性:吸水性、脱水性、强氧化性。注 意浓度不同时,反应情况不同: ①Zn与浓硫酸反应时,若Zn过量,随着硫酸浓度的减小,当浓 硫酸变为稀硫酸时,Zn与稀硫酸反应生成H2 ,最后得到SO2和 H2的混合气体。 ②Cu与浓硫酸反应时,若Cu过量,随着硫酸浓度的减小,当浓 硫酸变为稀硫酸时,两者不再反应。 ③常温下浓硫酸能使Fe、Al发生钝化,若加热或将浓硫酸稀 释,则可以继续反应