
全程设计 第三节 物质的量 第1课时 物质的量的单位一一摩尔
第三节 物质的量 第1课时 物质的量的单位——摩尔
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练
素养·目标定位 课前·基础认知 课堂·重难突破 随 堂 训 练

导航 素养·目标定位 目标素养 1.了解物质的量及其单位—摩尔。 2.通过对比、类比、归纳、演绎等多种研究方法,了解阿伏加 德罗常数、摩尔质量、气体摩尔体积、物质的量浓度的含义 和应用,体会定量研究对化学科学的重要作用
导航 目标素养 1.了解物质的量及其单位——摩尔。 2.通过对比、类比、归纳、演绎等多种研究方法,了解阿伏加 德罗常数、摩尔质量、气体摩尔体积、物质的量浓度的含义 和应用,体会定量研究对化学科学的重要作用。 素养·目标定位

3.能基于物质的量认识物质的组成及其化学变化,并运用物质的 量、摩尔质量、气体摩尔体积之间的相互关系进行简单计算。 知道从定量角度认识宏观物质和微观粒子的相互关系是研究化 学问题的科学方法之一。 4.了解物质的体积大小的决定因素,知道气体体积与温度、压强 的关系,并能从微观角度进行分析物质体积的影响因素。 5.认识容量瓶,初步学会配制一定物质的量浓度的溶液的方法和 技能,通过对实验细节的分析,增强定量研究的意识。 6通过了解生产、生活、科研中的多种计量方法,认识化学计量 方法的选择取决于实际需要,初步学会从实际需求的角度审视化 学问题
导航 3.能基于物质的量认识物质的组成及其化学变化,并运用物质的 量、摩尔质量、气体摩尔体积之间的相互关系进行简单计算。 知道从定量角度认识宏观物质和微观粒子的相互关系是研究化 学问题的科学方法之一。 4.了解物质的体积大小的决定因素,知道气体体积与温度、压强 的关系,并能从微观角度进行分析物质体积的影响因素。 5.认识容量瓶,初步学会配制一定物质的量浓度的溶液的方法和 技能,通过对实验细节的分析,增强定量研究的意识。 6.通过了解生产、生活、科研中的多种计量方法,认识化学计量 方法的选择取决于实际需要,初步学会从实际需求的角度审视化 学问题
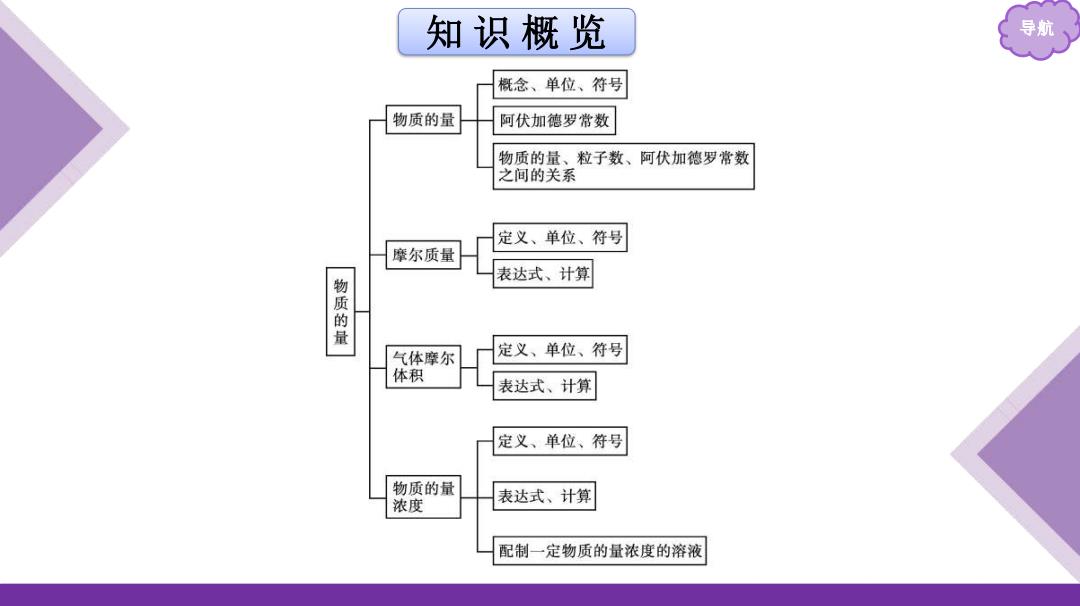
知识概览 导航 概念、单位、符号 物质的量 阿伏加德罗常数 物质的量、粒子数、阿伏加德罗常数 之间的关系 定义、单位、符号 摩尔质量 表达式、计算 物质的量 气体摩尔 定义、单位、符号 体积 表达式、计算 定义、单位、符号 物质的量 浓度 表达式、计算 配制一定物质的量浓度的溶液
知 识 概 览 导航

导航 课前·基础认知 一、物质的量及其单位 1.定义:物质的量是一个 ,表示含有 的集合体。符号为 2.单位:单位为 ,简称摩,符号为
导航 一、物质的量及其单位 1.定义:物质的量是一个 物理量 ,表示含有 一定数目粒 子 的集合体。符号为 n 。 2.单位:单位为 摩尔 ,简称摩,符号为 mol 。 课前·基础认知

导 3.衡量标准:国际上规定,1ol粒子集合体所含的粒子数约 为6.02×1023。 4.阿伏加德罗常数: 任何粒子的粒子数叫做阿伏 加德罗常数,符号为 ,通常用 表 示。 5.物质的量、阿伏加德罗常数与粒子数之间的关系: 。其中表示物质的量,N表示阿伏加德罗常数,N表 示
导航 3.衡量标准:国际上规定,1 mol粒子集合体所含的粒子数约 为6.02×1023 。 4.阿伏加德罗常数: 1 mol 任何粒子的粒子数叫做阿伏 加德罗常数,符号为 NA ,通常用 6.02×1023 mol-1 表 示。 5.物质的量、阿伏加德罗常数与粒子数之间的关系: n= 。其中n表示物质的量,NA表示阿伏加德罗常数,N表 示 粒子数 。 𝑵 𝑵𝐀

导航 微判断1(1)物质的量就是物质的质量。(×) (2)设N代表阿伏加德罗常数的值。2mol氧中所含氧原子 的个数为2NA·(×) (3)1 mol NH3所含原子数约是2.408×1024。(√) (4)物质的量是指物质所含粒子的数目。(×) (⑤)物质的量的单位一摩尔只适用于分子、原子和离子。 (X)
导航 微判断1(1)物质的量就是物质的质量。( ) (2)设NA代表阿伏加德罗常数的值。2 mol氧中所含氧原子 的个数为2NA。( ) (3)1 mol NH3所含原子数约是2.408×1024 。( ) (4)物质的量是指物质所含粒子的数目。( ) (5)物质的量的单位——摩尔只适用于分子、原子和离子。 ( ) × × √ × ×
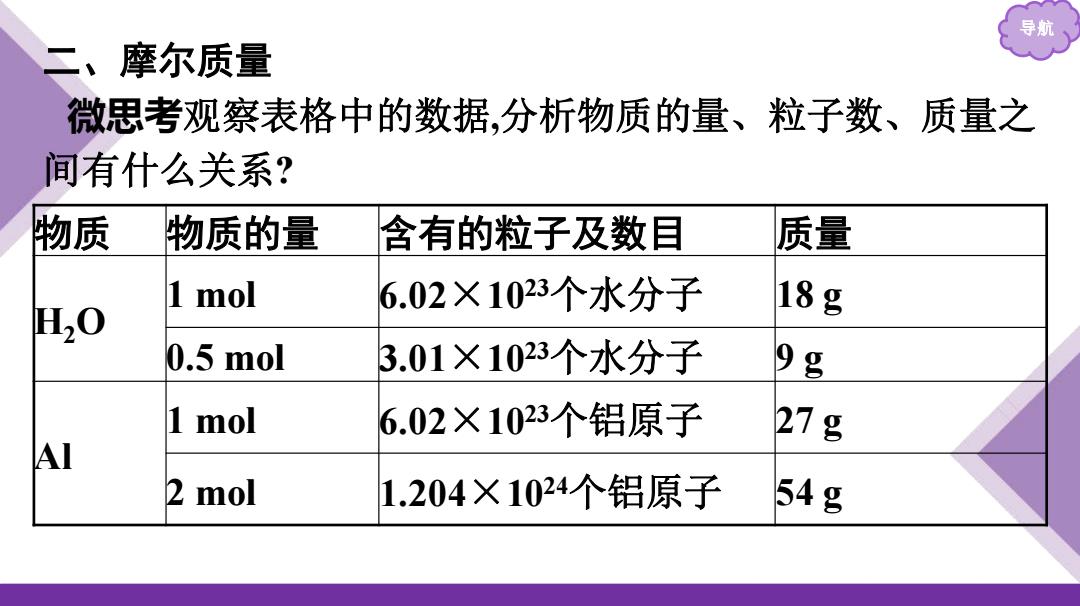
导 二、摩尔质量 微思考观察表格中的数据,分析物质的量、粒子数、质量之 间有什么关系? 物质 物质的量 含有的粒子及数目 质量 1 mol 6.02×1023个水分子 H20 18g 0.5 mol 3.01×1023个水分子 9g 1 mol 6.02×1023个铝原子 27g A 2 mol 1.204×1024个铝原子 54g
导航 二、摩尔质量 微思考观察表格中的数据,分析物质的量、粒子数、质量之 间有什么关系? 物质 物质的量 含有的粒子及数目 质量 H2O 1 mol 6.02×1023个水分子 18 g 0.5 mol 3.01×1023个水分子 9 g Al 1 mol 6.02×1023个铝原子 27 g 2 mol 1.204×1024个铝原子 54 g

导航 提示:1)1ol不同物质中所含的粒子数是相同的,但由于不 同粒子的质量不同,1m0l不同物质的质量也不同。 (2)1m0l任何粒子集合体都约含有6.02×1023个粒子;而1 0l任何粒子或物质的质量以克为单位时,其数值都与该粒子 的相对原子质量或相对分子质量相等
导航 提示:(1)1 mol不同物质中所含的粒子数是相同的,但由于不 同粒子的质量不同,1 mol不同物质的质量也不同。 (2)1 mol任何粒子集合体都约含有6.02×1023个粒子;而1 mol任何粒子或物质的质量以克为单位时,其数值都与该粒子 的相对原子质量或相对分子质量相等