
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
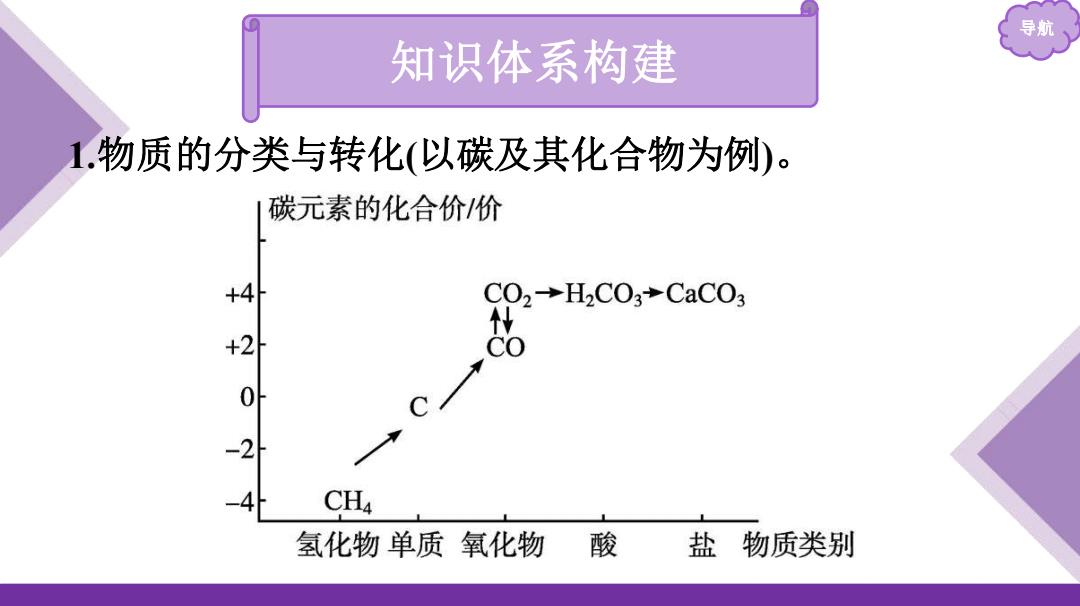
导航 知识体系构建 1.物质的分类与转化(以碳及其化合物为例)。 碳元素的化合价价 4 C02→H2C03+CaC03 +2 CH4 氢化物单质氧化物酸 盐物质类别
导航 知识体系构建 1.物质的分类与转化(以碳及其化合物为例)
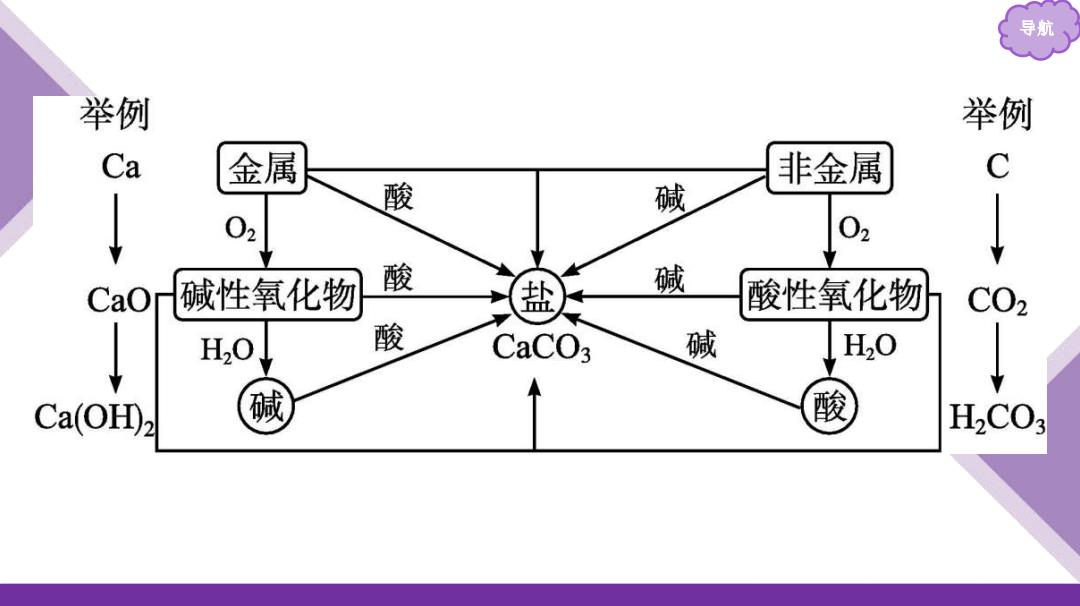
导航 举例 举例 Ca 金属 非金属 C 酸 碱 02 02 CaO 碱性氧化物 酸 碱 酸性氧化物 C02 H20 酸 CaCO3 碱 H20 Ca(OH) 碱 酸 H.CO
导航
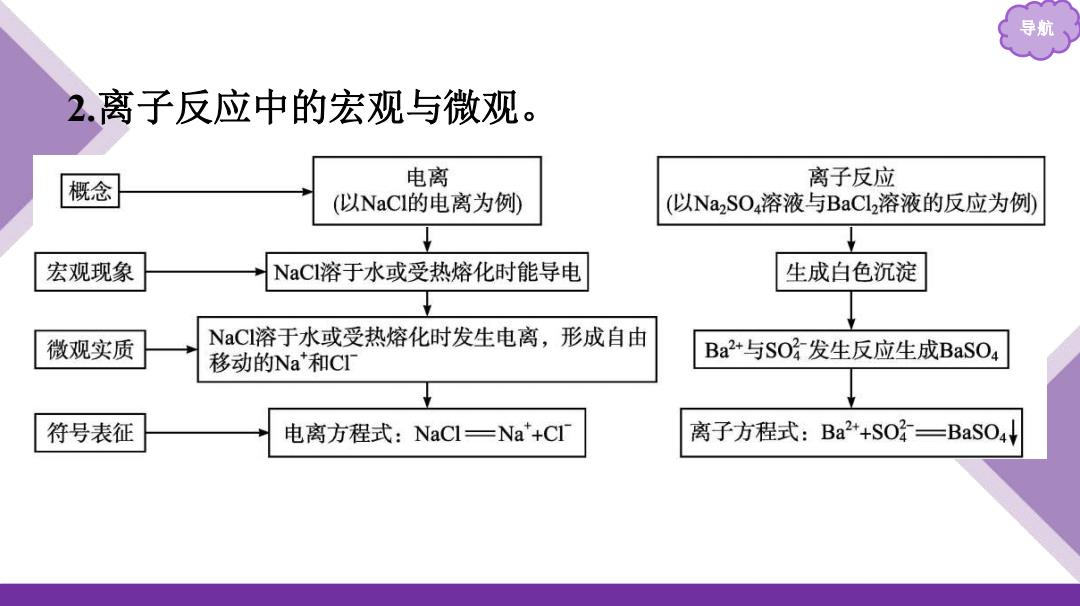
导 2.离子反应中的宏观与微观。 概念 电离 离子反应 (以NaCI的电离为例 (以Na2SO4溶液与BaCl2溶液的反应为例 宏观现象 NaCI溶于水或受热熔化时能导电 生成白色沉淀 微观实质 NaCI溶于水或受热熔化时发生电离,形成自由 移动的Na和CI Ba2+与SO发生反应生成BaSO4 符号表征 电离方程式:NaCl=Na+C 离子方程式:Ba2+SO=BaSO4
导航 2.离子反应中的宏观与微观
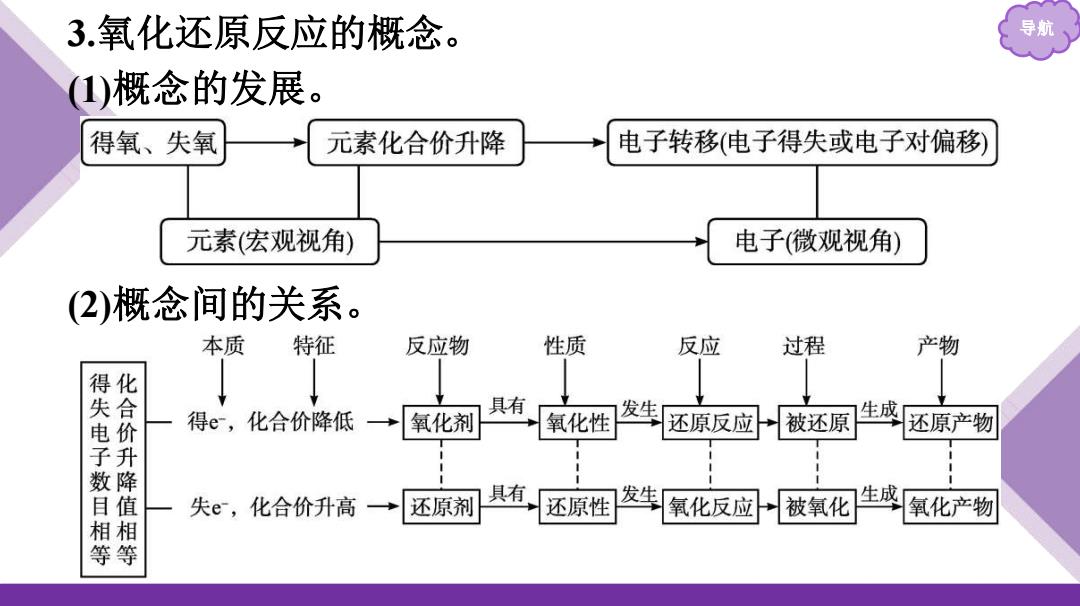
3.氧化还原反应的概念。 导 (1)概念的发展 得氧、失氧 元素化合价升降 电子转移(电子得失或电子对偏移 元素(宏观视角) 电子(微观视角) (2)概念间的关系 。 本质 特征 反应物 性质 反应 过程 产物 得化 失合 得e,化合价降低→ 具有 氧化剂 氧化性 发生 生成 电价 还原反应 被还原 还原产物 子升 数降 目值 失e,化合价升高→ 还原剂 具有 还原性 发生 氧化反应 被氧化 生成 氧化产物 相相 等等
导航 3.氧化还原反应的概念。 (1)概念的发展。 (2)概念间的关系

导航 专题归纳突破 专题一离子共存问题 所谓几种离子在同一溶液中能大量共存,就是指离子之间不 发生任何反应,若离子之间能发生反应,则不能大量共存
导航 专题归纳突破 专题一 离子共存问题 所谓几种离子在同一溶液中能大量共存,就是指离子之间不 发生任何反应,若离子之间能发生反应,则不能大量共存

1.离子间发生的反应类型。 (1)复分解反应。 ①生成难溶物或微溶物:如Ba2+与C0子、Ag与C、Ca2+与S0子 等不能大量共存。 ②生成气体物质:如H(足量)与C0子等不能大量共存。 ③生成弱酸、弱碱、水等物质:如H+与CH,COO生成弱酸、 H+与OH生成水。 (2)氧化还原反应。 具有较强氧化性的离子(如F3+)与还原性离子(如)不能犬 量共存
导航 1.离子间发生的反应类型。 (1)复分解反应。 ①生成难溶物或微溶物:如 Ba2+与 C𝐎𝟑 𝟐- 、Ag+ 与 Cl- 、Ca2+与 S𝐎𝟒 𝟐- 等不能大量共存。 ②生成气体物质:如 H+ (足量)与 C𝐎𝟑 𝟐- 等不能大量共存。 ③生成弱酸、弱碱、水等物质:如H+与CH3COO-生成弱酸、 H+与OH-生成水。 (2)氧化还原反应。 具有较强氧化性的离子(如Fe3+)与还原性离子(如I - )不能大 量共存

导 2.有限制条件的离子共存问题。 (1)酸性溶液(H)、碱性溶液(OH)等,酸性溶液中能与H+反 应的离子不能大量共存,碱性溶液中能与OH反应的离子不能 大量共存。 (2)无色溶液中,有色离子Mn04(紫色)、Fe3+(黄色)、Fe2+(浅 绿色)、Cu2+(蓝色)等不能大量存在。 (3)注意题目要求“大量共存还是“不能大量共存
导航 2.有限制条件的离子共存问题。 (1)酸性溶液(H+ )、碱性溶液(OH- )等,酸性溶液中能与H+反 应的离子不能大量共存,碱性溶液中能与OH-反应的离子不能 大量共存。 (2)无色溶液中,有色离子 (紫色)、Fe3+(黄色)、Fe2+(浅 绿色)、Cu2+(蓝色)等不能大量存在。 (3)注意题目要求“大量共存”还是“不能大量共存” 。 Mn𝐎𝟒 -

【典型例题1】下列各组离子一定能够大量共存的是( A无色溶液中:H+、Fe+、C、S0子 B.在含有大量Ca2+的溶液中:Na+、K+、C、C0子 C.在强酸性溶液中:Cu2+、Na*、C、S0子 D.在强碱性溶液中:Mg2+、Ba2+、HC03、N03 答案:C
导航 【典型例题1】下列各组离子一定能够大量共存的是( )。 A.无色溶液中:H+ 、Fe3+ 、Cl- 、S𝐎𝟒 𝟐- B.在含有大量 Ca2+的溶液中:Na+ 、K+ 、Cl- 、C𝐎𝟑 𝟐- C.在强酸性溶液中:Cu2+ 、Na+ 、Cl- 、S𝐎𝟒 𝟐- D.在强碱性溶液中:Mg2+ 、Ba2+ 、HC𝐎𝟑 - 、N𝐎𝟑 - 答案:C