
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
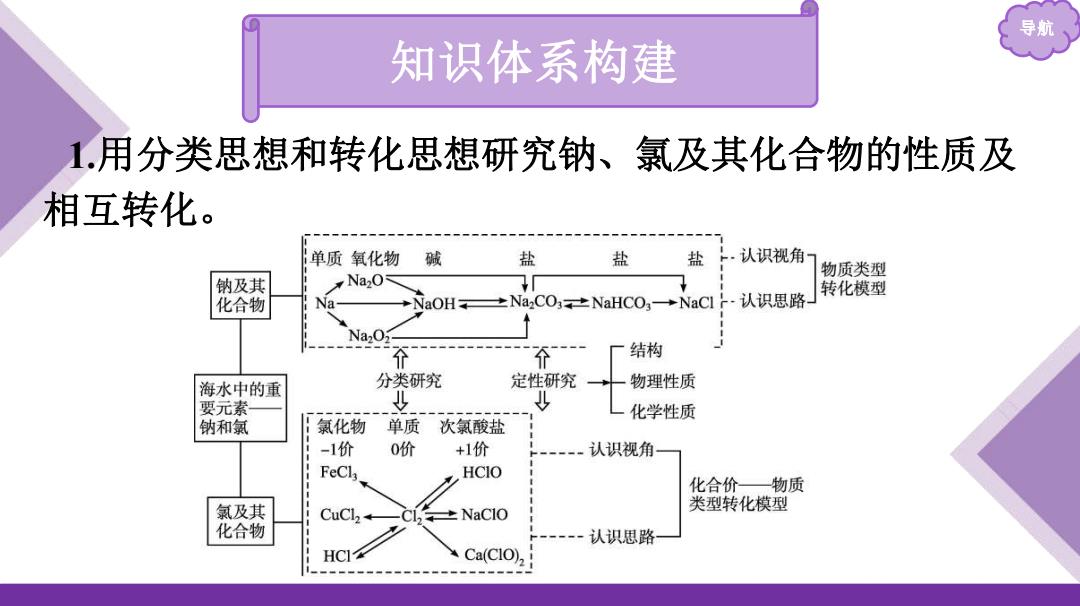
导航 知识体系构建 1.用分类思想和转化思想研究钠、氯及其化合物的性质及 相互转化。 单质氧化物 碱 盐 盐 盐 ·.认识视角 物质类型 钠及其 Na2O NaOH,±NaCO3,±NaHCO,→NaCl-认识思路- 转化模型 化合物 Na 结构 海水中的重 分类研究 定性研究 物理性质 要元素 少 化学性质 钠和氯 氯化物 单质 次氯酸盐 -1价 0价 +1价 认识视角 FeCl HCIO 化合价一物质 氯及其 CuCl2+ 。±NaCIO 类型转化模型 化合物 认识思路 HCI Ca(ClO)2
导航 知识体系构建 1.用分类思想和转化思想研究钠、氯及其化合物的性质及 相互转化
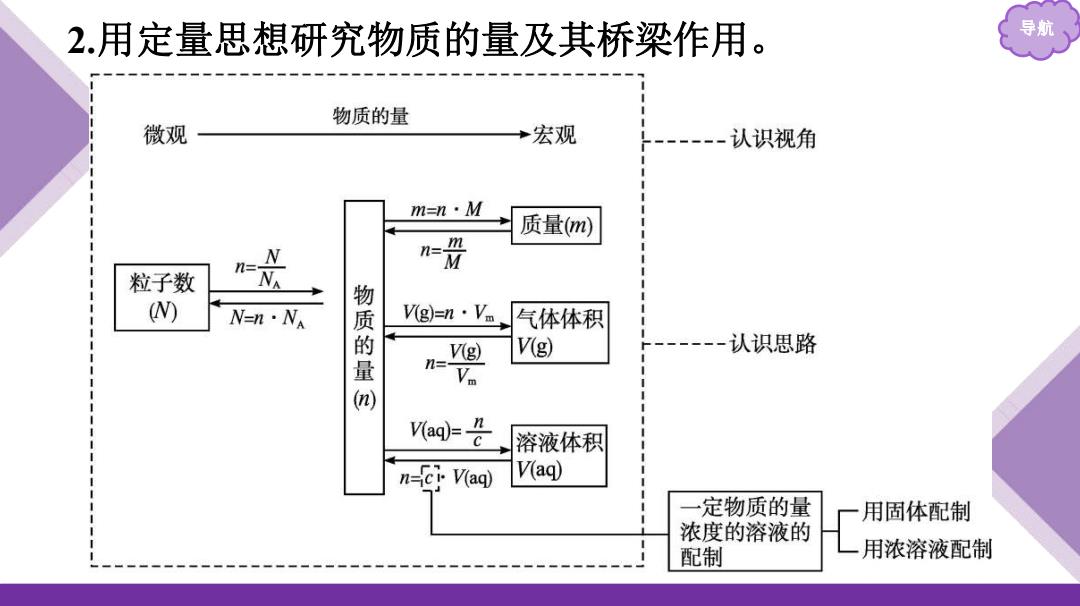
2.用定量思想研究物质的量及其桥梁作用。 导航 物质的量 微观 宏观 ----认识视角 m=n·M 质量m) m N 粒子数 NA W N=n·Na 质 Vg)=n·Vm 气体体积 V(g) V(g) 认识思路 量 n= V V(aq)=n 溶液体积 n-er V(aq) V(aq) 定物质的量 用固体配制 浓度的溶液的 配制 用浓溶液配制
导航 2.用定量思想研究物质的量及其桥梁作用
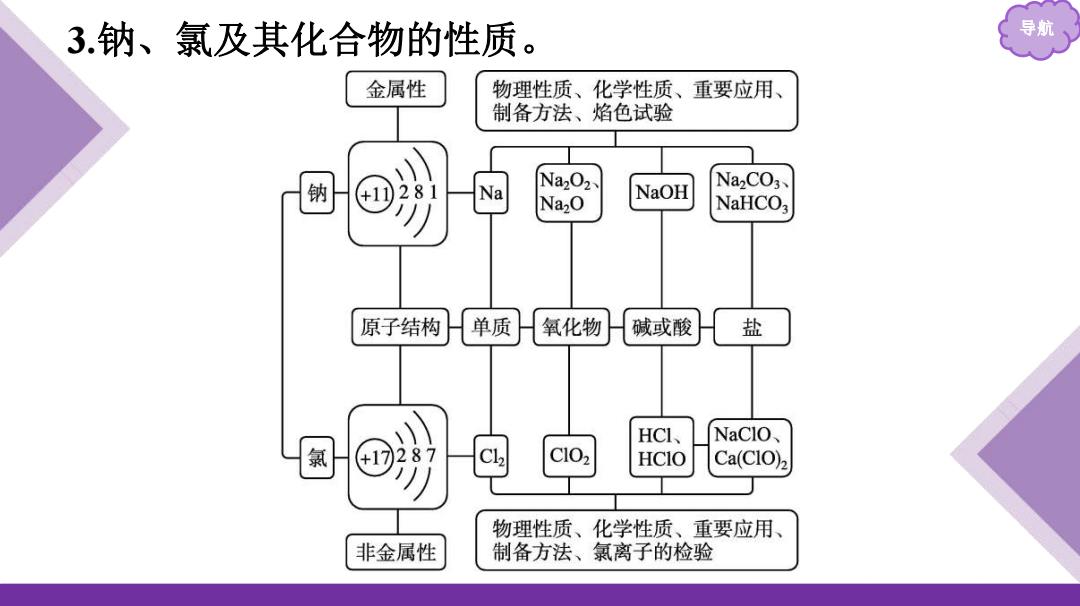
3.钠、氯及其化合物的性质。 导航 金属性 物理性质、化学性质、重要应用、 制备方法、焰色试验 281 Na202 NaOH NazC03、 Na Na,O NaHCOa 原子结构 单质 氧化物 碱或酸 盐 HCI、 NaClO, 氯 17287 CL HCIO Ca(CIO)2 物理性质、化学性质、重要应用、 非金属性 制备方法、氯离子的检验
导航 3.钠、氯及其化合物的性质

导航 专题归纳突破 专题一过氧化钠与C02、H20的反应的重要关系 1.电子转移关系。 得到2×e 得到2×e 2Na2O2+2H2O-4NaOH+O2 2Na202十+2C02—2Na2C03+02 失去2×e 失去2Xe 每生成1molO2,反应2 mol Na202,转移2mole
导航 专题归纳突破 专题一 过氧化钠与CO2、H2O的反应的重要关系 1.电子转移关系。 每生成1 mol O2 ,反应2 mol Na2O2 ,转移2 mol e -

导航 2.物质的量关系。 无论是C02还是H,0,或者是C02与水蒸气的混合物,通过足 量过氧化钠时,C02或H,0与放出氧气的物质的量之比均为 2:1
导航 2.物质的量关系。 无论是CO2还是H2O,或者是CO2与水蒸气的混合物,通过足 量过氧化钠时,CO2或H2O与放出氧气的物质的量之比均为 2∶1

3.同温同压下,气体体积关系。 导航 2Na202+2C02—2Na2C03+02 2V V V 2Na202+2H20(g)-4Na0H+02 △V 2V V V 由上述关系可知,同温同压下,生成的氧气的体积总是消耗 的C02或H,0(g)的体积的一半,若参与反应的气体是由二氧 化碳和水蒸气混合而成,生成的氧气体积仍是消耗的两者总 体积的一半。若过氧化钠足量,则充分反应后,气体体积减小 量与生成氧气的体积相等
导航 3.同温同压下,气体体积关系。 2Na2O2+2CO2 ══2Na2CO3+O2 ΔV 2V V V 2Na2O2+2H2O(g)══4NaOH+O2 ΔV 2V V V 由上述关系可知,同温同压下,生成的氧气的体积总是消耗 的CO2或H2O(g)的体积的一半,若参与反应的气体是由二氧 化碳和水蒸气混合而成,生成的氧气体积仍是消耗的两者总 体积的一半。若过氧化钠足量,则充分反应后,气体体积减小 量与生成氧气的体积相等

导航 4.固体质量关系。 (1)2Na202+2C02一2Na2C03+02△m(固体) 2X78g 2×106g 56g 2 mol (2molC0的质量) 发生反应(1)时,固体增加的质量等于与参加反应的C0,等物 质的量的CO的质量
导航 4.固体质量关系。 (1)2Na2O2+2CO2 ══2Na2CO3+O2 Δm(固体) 2×78 g 2×106 g 56 g 2 mol (2 mol CO的质量) 发生反应(1)时,固体增加的质量等于与参加反应的CO2等物 质的量的CO的质量

导航 (2)2Na202+2H20一4Na0H+02↑△m(固体) 2X78g 4×40g 48 2 mol (2molH,的质量) 发生反应(2)时,固体增加的质量等于与参加反应的水等物 质的量的H,的质量
导航 (2)2Na2O2+2H2O══4NaOH+O2↑ Δm(固体) 2×78 g 4×40 g 4 g 2 mol (2 mol H2的质量) 发生反应(2)时,固体增加的质量等于与参加反应的水等物 质的量的H2的质量