
全程设计 第二节 元素周期律 第1课时 元素性质的周期性变化规律
第二节 元素周期律 第1课时 元素性质的周期性变化规律
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练
素养·目标定位 课前·基础认知 课堂·重难突破 随 堂 训 练

导期 素养·目标定位 目标素养 1.结合有关数据和实验事实认识原子核外电子排布、元素最 高化合价和最低化合价、原子半径等随元素原子序数递增而 呈周期性变化的规律。 2.以第三周期元素为例,认识同周期元素的金属性、非金属性 等随元素原子序数递增而呈周期性变化的规律,构建元素周 期律
导航 目标素养 1.结合有关数据和实验事实认识原子核外电子排布、元素最 高化合价和最低化合价、原子半径等随元素原子序数递增而 呈周期性变化的规律。 2.以第三周期元素为例,认识同周期元素的金属性、非金属性 等随元素原子序数递增而呈周期性变化的规律,构建元素周 期律。 素养·目标定位

导期 3,基于元素“位置“结构“性质”之间的内在联系认识元素性 质,基于物质“结构“性质“用途”之间的内在联系认识物质 性质,基于元素性质递变的本质原因认识物质世界。 4.加深对分类法、归纳法等科学方法的认识,提高逻辑推理能 力、论证能力,从而发展证据推理与模型认知的化学学科核 心素养
导航 3.基于元素“位置”“结构”“性质”之间的内在联系认识元素性 质,基于物质“结构”“性质”“用途”之间的内在联系认识物质 性质,基于元素性质递变的本质原因认识物质世界。 4.加深对分类法、归纳法等科学方法的认识,提高逻辑推理能 力、论证能力,从而发展证据推理与模型认知的化学学科核 心素养
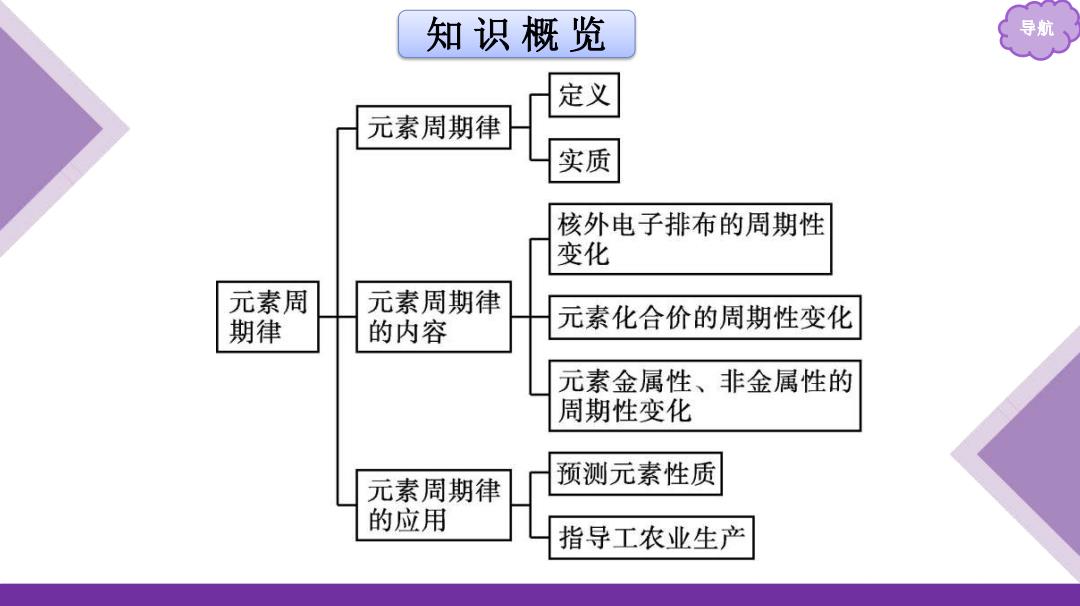
知识概览 导航 定义 元素周期律 实质 核外电子排布的周期性 变化 元素周 元素周期律 期律 的内容 元素化合价的周期性变化 元素金属性、非金属性的 周期性变化 元素周期律 预测元素性质 的应用 指导工农业生产
知 识 概 览 导航

导航 课前·基础认知 一、元素的原子核外电子排布、原子半径、元素化合价的变 化规律 1.原子结构的变化规律
导航 一、元素的原子核外电子排布、原子半径、元素化合价的变 化规律 1.原子结构的变化规律。 课前·基础认知

导航 达到稳定结构时的最 原子序数 电子层数 最外层电子数 外层电子数 1~2 1→ 3~10 1→ 11~18 3 1→ 结论:随着原子序数的递增,元素原子核外的电子排布呈现 的变化
导航 原子序数 电子层数 最外层电子数 达到稳定结构时的最 外层电子数 1~2 1 1→ 2 2 3~10 2 1→ 8 8 11~18 3 1→ 8 8 结论:随着原子序数的递增,元素原子核外的电子排布呈现 周期性 的变化
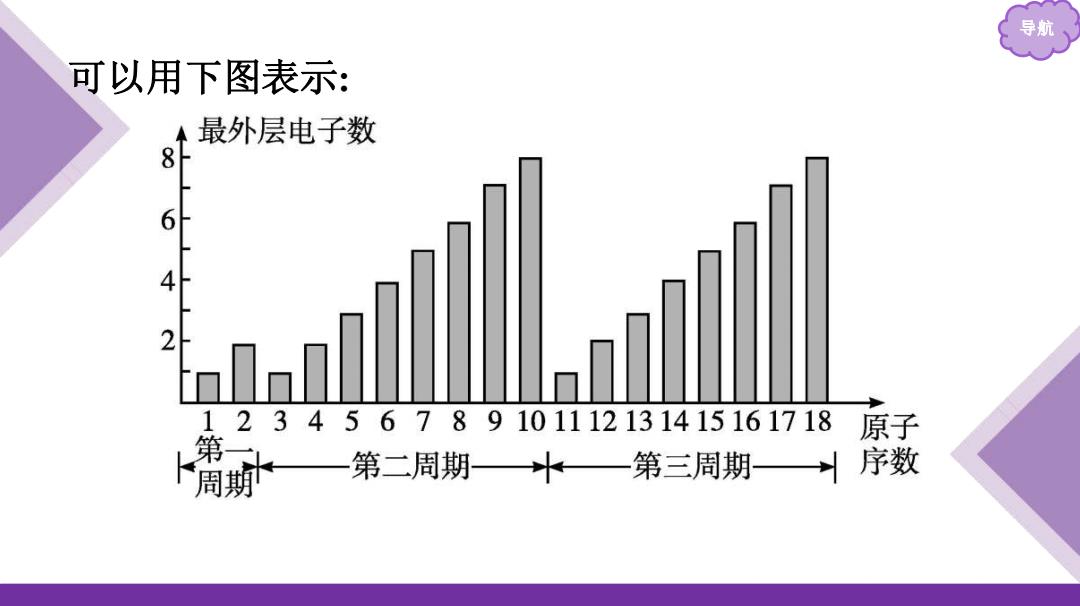
导航 可以用下图表示: 最外层电子数 8 6 4 2 123456789101112131415161718 原子 第一 周 第二周期屮—第三周期序数
导航 可以用下图表示:

导航 2.原子半径的变化规律。 3~10 Li Be B N 0 Ne 原子半径 0.1520.089 0.082 0.077 0.075 0.074 0.071 nm 变化趋势 逐渐
导航 2.原子半径的变化规律。 3~10 Li Be B C N O F Ne 原子半径 /nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 — 变化趋势
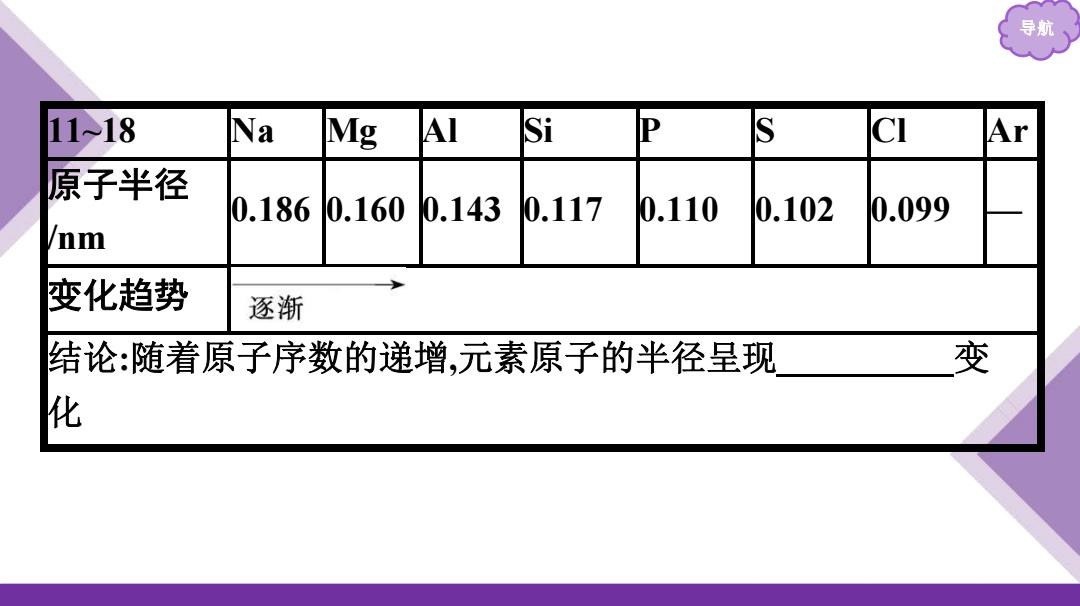
导航 11>18 Na Mg :A Si P CI Ar 原子半径 0.1860.160 0.143 0.117 0.110 0.102 0.099 /nm 变化趋势 逐渐 结论:随着原子序数的递增,元素原子的半径呈现 变 化
导航 11~18 Na Mg Al Si P S Cl Ar 原子半径 /nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099 — 变化趋势 结论:随着原子序数的递增,元素原子的半径呈现 周期性 变 化