
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
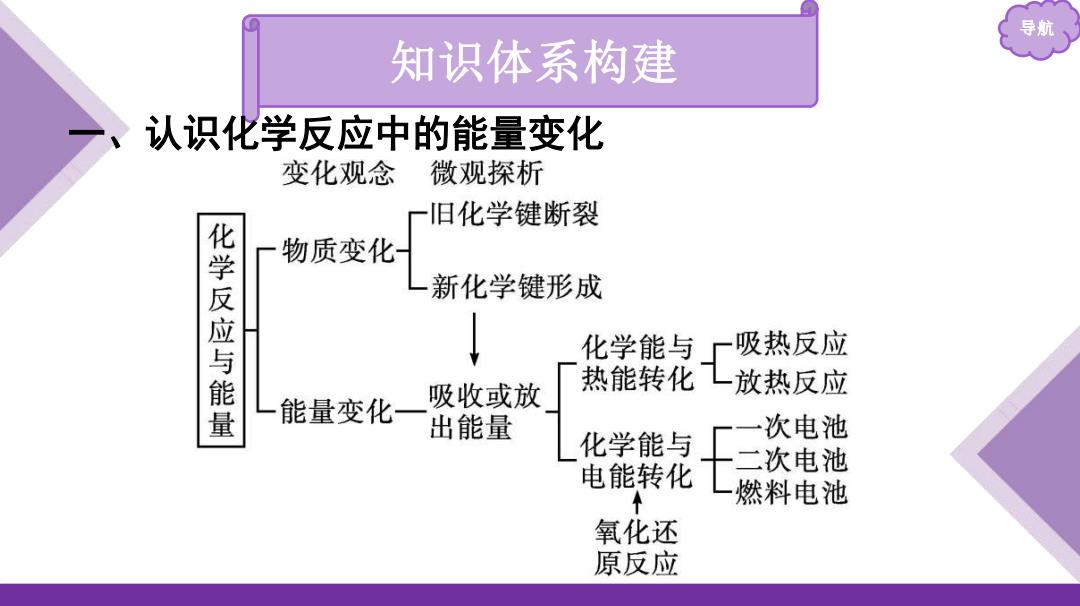
导航 知识体系构建 认识化学反应中的能量变化 变化观念 微观探析 一旧化学键断裂 物质变化 化学反应与能量 新化学键形成 化学能与 一吸热反应 热能转化L放热反应 能量变化一 吸收或放 出能量 次电池 化学能与 电能转化 燃料电池 氧化还 原反应
导航 知识体系构建 一、认识化学反应中的能量变化
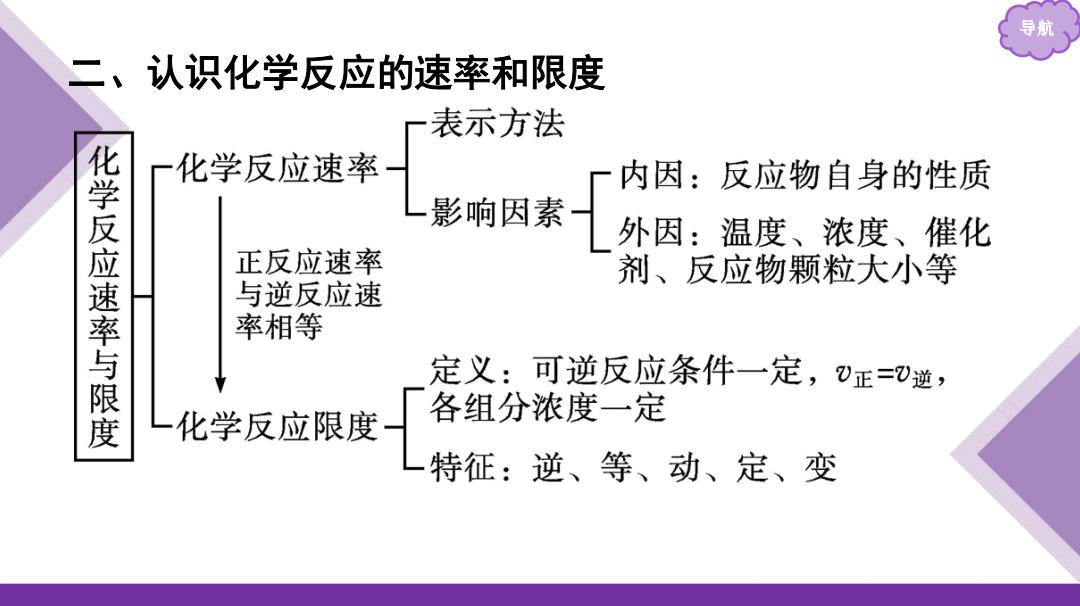
导期 二、认识化学反应的速率和限度 表示方法 一化学反应速率 内因:反应物自身的性质 化学反应速率与限度 影响因素 外因:温度、浓度、催化 正反应速率 剂、反应物颗粒大小等 与逆反应速 率相等 定义:可逆反应条件一定,正=⑦逆, 化学反应限度 各组分浓度一定 特征:逆、等、动、定、变
导航 二、认识化学反应的速率和限度
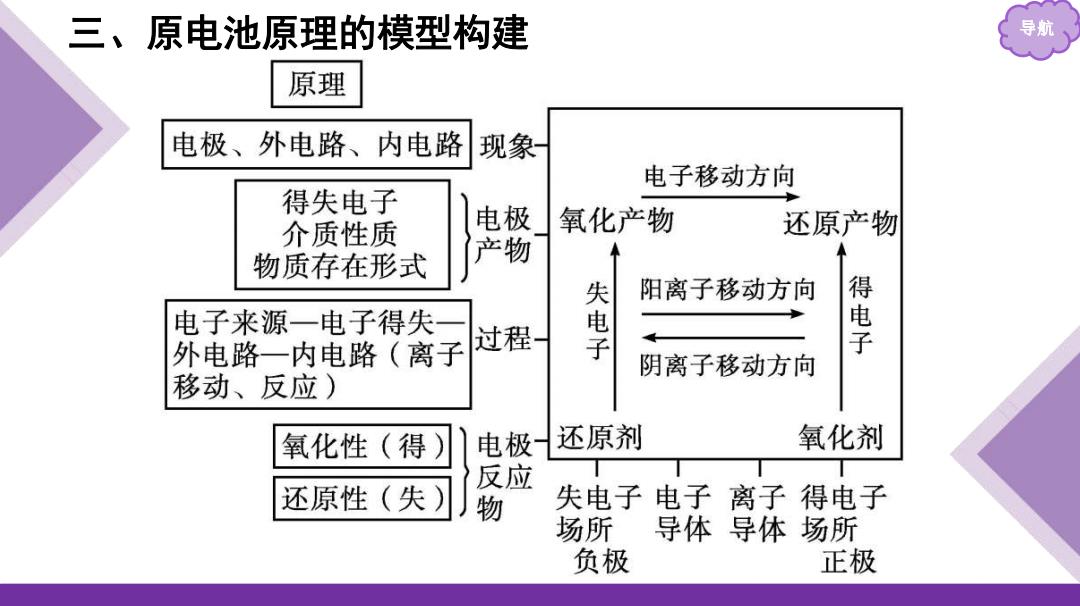
三、原电池原理的模型构建 导航 原理 电极、外电路、内电路 现象 电子移动方向 得失电子 介质性质 电 氧化产物 还原产物 物质存在形式 产物 阳离子移动方向 得 电子来源一电子得失 外电路一内电路(离子 过程 电子 子 阴离子移动方向 移动、反应) 氧化性(得) 电极 还原剂 氧化剂 反应 还原性(失) 失电子电子 离子 得电子 场所 导体导体场所 负极 正极
三、原电池原理的模型构建 导航

导航 专题归纳突破 专题一原电池的常见考查方式 1.正、负极的判断。 (1)负极的判断法。 ①相对活泼的电极由于本身被氧化而溶解。 ②通入该电极的为还原性气体,如H2、CH,等。 ③电子流出的一极
导航 专题归纳突破 专题一原电池的常见考查方式 1.正、负极的判断。 (1)负极的判断方法。 ①相对活泼的电极由于本身被氧化而溶解。 ②通入该电极的为还原性气体,如H2、CH4等。 ③电子流出的一极

导航 (2)正极的判断方法。 ①溶液中的阳离子(如H+、Cu+、Ag+等)在此电极放电。 ②溶液中溶解的0,在此电极得电子。 ③通入该电极的为氧化性气体,如02、C,等
导航 (2)正极的判断方法。 ①溶液中的阳离子(如H+ 、Cu2+ 、Ag+等)在此电极放电。 ②溶液中溶解的O2在此电极得电子。 ③通入该电极的为氧化性气体,如O2、Cl2等

2.电池反应式的书写。 导 ()一般原电池电极反应式的书写。 ①首先确定电极名称。 ②负极上电极材料本身发生氧化反应,正极上溶液中的粒子 发生还原反应。 ③根据电解质溶液确定电极反应后元素的存在形式。 ④弱电解质、气体和难溶物均写成化学式,其余的以离子符 号表示(注意:电解质溶液的成分对电极产物的影响;燃料电池 的电极材料本身不参与电极反应)。 ⑤根据电子守恒,使正、负极上得失电子总数相等
导航 2.电池反应式的书写。 (1)一般原电池电极反应式的书写。 ①首先确定电极名称。 ②负极上电极材料本身发生氧化反应,正极上溶液中的粒子 发生还原反应。 ③根据电解质溶液确定电极反应后元素的存在形式。 ④弱电解质、气体和难溶物均写成化学式,其余的以离子符 号表示(注意:电解质溶液的成分对电极产物的影响;燃料电池 的电极材料本身不参与电极反应)。 ⑤根据电子守恒,使正、负极上得失电子总数相等
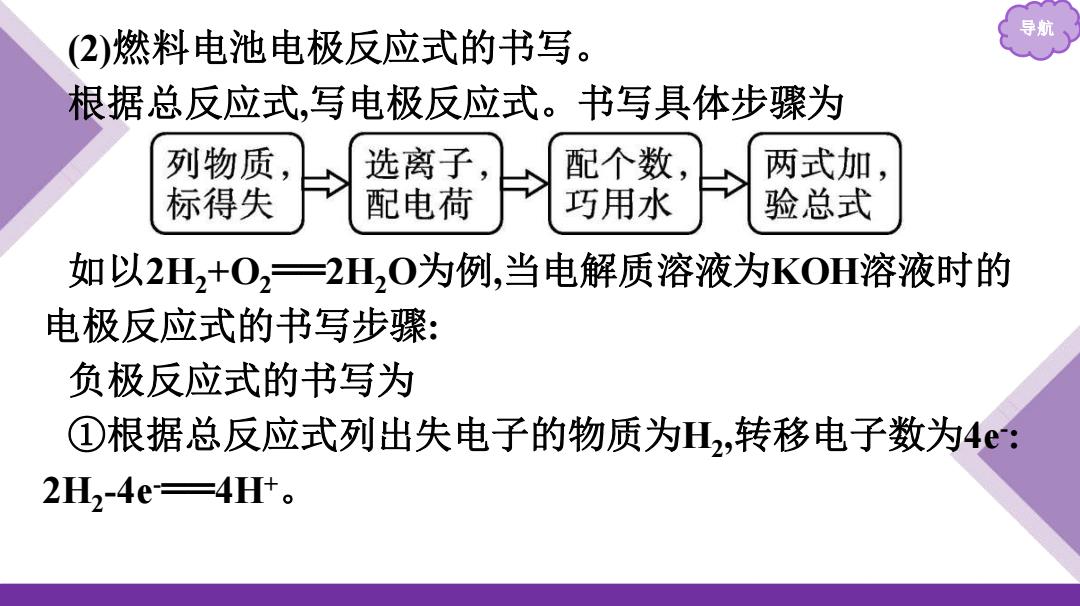
导 (2)燃料电池电极反应式的书写。 根据总反应式,写电极反应式。书写具体步骤为 列物质 选离子 配个数, 两式加, 标得失 配电荷 巧用水 验总式 如以2H2+02一2H2O为例,当电解质溶液为KOH溶液时的 电极反应式的书写步骤: 负极反应式的书写为 ①根据总反应式列出失电子的物质为H,转移电子数为4e: 2H2-4e=4H+
导航 (2)燃料电池电极反应式的书写。 根据总反应式,写电极反应式。书写具体步骤为 如以2H2+O2 ══2H2O为例,当电解质溶液为KOH溶液时的 电极反应式的书写步骤: 负极反应式的书写为 ①根据总反应式列出失电子的物质为H2 ,转移电子数为4e- : 2H2 -4e-══4H+

②根据电解质溶液呈喊性,用O配平,使两边电荷总数相 等:2H,+40H-4e=4H,0。 电子带负电荷,在碱性溶液中,电极反应式中不应出现。 ③利用H,0使两边的元素守恒,即得2H2+40H-4e=4H20。 同理,正极反应式的书写如下: ①02+4e=202-。 ②02+2H20+4e=40H。 在碱性溶液中提供H+使O2-变为OH的是水,水要写成化学 式的形式。 将正、负极反应式相加,若得到总反应式,说明书写正确
②根据电解质溶液呈碱性,用OH 导航 -配平,使两边电荷总数相 等:2H2+4OH- -4e-══4H2O。 电子带负电荷,在碱性溶液中,电极反应式中不应出现H+ 。 ③利用H2O使两边的元素守恒,即得2H2+4OH- -4e-══4H2O。 同理,正极反应式的书写如下: ①O2+4e-══2O2-。 ②O2+2H2O+4e-══4OH-。 在碱性溶液中提供H+使O2-变为OH-的是水,水要写成化学 式的形式。 将正、负极反应式相加,若得到总反应式,说明书写正确