
全程设计 第二节 元素周期律 第2课时 元素周期表和元素周期律的应用
第二节 元素周期律 第2课时 元素周期表和元素周期律的应用

课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随 堂 训 练
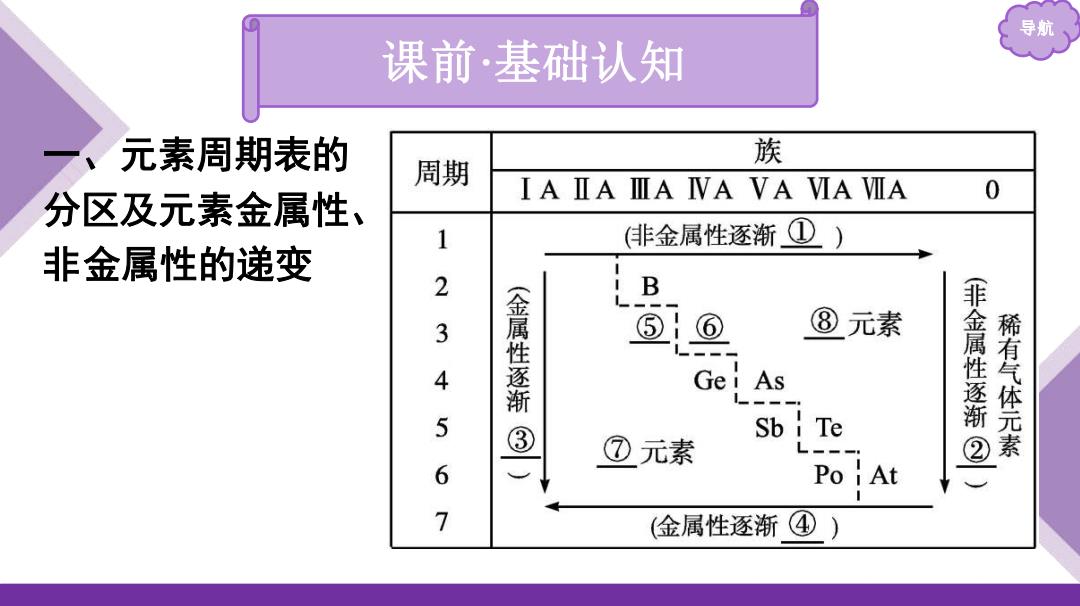
导航 课前·基础认知 、 元素周期表的 族 周期 IAⅡAⅢIA IVA VAVA VIA 分区及元素金属性、 0 1 (非金属性逐渐 ①) 非金属性的递变 2 B 3 4 (金属性逐 ⑤ ⑧元素 Gei As 5 ③ Sb i Te (非金属性逐渐② 稀有气体元素 ⑦元素 6 Po At 7 (金属性逐渐④)
导航 一、元素周期表的 分区及元素金属性、 非金属性的递变 课前 ·基础认知

导航 1.请填写出图中序号所表示的内容。 ;④ ⑤ 2.元素的金属性与非金属性之间并没有严格的界线,位于分 界线附近的元素既能表现出一定的 ,又能表现出 一定的
导航 1.请填写出图中序号所表示的内容。 ① 增强 ;② 减弱 ;③ 增强 ;④ 增强 ;⑤ Al ; ⑥ Si ;⑦ 金属 ;⑧ 非金属 。 2.元素的金属性与非金属性之间并没有严格的界线,位于分 界线附近的元素既能表现出一定的 金属性 ,又能表现出 一定的 非金属性

元素的化合价与元素在周期表中的位置之间的关系 1.一般情况下,主族元素的最高正化合价,等于它所处的族序 数,因为族序数与 数相同。 2.一般情况下,非金属元素的最高正化合价等于 ;而它的负化合价则等于 所以,非金属 元素的最高正化合价和它的负化合价的绝对值之和等于
导航 二、元素的化合价与元素在周期表中的位置之间的关系 1.一般情况下,主族元素的最高正化合价,等于它所处的族序 数,因为族序数与 最外层电子(价电子) 数相同。 2.一般情况下,非金属元素的最高正化合价等于 原子所能 失去或偏移的最外层电子数 ;而它的负化合价则等于 使 原子达到8电子稳定结构所需得到的电子数 。所以,非金属 元素的最高正化合价和它的负化合价的绝对值之和等于 8

导航 微思考短周期元素R的氢化物的化学式为HR,则该元素最 高价氧化物对应水化物的化学式是什么? 提示:氢化物的化学式为H,R,则R的负化合价为-2价,所以最 高正化合价为+6价,故该元素最高价氧化物对应水化物的化 学式为H2RO4
导航 微思考短周期元素R的氢化物的化学式为H2R,则该元素最 高价氧化物对应水化物的化学式是什么? 提示:氢化物的化学式为H2R,则R的负化合价为-2价,所以最 高正化合价为+6价,故该元素最高价氧化物对应水化物的化 学式为H2RO4

导 三、元素周期表和元素周期律的应用 1.元素在元素周期表中的位置,反映了元素的 和 。在认识了元素周期律以后,可以根据元素在周 期表中的 推测其原子结构和性质,并研究元素性质 的变化规律;也可以根据元素的原子结构推测其在周期表中 的 和 2.科学家依据元素周期律和周期表,对元素性质进行系统研 究,可以为新元素的发现以及预测它们的 提供线索
导航 三、元素周期表和元素周期律的应用 1.元素在元素周期表中的位置,反映了元素的 原子结构 和 性质 。在认识了元素周期律以后,可以根据元素在周 期表中的 位置 推测其原子结构和性质,并研究元素性质 的变化规律;也可以根据元素的原子结构推测其在周期表中 的 位置 和 性质 。 2.科学家依据元素周期律和周期表,对元素性质进行系统研 究,可以为新元素的发现以及预测它们的 原子结构和性质 提供线索

导 3.由于周期表中位置靠近的元素性质相近,在一定区域内寻 找元素、发现物质的新用途被视为一种相当有效的方法。 (1)在金属与非金属分界处可以找到 材料。 (2)研究 附近元素,制造新农药。 (3)在 中寻找制造催化剂和耐高温、耐腐蚀合 金的元素
导航 3.由于周期表中位置靠近的元素性质相近,在一定区域内寻 找元素、发现物质的新用途被视为一种相当有效的方法。 (1)在金属与非金属分界处可以找到 半导体 材料。 (2)研究 氟、氯、硫、磷、砷 附近元素,制造新农药。 (3)在 过渡元素 中寻找制造催化剂和耐高温、耐腐蚀合 金的元素

导 微训练主族元素储的最高化合价为+4价,且储位于硅的下一 周期,写出“锗”在周期表中的位置: 根据 锗在周期表中处于金属和非金属分界线附近,预测锗单质的 一种用途是 。硅和锗单质分别与 H反应时,友应较难进行的是 (填“硅”或“锗)。 答案:第四周期第VA族用作半导体材料锗
导航 微训练主族元素锗的最高化合价为+4价,且锗位于硅的下一 周期,写出“锗”在周期表中的位置: 。根据 锗在周期表中处于金属和非金属分界线附近,预测锗单质的 一种用途是 。硅和锗单质分别与 H2反应时,反应较难进行的是 (填“硅”或“锗”)。 答案:第四周期第ⅣA族 用作半导体材料 锗
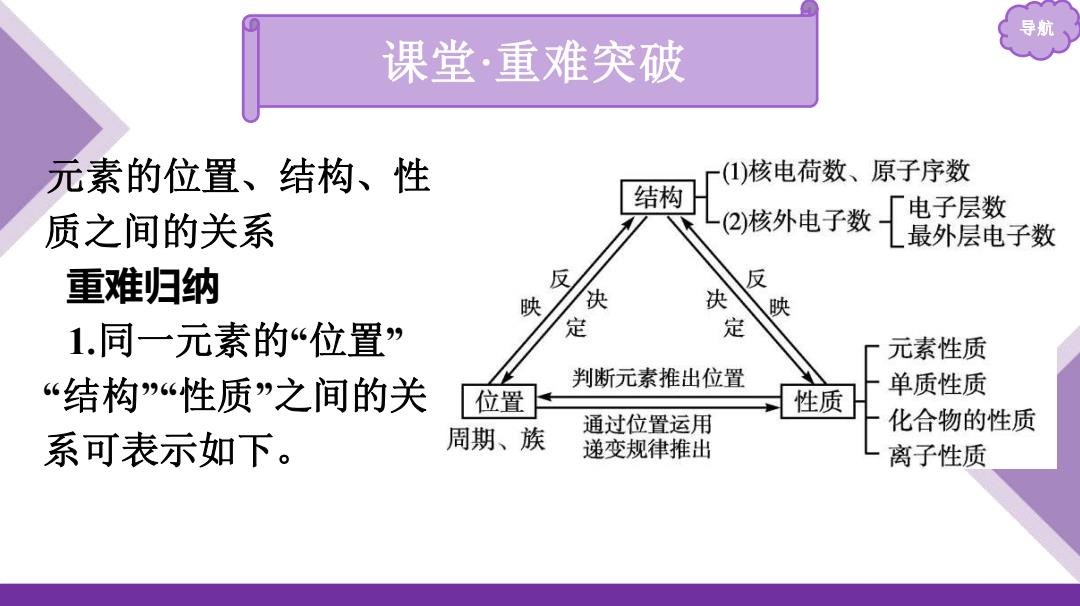
导期 课堂·重难突破 元素的位置、结构、性 (1)核电荷数、原子序数 结构 L(2)核外电子数 电子层数 质之间的关系 最外层电子数 重难归纳 反 反 映 决 决 映 1.同一元素的“位置” 定 定 元素性质 “结构“性质”之间的关 判断元素推出位置 单质性质 位置 性质 化合物的性质 系可表示如下。 周期、族 通过位置运用 递变规律推出 离子性质
导航 元素的位置、结构、性 质之间的关系 重难归纳 1.同一元素的“位置” “结构”“性质”之间的关 系可表示如下。 课堂·重难突破