
第五章 化学平衡 化学反应可以同时向正、反两个方向 进行,在一定条件下,当正反两个方向速率 相等时,体系就达到了平衡状态。不同的体 系,达到平衡所需的时间各不相同,但其共 同的特点是平衡后体系中各物质的数量均不 再随时间而改变,产物和反应物的数量之间 具有一定的关系,只要外界条件一经改变 平衡状态就要发生变化
1 第五章 化学平衡 化学反应可以同时向正、反两个方向 进行,在一定条件下,当正反两个方向速率 相等时,体系就达到了平衡状态。不同的体 系,达到平衡所需的时间各不相同,但其共 同的特点是平衡后体系中各物质的数量均不 再随时间而改变,产物和反应物的数量之间 具有一定的关系,只要外界条件一经改变, 平衡状态就要发生变化

在实际生产中需要知道,如何控制反应 条件,使反应按我们所需要的方向进行,在 给定条件下反应进行的最高限度是什么?等 等。这些问题是很重要的,尤其是在开发新 反应时就常常碰到设计新反应的问题。 把热力学基本原理和规律应用于化学反 应就可以从原则上确定反应进行的方向,平 衡的条件,反应所能达到的最高限度,以及 导出平稳时物质的数量关系,并用平衡常数 来表示
2 在实际生产中需要知道,如何控制反应 条件,使反应按我们所需要的方向进行,在 给定条件下反应进行的最高限度是什么?等 等。这些问题是很重要的,尤其是在开发新 反应时就常常碰到设计新反应的问题。 把热力学基本原理和规律应用于化学反 应就可以从原则上确定反应进行的方向,平 衡的条件,反应所能达到的最高限度,以及 导出平稳时物质的数量关系,并用平衡常数 来表示

§5.1 化学反应的等温方程 1.摩尔反应吉布斯函数变化 设反应为dD+eE+..→fF+gG. 或写作 O=∑VBB B 对多组分体系 dG=-SdT+Vdp+∑μBdnB 如果变化是在等温等压下进行的,则 dG=∑μgdhg
3 §5.1 化学反应的等温方程 1. 摩尔反应吉布斯函数变化 设反应为 dD + eE+…→ fF + gG… 或写作 = B 0 B B 对多组分体系 = − + + B dG SdT Vdp B dn B 如果变化是在等温等压下进行的,则 = B dG B dn B

根据反应进度的定义 d dn B dnB =Vedg 代入得 dG=∑VnHpdE 22 B △,Gm-摩尔反应吉布斯函数变化
4 根据反应进度的定义 B dn B d = dn = d B B = B 代入得 dG B B d = B T,P B B ) G ( = = B r m T,P B B ) G G ( rGm --摩尔反应吉布斯函数变化

G △,Gm=( I,P=∑VBdμB 分析: (1)△,Gm为在恒定温度、压力条件下,体系 吉布斯函数G随反应进度ξ的变化率,或在大 量体系中一个单位进度的化学反应时的吉布 斯函数的变化(体系大量,u基本不变)。 (2)AGm的量纲应为Jmo1,摩尔是指反应进 度为1摩尔
5 (1) rGm为在恒定温度、压力条件下,体系 吉布斯函数G随反应进度的变化率,或在大 量体系中一个单位进度的化学反应时的吉布 斯函数的变化(体系大量,i基本不变)。 = = B r m T,P B d B ) G G ( 分析: (2) rGm的量纲应为J·mol-1 , 摩尔是指反应进 度为1摩尔

3) (AGm)Ip=∑VBB0,反应向右不能自发 进行,逆向可自发 这就是化学反应方向和限度的判据,即 (AGm)T,p=∑VBuB≤0 自发 B 平衡
6 (3) 0,反应向右不能自发 进行,逆向可自发 = =0,反应达到平衡 B r m T,p B B ( G ) 这就是化学反应方向和限度的判据,即 = B r m T,p B B ( G ) ( G ) 0 B r m T,p = B B 自发 平衡

2.化学平衡的判据 (A,Gm)T,p=∑VBHB=0 B 为什么化学反应常常不能进行到底? 3.体系混合吉布斯函数对反应的影响 Ma(T.p)-(T)+RTin A,Gm=∑VBHB w0+2,RTn合)
7 2. 化学平衡的判据 ( G ) 0 B r m T,p = B B = 为什么化学反应常常不能进行到底? 3. 体系混合吉布斯函数对反应的影响 0 0 B B B P P (T,p) = (T) + RT ln = B r G m B B = + B B 0 B B 0 B B ) P P (T) RTln(
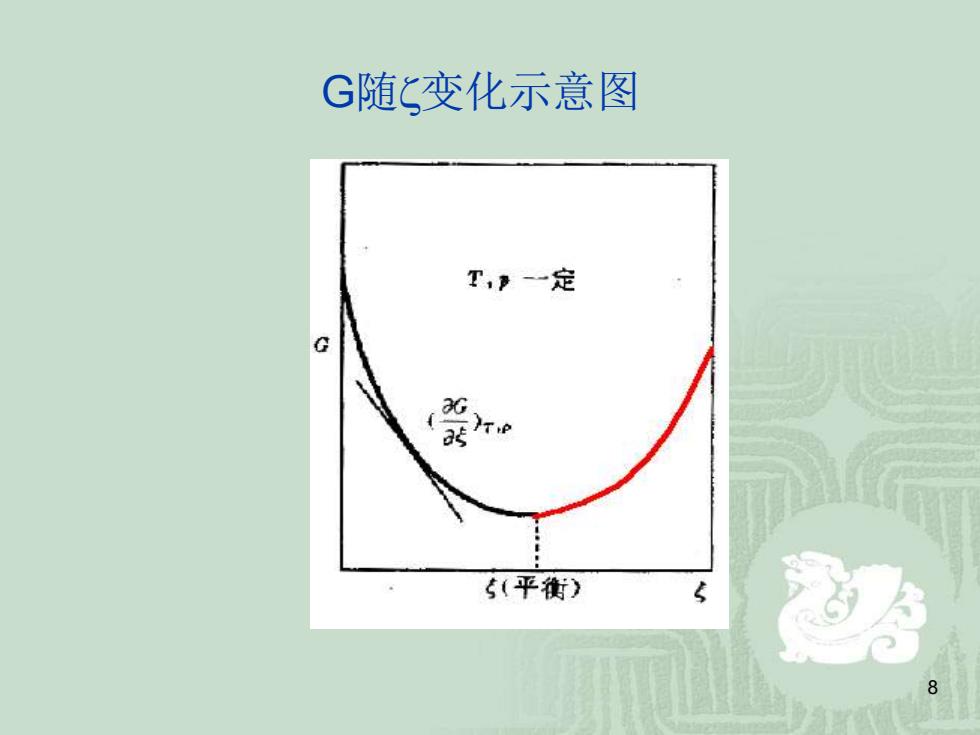
G随C变化示意图 T,》一定 5(平衡)
8 G随变化示意图
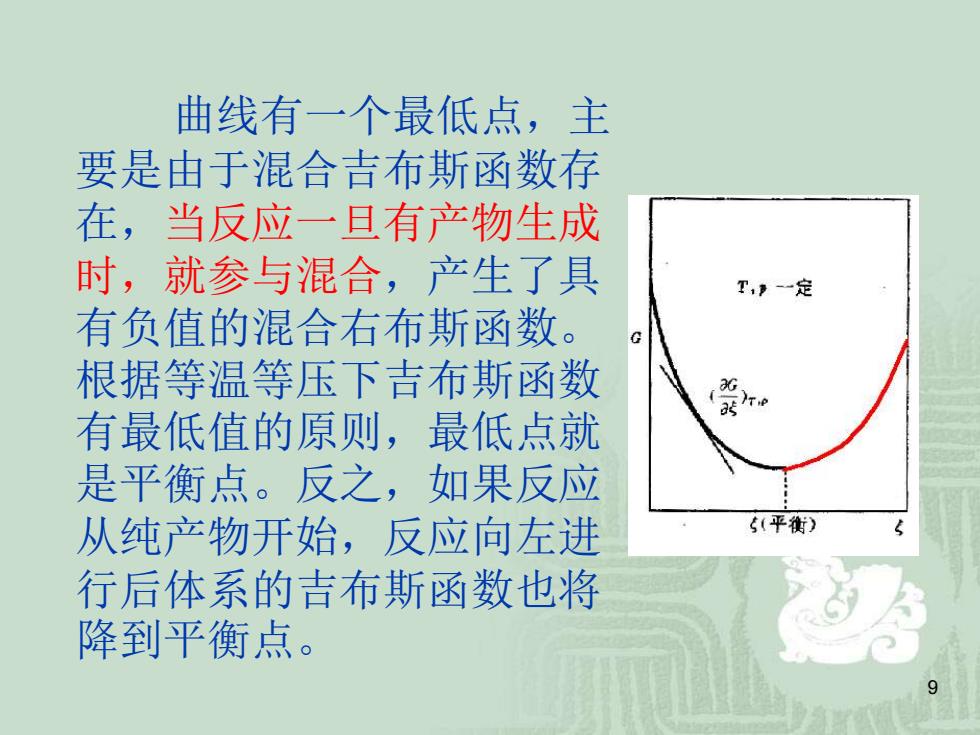
曲线有一个最低点,主 要是由于混合吉布斯函数存 在,当反应一旦有产物生成 时,就参与混合,产生了具 T,》-一定 有负值的混合右布斯函数。 根据等温等压下吉布斯函数 )e 有最低值的原则,最低点就 是平衡点。反之,如果反应 从纯产物开始,反应向左进 5(平衡) 行后体系的吉布斯函数也将 降到平衡点
9 曲线有一个最低点,主 要是由于混合吉布斯函数存 在,当反应一旦有产物生成 时,就参与混合,产生了具 有负值的混合右布斯函数。 根据等温等压下吉布斯函数 有最低值的原则,最低点就 是平衡点。反之,如果反应 从纯产物开始,反应向左进 行后体系的吉布斯函数也将 降到平衡点

4.化学反应亲和势 A=-A,Gm--( Q 对于给定的体系亲和势有定值,它决定 于体系的始终态而与反应的过程无关,与体 系的大小数量无关。客观上它仅与体系中各 物质的强度性质u有关。对于一个给定反应, 若自左至右的反应是自发进行的,则A>0, 即亲和势必为正值,这就体现了它具有“势” 的性质。对于逆向反应,亲和势必为负值, A<0,反应不能自发进行,而当体系达到平 衡时,则A=0。 10
10 4. 化学反应亲和势 = − = − = − B r m T,P B B ) G A G ( 对于给定的体系亲和势有定值,它决定 于体系的始终态而与反应的过程无关,与体 系的大小数量无关。客观上它仅与体系中各 物质的强度性质μ有关。对于一个给定反应, 若自左至右的反应是自发进行的,则A>0, 即亲和势必为正值,这就体现了它具有“势” 的性质。对于逆向反应,亲和势必为负值, A<0,反应不能自发进行,而当体系达到平 衡时,则A=0