
第三章食品中一般成分含量的测定 实验一食品中水分含量的测定(直接干燥法) 一、目的与要求 1.学习水分测定的意义和原理。 2.掌直接干燥法的操作技术和注意事项。 3.分析影响测定准确性的因素。 二、原理 在一定的温度(95~105℃)和压力(常压)下,将样品放在烘箱中加热干燥,除去蒸 发的水分,干燥前后样品的质量之差即为样品的水分含量。 三、仪器与试剂 1.仪器 ()电热恒温干燥箱: (2)扁形铝制或玻璃制称量瓶:内径60mm一70mm,高35mm以下 (3)干燥器: (4)分析天平。 2.试剂 ()盐酸溶液(6molL):量取100mL盐酸,缓缓倒入水中并稀释至200mL: (2)氢氧化钠溶液(6mo/L):称取24g氢氧化钠,加水溶解并稀释至100mL (3)海砂:取用水洗去泥土的海砂或河砂,先用6molL盐酸煮沸0.5h,用水洗至中性,再 用6moL氢氧化钠溶液煮沸0.5h,用水洗至中性,经105℃干燥备用。 四、测定步骤 1.称量瓶的准备 取洁净称量瓶,置于95105℃干燥箱中,瓶盖斜支于瓶边,加热0.5h一1.0h后, 盖好取出,置干燥器内冷却0.5h,称量。并重复干燥至恒重。 2.样品测定 (1)固体试样:称取2.00g~10.00g切碎或磨细的试样,放入已称至恒重的称量瓶中,试 样厚度约为5mm,弄平,立即加盖,精密称量后,置95~105℃干燥箱中,瓶盖斜支 于瓶边,干燥2h~4h后,盖好取出。放入干燥器内冷却0.5h后称量。然后再放入95~ 105℃干燥箱中干燥h左右,取出,放干燥器内冷却0.5h后再称量。至前后两次质量 差不超过2mg,即为恒重。 (②)半固体或液体试样:取洁净的蒸发皿,内加10.0g海砂及一根小玻棒,置于95℃~105 ℃干燥箱中,干燥05h~1.0h后取出,放入干燥器内冷却0.5h后称量,并重复干燥至 恒量。然后精密称取5g~10g试样,置于蒸发皿中,用小玻棒搅匀放在沸水浴上蒸干
第三章 食品中一般成分含量的测定 实验一 食品中水分含量的测定(直接干燥法) 一、目的与要求 1. 学习水分测定的意义和原理。 2. 掌握直接干燥法的操作技术和注意事项。 3.分析影响测定准确性的因素。 二、原理 在一定的温度(95~105℃)和压力(常压)下,将样品放在烘箱中加热干燥,除去蒸 发的水分,干燥前后样品的质量之差即为样品的水分含量。 三、仪器与试剂 1. 仪器 (1) 电热恒温干燥箱; (2)扁形铝制或玻璃制称量瓶:内径 60mm~70mm,高 35mm 以下; (3)干燥器; (4)分析天平。 2.试剂 (1) 盐酸溶液(6 mol/L):量取 100 mL 盐酸,缓缓倒入水中并稀释至 200 mL; (2) 氢氧化钠溶液(6 mol/L):称取 24g 氢氧化钠,加水溶解并稀释至 100 mL; (3) 海砂:取用水洗去泥土的海砂或河砂,先用 6mol/L 盐酸煮沸 0.5h,用水洗至中性,再 用 6mol/L 氢氧化钠溶液煮沸 0.5h,用水洗至中性,经 105℃干燥备用。 四、测定步骤 1. 称量瓶的准备 取洁净称量瓶,置于 95~105℃干燥箱中,瓶盖斜支于瓶边,加热 0.5h~1.0h 后, 盖好取出,置干燥器内冷却 0.5h,称量。并重复干燥至恒重。 2. 样品测定 (1) 固体试样:称取 2.00g~10.00g 切碎或磨细的试样,放入已称至恒重的称量瓶中,试 样厚度约为 5mm,弄平,立即加盖,精密称量后,置 95~105℃干燥箱中,瓶盖斜支 于瓶边,干燥 2h~4h 后,盖好取出。放入干燥器内冷却 0.5h 后称量。然后再放入 95~ 105℃干燥箱中干燥 1h 左右,取出,放干燥器内冷却 0.5h 后再称量。至前后两次质量 差不超过 2mg,即为恒重。 (2) 半固体或液体试样:取洁净的蒸发皿,内加 10.0g 海砂及一根小玻棒,置于 95℃~105 ℃干燥箱中,干燥 05h~1.0h 后取出,放入干燥器内冷却 0.5h 后称量,并重复干燥至 恒量。然后精密称取 5g~10g 试样,置于蒸发皿中,用小玻棒搅匀放在沸水浴上蒸干

并随时搅拌,擦去皿底的水滴,置入95℃~105℃干燥箱中干燥4h后,盖好取出,放 入干燥器内冷却0.5h后称量。以下按(1)自“然后再放入95℃~105℃干燥箱中干燥 h左右.”起依法操作。 五、结果计算 1.数据记录表 称量瓶质量烘干前样品和称量瓶 烘干后样品和称量瓶质量mg /mo/g 质量mg 3 恒重 2.计算公式 X=m-m×100 m11-1o 式中:X一样品中的水分含量,g100g: 一称量瓶的质量,g: m 计算结果保留三位有效数字。 六、注意事项 1.本法适用于在95~105℃下,不含或含其他挥发性物质甚微且对热稳定的食品: 2.经加热干燥的称量瓶要迅速放到干燥器中冷却:干燥器内一般采用硅胶作为干燥剂当其颜色 由蓝色减退或变成红色时,就及时更新,于135℃条件下烘干2~3h后,再重新使用。 3.直接干燥法的最低检出限量为0.002g,当取样量为2g时,方法检出限为0.10g/100g,方法 相对误差≤5%。 思考题 1.在下列情况下,水分测定的结果是偏高还是偏低?为什么? (1)样品粉碎不充分:(2)样品中含较多挥发性成分:(3)脂肪的氧化:(4)样品的吸湿性较 强:(5)美拉德反应:(6)样品表面结了谀皮:(7)装有样品的干燥器未密封好:(8)干燥器 中硅胶已受潮。 2.干燥器有什么作用?怎样正确地使用和维护干燥器? 3.为什么经加热干燥的称瓶要迅速放到干燥器内冷却后再称量:
并随时搅拌,擦去皿底的水滴,置入 95℃~105℃干燥箱中干燥 4h 后,盖好取出,放 入干燥器内冷却 0.5h 后称量。以下按(1)自“然后再放入 95℃~105℃干燥箱中干燥 1h 左右.”起依法操作。 五、结果计算 1. 数据记录表 称量瓶质量 烘干后样品和称量瓶质量/m2/g /m0/g 烘干前样品和称量瓶 质量/m1/g 1 2 3 恒重值 2. 计算公式 X= 100 1 0 1 2 × − − m m m m 式中:X——样品中的水分含量,g/100g; m0——称量瓶的质量,g; m1——称量瓶和样品的质量,g; m2——称量瓶和样品干燥后的质量,g。 计算结果保留三位有效数字。 六、注意事项 1. 本法适用于在 95~105℃下,不含或含其他挥发性物质甚微且对热稳定的食品; 2. 经加热干燥的称量瓶要迅速放到干燥器中冷却;干燥器内一般采用硅胶作为干燥剂当其颜色 由蓝色减退或变成红色时,就及时更新,于 135℃条件下烘干 2~3h 后,再重新使用。 3. 直接干燥法的最低检出限量为 0.002g,当取样量为 2g 时,方法检出限为 0.10g/100g,方法 相对误差≤5%。 思考题 1. 在下列情况下,水分测定的结果是偏高还是偏低?为什么? (1)样品粉碎不充分;(2)样品中含较多挥发性成分;(3)脂肪的氧化;(4)样品的吸湿性较 强;(5)美拉德反应;(6)样品表面结了硬皮;(7)装有样品的干燥器未密封好;(8)干燥器 中硅胶已受潮。 2. 干燥器有什么作用?怎样正确地使用和维护干燥器? 3. 为什么经加热干燥的称量瓶要迅速放到干燥器内冷却后再称量?
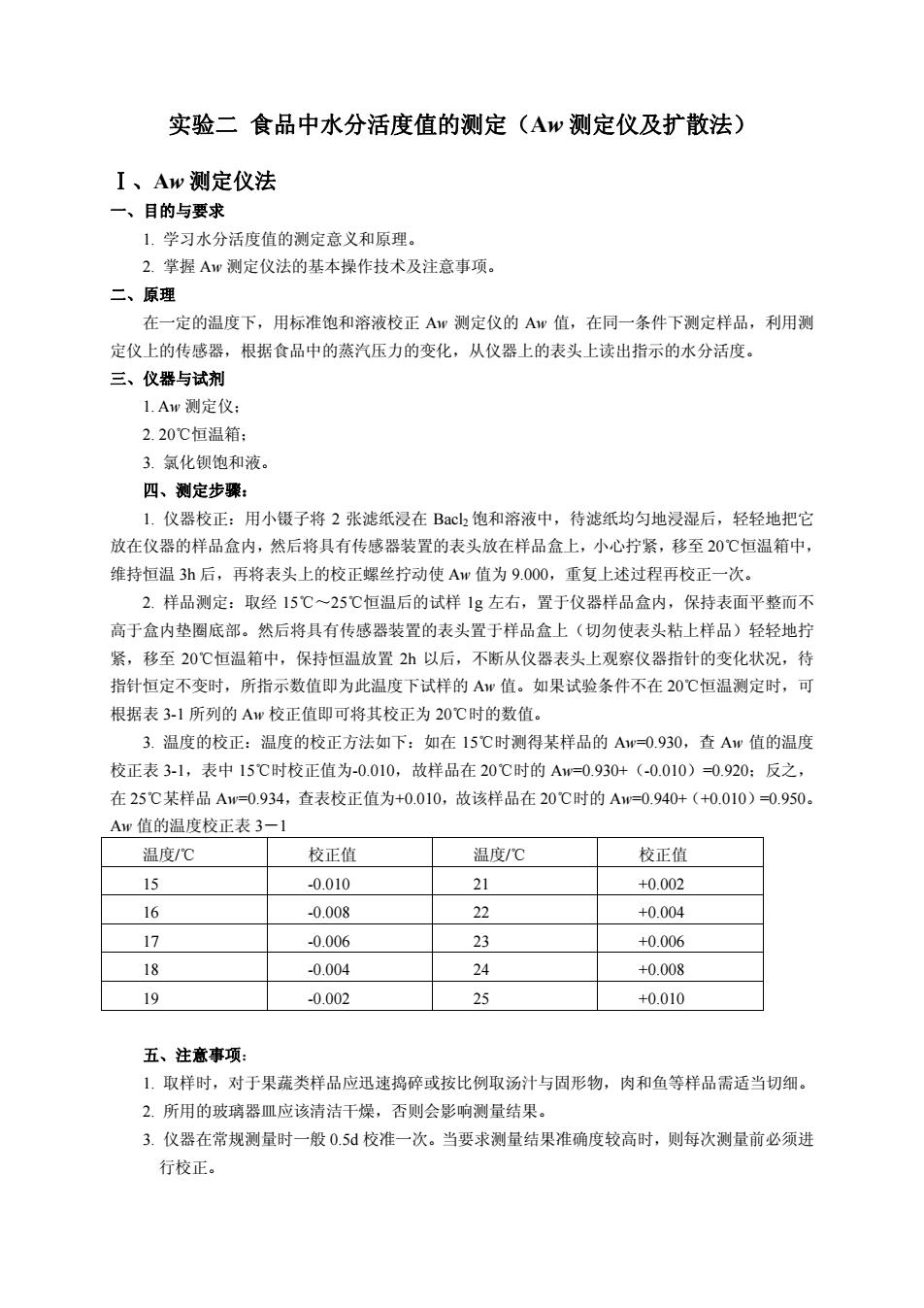
实验二食品中水分活度值的测定(Aw测定仪及扩散法) I、Aw测定仪法 一、目的与要求 1,学习水分活度值的测定意义和原理。 2.掌握Aw测定仪法的基本操作技术及注意事顶。 二、原理 在一定的温度下,用标准饱和溶液校正Aw测定仪的Aw值,在同一条件下测定样品,利用测 定仪上的传感器,根据食品中的蒸汽压力的变化,从仪器上的表头上读出指示的水分活度。 三、仪器与试剂 1.Aw测定仪 2.20℃恒温箱. 3.氯化钡饱和液 四、测定步臻: 1.仪器校正:用小镊子将2张滤纸浸在Bc山饱和溶液中,待滤纸均匀地浸湿后,轻轻地把它 放在仪器的样品盒内,然后将具有传感器装置的表头放在样品盒上,小心拧紧,移至20℃恒温箱中, 维持恒温3后,再将表头上的校正螺丝拧动使Aw值为9.000,重复上述过程再校正一次。 2.样品测定:取经15℃-25℃恒温后的试样1g左右,置于仪器样品盒内,保持表面平整而不 高于盒内垫圈底部。然后将具有传感器装置的表头置于样品盒上(切勿使表头粘上样品)轻轻地拧 紧,移至20℃恒温箱中,保持恒温放置2h以后,不断从仪器表头上观察仪器指针的变化状况,待 指针恒定不变时,所指示数值即为此温度下试样的A值。如果试验条件不在20℃恒温测定时,可 根据表3-1所列的A校正值即可将其校正为20℃时的数值。 3.温度的校正:温度的校正方法如下:如在15℃时测得某样品的Aw=0.930,查Aw值的温度 校正表3-1,表中15℃时校正值为-0.010,故样品在20C时的Aw=0.930+(-0.010)=0.920:反之, 在25℃某样品Aw=0.934,查表校正值为+0.010,故该样品在20℃时的A=0.940+(+0.010)-0.950。 A世值的温府校正表3一 温度/℃ 校正值 温度℃ 校正值 15 -0.010 21 +0.002 16 0008 22 +0004 17 0006 3 +0.006 18 -0.004 24 +0.008 19 -0.002 25 +0.010 五、注意事项: 1,取样时,对于果蔬类样品应迅速捣碎或按比例取汤汁与固形物, 肉和鱼等样品需适当切细。 2.所用的破离器皿应该清洁干燥,否则会影响测量结果。 3.仪器在常规测量时一般0.5校准一次。当要求测量结果准确度较高时,则每次测量前必须进 行校正
实验二 食品中水分活度值的测定(Aw 测定仪及扩散法) Ⅰ、Aw 测定仪法 一、目的与要求 1. 学习水分活度值的测定意义和原理。 2. 掌握 Aw 测定仪法的基本操作技术及注意事项。 二、原理 在一定的温度下,用标准饱和溶液校正 Aw 测定仪的 Aw 值,在同一条件下测定样品,利用测 定仪上的传感器,根据食品中的蒸汽压力的变化,从仪器上的表头上读出指示的水分活度。 三、仪器与试剂 1. Aw 测定仪; 2. 20℃恒温箱; 3. 氯化钡饱和液。 四、测定步骤: 1. 仪器校正:用小镊子将 2 张滤纸浸在 Bacl2 饱和溶液中,待滤纸均匀地浸湿后,轻轻地把它 放在仪器的样品盒内,然后将具有传感器装置的表头放在样品盒上,小心拧紧,移至 20℃恒温箱中, 维持恒温 3h 后,再将表头上的校正螺丝拧动使 Aw 值为 9.000,重复上述过程再校正一次。 2. 样品测定:取经 15℃~25℃恒温后的试样 1g 左右,置于仪器样品盒内,保持表面平整而不 高于盒内垫圈底部。然后将具有传感器装置的表头置于样品盒上(切勿使表头粘上样品)轻轻地拧 紧,移至 20℃恒温箱中,保持恒温放置 2h 以后,不断从仪器表头上观察仪器指针的变化状况,待 指针恒定不变时,所指示数值即为此温度下试样的 Aw 值。如果试验条件不在 20℃恒温测定时,可 根据表 3-1 所列的 Aw 校正值即可将其校正为 20℃时的数值。 3. 温度的校正:温度的校正方法如下:如在 15℃时测得某样品的 Aw=0.930,查 Aw 值的温度 校正表 3-1,表中 15℃时校正值为-0.010,故样品在 20℃时的 Aw=0.930+(-0.010)=0.920;反之, 在 25℃某样品 Aw=0.934,查表校正值为+0.010,故该样品在 20℃时的 Aw=0.940+(+0.010)=0.950。 Aw 值的温度校正表 3-1 温度/℃ 校正值 温度/℃ 校正值 15 -0.010 21 +0.002 16 -0.008 22 +0.004 17 -0.006 23 +0.006 18 -0.004 24 +0.008 19 -0.002 25 +0.010 五、注意事项: 1. 取样时,对于果蔬类样品应迅速捣碎或按比例取汤汁与固形物,肉和鱼等样品需适当切细。 2. 所用的玻璃器皿应该清洁干燥,否则会影响测量结果。 3. 仪器在常规测量时一般 0.5d 校准一次。当要求测量结果准确度较高时,则每次测量前必须进 行校正
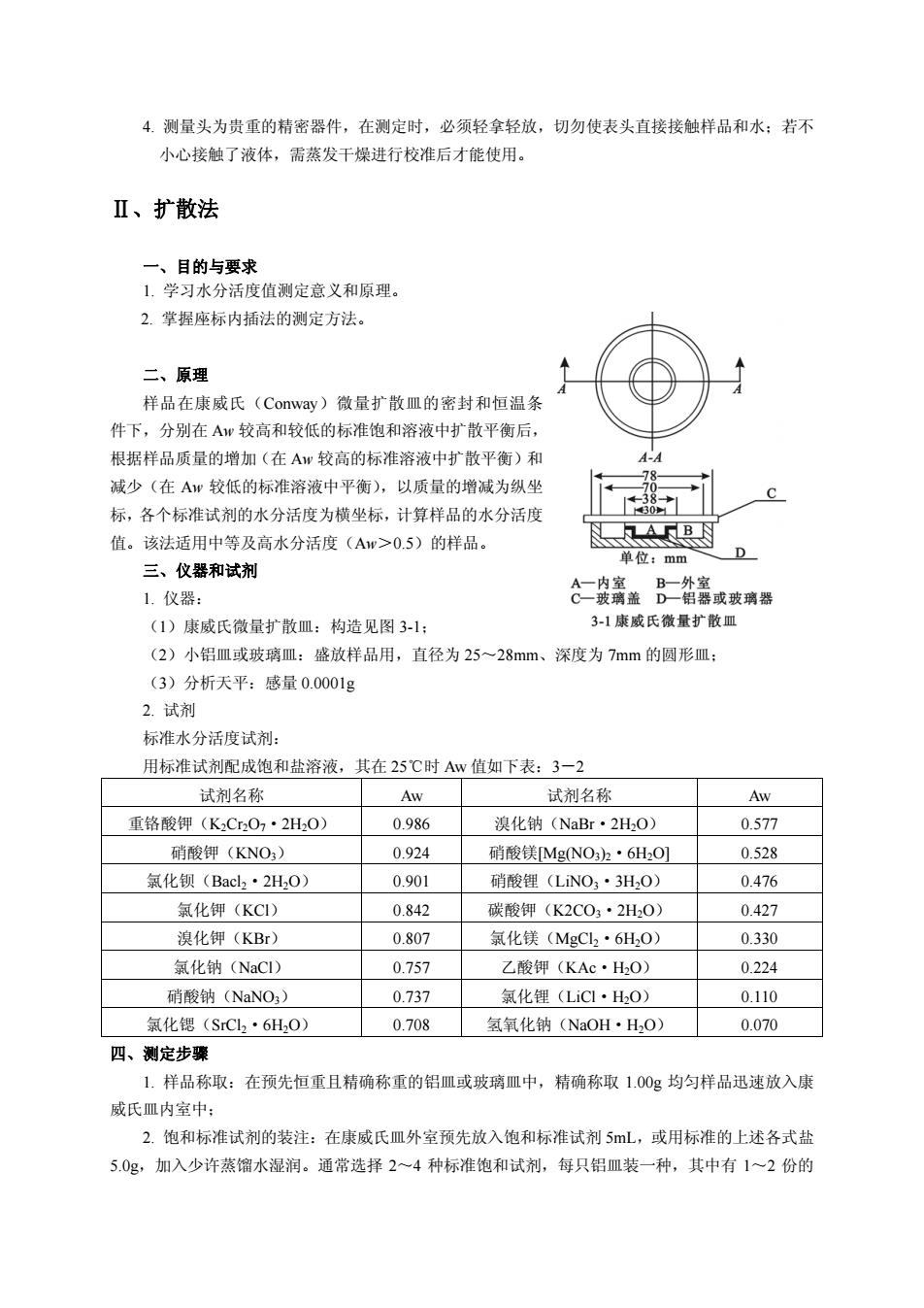
4.测量头为贵重的精密器件,在测定时,必须轻拿轻放,切勿使表头直接接触样品和水:若不 小心接触了液体,需蒸发干燥进行校准后才能使用。 Ⅱ、扩散法 一、目的与要求 1.学习水分活度值测定意义和原理 2.掌握座标内插法的测定方法。 二、原理 样品在康威氏(Conway)微量扩散皿的密封和恒温条 件下,分别在Aw较高和较低的标准饱和溶液中扩散平衡后 根据样品质量的增加(在Aw较高的标准溶液中扩散平衡)和 减少(在A较低的标准溶液中平衡),以质量的增减为纵坐 38 标,各个标准试剂的水分活度为横坐标,计算样品的水分活度 值。该法适用中等及高水分活度(Aw>0.5)的样品。 AB因 单位:mm 三、仪器和试剂 1.仪器: (1)康威氏微量扩散皿:构造见图31 3-1康威氏微量扩散皿 (2)小铝皿或玻璃皿:盛放样品用,直径为25一28mm、深度为7mm的圆形皿: (3)分析天平:感量0.0001g 2.试剂 标准水分活度试剂: 用标准试剂配成饱和盐溶液,其在25℃时Aw值如下表:3一2 试剂名称 Aw 试剂名称 Aw 重铬酸钾(KCr207·2H20) 0.986 溴化钠(NaBr·2H,O) 0.577 硝酸钾(KNO) 0.924 硝酸镁MgNO32·6HO] 0.528 氯化钡(Bacl2·2H,0) 0.901 硝酸锂(LNO·3HO) 0.476 氢化钾(KC1) 0.842 碳酸钾(K2CO2·2H0) 0.427 溴化钾(KBr) 0.807 氯化镁(MgCl·6H,0 0.330 氯化钠(NaCI) 0.757 乙酸钾(KAC·H,O) 0224 硝酸钠(NaNO) 0.737 氯化锂(LiCl·HO) 0.110 氯化锶(SrC2·6H20) 0708 氢氧化钠(NaOH·H,O) 0.070 四、测定步骤 1,样品称取:在预先恒重且精确称重的铝皿或玻璃皿中, 精确称取1.00g均匀样品迅速放入康 威氏皿内室中: 2.饱和标准试剂的装注:在康威氏皿外室预先放入饱和标准试剂5mL, 或用标准的上述各式盐 5.0g,加入少许蒸馏水湿润。通常选择2一4种标准饱和试剂,每只铝皿装一种,其中有1一2份的
4. 测量头为贵重的精密器件,在测定时,必须轻拿轻放,切勿使表头直接接触样品和水;若不 小心接触了液体,需蒸发干燥进行校准后才能使用。 Ⅱ、扩散法 一、目的与要求 1. 学习水分活度值测定意义和原理。 2. 掌握座标内插法的测定方法。 二、原理 样品在康威氏(Conway)微量扩散皿的密封和恒温条 件下,分别在 Aw 较高和较低的标准饱和溶液中扩散平衡后, 根据样品质量的增加(在 Aw 较高的标准溶液中扩散平衡)和 减少(在 Aw 较低的标准溶液中平衡),以质量的增减为纵坐 标,各个标准试剂的水分活度为横坐标,计算样品的水分活度 值。该法适用中等及高水分活度(Aw>0.5)的样品。 三、仪器和试剂 1. 仪器: (1)康威氏微量扩散皿:构造见图 3-1; (2)小铝皿或玻璃皿:盛放样品用,直径为 25~28mm、深度为 7mm 的圆形皿; (3)分析天平:感量 0.0001g 2. 试剂 标准水分活度试剂: 用标准试剂配成饱和盐溶液,其在 25℃时 Aw 值如下表:3-2 试剂名称 Aw 试剂名称 Aw 重铬酸钾(K2Cr2O7·2H2O) 0.986 溴化钠(NaBr·2H2O) 0.577 硝酸钾(KNO3) 0.924 硝酸镁[Mg(NO3)2·6H2O] 0.528 氯化钡(Bacl2·2H2O) 0.901 硝酸锂(LiNO3·3H2O) 0.476 氯化钾(KCl) 0.842 碳酸钾(K2CO3·2H2O) 0.427 溴化钾(KBr) 0.807 氯化镁(MgCl2·6H2O) 0.330 氯化钠(NaCl) 0.757 乙酸钾(KAc·H2O) 0.224 硝酸钠(NaNO3) 0.737 氯化锂(LiCl·H2O) 0.110 氯化锶(SrCl2·6H2O) 0.708 氢氧化钠(NaOH·H2O) 0.070 四、测定步骤 1. 样品称取:在预先恒重且精确称重的铝皿或玻璃皿中,精确称取 1.00g 均匀样品迅速放入康 威氏皿内室中; 2. 饱和标准试剂的装注:在康威氏皿外室预先放入饱和标准试剂 5mL,或用标准的上述各式盐 5.0g,加入少许蒸馏水湿润。通常选择 2~4 种标准饱和试剂,每只铝皿装一种,其中有 1~2 份的

Aw值大于或小于试样的Aw值: 3加盖密封及平衡:接着在康威氏皿磨口边缘均匀涂上真空脂或凡土林,样品放入后,迅速加 盖密封,并移至(25士0.5)℃的恒温箱中放置2(±0.5)h,(几乎绝大多数样品可在2h后测得Aw): 4.取出铝皿或玻璃皿,用分析天平迅速称量: 5.再次平衡0.5h后,称重,直至恒重。分别计算各样品的质量增减数: 6.数据记录表 样品质量增减 标准试剂 样品质量初读数/g 2h后样品质量/但 2.5h后样品质量g 样品质量增减数/mg 五、结果计算 1.Aw值测定图绘制 以各种标准饱和溶液在25℃时的Aw值为横坐标,样品的质量增减数为纵坐标,在坐标纸上作 图,将各点连结成一条直线,这条线与横坐标的交点即为所侧样品的水分活度值。 2水分活度值的计算实例 某食品的样品在硝酸钾标准饱和溶液平衡下增重 为A点 在氯化钡标准饱和溶液中增重 为B 点,在氯化钾中减重9mg,为C点,在溴化钾中减重15m 为D点,如图32所示,把A、B、C、D四点连成一线, 与横坐标交可E点,即可求得其Aw=0.878。 0.878 六、注意事项 1,在测定Aw之前,需要对样品进行预处理。 k2812H02 固体、液体或流动的浓稠状样品,可直接取样进行称 图3-2Aw值测定图解 量:对瓶装固液混合样品可取液体部分称量:对组分复杂 的混合样品,则应取有代表性的混合均匀的样品称量】 2.样品称量应注意精确度,否则会造成测定误差。 3.取样时应迅速,各份样品称量应在同一条件下进行! 4.康威氏皿应该具有良好的密封性。 5.绝大多数样品在2h后可测得Aw,但有的样品如米饭类、油脂类、油浸烟熏类则需1~4天 左右时间才能测定。则先测定2h后的样品质量,然后间隔一定时间称量,再作坐标求出,为此,需 加入样品最0.2%的山梨酸作防腐剂,并以其水溶液作空白。 思考题 1.请闸述水分活度值的概念以及它在食品工业生产中的重要意义。 2.比较Aw测定仪法及扩散法两种方法测定水分活度值,各有什么优缺点?
Aw 值大于或小于试样的 Aw 值; 3. 加盖密封及平衡:接着在康威氏皿磨口边缘均匀涂上真空脂或凡土林,样品放入后,迅速加 盖密封,并移至(25±0.5)℃的恒温箱中放置 2(±0.5)h,(几乎绝大多数样品可在 2h 后测得 Aw); 4. 取出铝皿或玻璃皿,用分析天平迅速称量; 5. 再次平衡 0.5h 后,称重,直至恒重。分别计算各样品的质量增减数; 6. 数据记录表 样品质量初读数/g 2h 后样品质量/g 2.5h 后样品质量/g 样品质量增减数/mg 五、结果计算 1. Aw 值测定图绘制 以各种标准饱和溶液在 25℃时的 Aw 值为横坐标,样品的质量增减数为纵坐标,在坐标纸上作 图,将各点连结成一条直线,这条线与横坐标的交点即为所侧样品的水分活度值。 2. 水分活度值的计算实例 某食品的样品在硝酸钾标准饱和溶液平衡下增重 7mg,为 A 点,在氯化钡标准饱和溶液中增重 3mg,为 B 点,在氯化钾中减重 9mg,为 C 点,在溴化钾中减重 15mg, 为 D 点,如图 3-2 所示,把 A、B、C、D 四点连成一线, 与横坐标交可 E 点,即可求得其 Aw=0.878。 六、注意事项 1. 在测定 Aw 之前,需要对样品进行预处理。 固体、液体或流动的浓稠状样品,可直接取样进行称 量;对瓶装固液混合样品可取液体部分称量;对组分复杂 的混合样品,则应取有代表性的混合均匀的样品称量。 2. 样品称量应注意精确度,否则会造成测定误差。 3. 取样时应迅速,各份样品称量应在同一条件下进行。 4. 康威氏皿应该具有良好的密封性。 5. 绝大多数样品在 2h 后可测得 Aw,但有的样品如米饭类、油脂类、油浸烟熏类则需 1~4 天 左右时间才能测定。则先测定 2h 后的样品质量,然后间隔一定时间称量,再作坐标求出,为此,需 加入样品量 0.2%的山梨酸作防腐剂,并以其水溶液作空白。 思考题 1. 请阐述水分活度值的概念以及它在食品工业生产中的重要意义。 2.比较 Aw 测定仪法及扩散法两种方法测定水分活度值,各有什么优缺点? 标 准 试 剂 样 品 质 量 增 减

实验三食品中总灰分含量的测定 一、目的与要求 1.学习食品中总灰分测定的意义和原理 2.掌握称重法测定灰分的基本操作技术及测定条件的选择 3.学会用减重法称取试样。 二、原理 将样品经炭化后置于500~600℃高温炉内灼烧,样品中的水分及挥发物质以气态放出,有 机物质中的碳、氢、氮等元素与有机物质本身的氧及空气中的氧生成二氧化碳、氮氧化物及水分而 散失,无机物以硫酸盐、磷酸盐、碳酸盐、氧化物等无机盐和金屈氧化物的形式残留下来,这些残 留物即为灰分,称景残留物的质最即可计算出样品中总灰分的含最 三、仪器 1.高温电炉(马福炉): 2坩据钳: 3.带盖坩埚(石英坩埚或瓷坩埚) 4.分析天平 5.千燥器 四、测定步骤: 1.瓷坩埚的准备 将坩埚用盐酸(1:4)煮12h,洗净晾干后,用三氯化铁与蓝墨水的混合液在坩埚外壁及 盖上写上编号,置于马弗炉中,在550℃±25℃下灼烧0.5h,冷至200℃以下后,取出,放入干 燥器中冷至室温,准确称最,并重复灼烧至恒重。(两次称量之差不超过0.5mg) 2.样品的预处理 (1)样品的取量:以灰分量10一100g来决定试样的采取量。通常如奶粉、大豆粉、调味料 鱼类及海产品等取1~2g:谷类食品、肉及肉制品、糕点、牛乳取3~5g:蔬菜及其制品、糖及糖制 品、淀粉及其制品、奶油、蜂蜜等取5~10g:水果及其制品取20g:油脂取50g (2)样品的处理 a果汁、牛乳等液体试样:准确称取适最试样于已知质量的坩埚中,先在沸水浴上蒸干,再进 行炭化。 b.果疏、动物组织等含水分较多的试样:先制备成均匀的试样,再准确称取适量试样于已知质 量坩埚中,置烘箱中干燥后,再进行炭化。 ©.谷物、豆类等水分含量较少的固体试样:先粉碎成均匀的试样,取适量于已知质量的坩埚中 进行炭化。 d.富含脂肪的样品:把试样制各均匀,准确称取一定量试样,先提取脂肪,再将残留物移入已 知质最的坩埚中,进行炭化。 3.样品的炭化:试样经上述预处理后,以小火加热使试样充分炭化至无烟 4.样品的灰化:将炭化后的试样置与弗炉中,在550℃±25℃灼烧4h。冷至200℃以下后取出 放入干燥器中冷却30m,在称量前如灼烧残渣有炭粒时,向试样中滴入少许水湿润,使结块松散
实验三 食品中总灰分含量的测定 一、目的与要求 1. 学习食品中总灰分测定的意义和原理 2. 掌握称重法测定灰分的基本操作技术及测定条件的选择; 3. 学会用减重法称取试样。 二、原理 将样品经炭化后置于 500~600℃高温炉内灼烧,样品中的水分及挥发物质以气态放出,有 机物质中的碳、氢、氮等元素与有机物质本身的氧及空气中的氧生成二氧化碳、氮氧化物及水分而 散失,无机物以硫酸盐、磷酸盐、碳酸盐、氧化物等无机盐和金属氧化物的形式残留下来,这些残 留物即为灰分,称量残留物的质量即可计算出样品中总灰分的含量。 三、仪器 1. 高温电炉(马福炉); 2. 坩埚钳; 3.带盖坩埚(石英坩埚或瓷坩埚) 4. 分析天平 5. 干燥器 四、测定步骤: 1. 瓷坩埚的准备 将坩埚用盐酸(1∶4)煮 1~2h,洗净晾干后,用三氯化铁与蓝墨水的混合液在坩埚外壁及 盖上写上编号,置于马弗炉中,在 550℃±25℃下灼烧 0.5h,冷至 200℃以下后,取出,放入干 燥器中冷至室温,准确称量,并重复灼烧至恒重。(两次称量之差不超过 0.5mg) 2. 样品的预处理 (1)样品的取量:以灰分量 10~100mg 来决定试样的采取量。通常如奶粉、大豆粉、调味料、 鱼类及海产品等取 1~2g;谷类食品、肉及肉制品、糕点、牛乳取 3~5g;蔬菜及其制品、糖及糖制 品、淀粉及其制品、奶油、蜂蜜等取 5~10g;水果及其制品取 20g;油脂取 50g。 (2)样品的处理 a. 果汁、牛乳等液体试样:准确称取适量试样于已知质量的坩埚中,先在沸水浴上蒸干,再进 行炭化。 b. 果疏、动物组织等含水分较多的试样:先制备成均匀的试样,再准确称取适量试样于已知质 量坩埚中,置烘箱中干燥后,再进行炭化。 c. 谷物、豆类等水分含量较少的固体试样:先粉碎成均匀的试样,取适量于已知质量的坩埚中 进行炭化。 d. 富含脂肪的样品:把试样制备均匀,准确称取一定量试样,先提取脂肪,再将残留物移入已 知质量的坩埚中,进行炭化。 3. 样品的炭化:试样经上述预处理后,以小火加热使试样充分炭化至无烟。 4. 样品的灰化:将炭化后的试样置与弗炉中,在 550℃±25℃灼烧 4h。冷至 200℃以下后取出 放入干燥器中冷却 30min,在称量前如灼烧残渣有炭粒时,向试样中滴入少许水湿润,使结块松散
蒸出水分再次灼烧直至无炭粒即灰化完全,冷至200℃以下后,取出放入干燥器中冷却30mi加后, 准确称量。重复灼烧至前后两次称量相差不超过0.5mg为恒重。 五、结果计算 1.数据记录表 空坩埚质量 样品和坩埚质量 残灰和坩埚质量/m/ /mig /m/g 1 3 恒重值 2.计算公式 X-m-m×10% m2-m, 式中 X一样品中总灰分的含量: m -空坩埚的质量,g: 一样品和坩埚的质量,g: m 一残灰加和坩埚的质量,g 计算结果保留三位有效数字。 六、注意事项 1,样品炭化时要注意热源强度,防止产生大量泡沫溢出坩埚:只有在炭化完全,即不目烟后才 能放入高温电炉中,且灼烧空坩埚与灼烧样品的条件应尽量一致,以消除系统误差。 2.把坩埚放入高温炉或从炉中取出时,要在炉口停留片刻,使坩埚预热或冷却。防止因温度副 变而使坩埚破裂 3.灼烧后的坩埚应冷却到200℃以下再移入干燥器中,否则因热动对流作用,易造成残灰飞散, 且冷却速度慢,冷却后干燥器内形成较大真空,盖子不易打开: 4.对于含糖分、淀粉、蛋白质较高的样品,为防止其发泡溢出,炭化前可加数滴纯植物油。 5.新坩埚在使用前须在盐酸溶液(1+4)中煮沸1~2h,然后用自来水和蒸馏水分别冲洗干净并 烘干。用过的旧坩埚经初步清洗后,可用废盐酸浸泡20min左右,再用水冲洗干净。 6.反复灼烧至恒重是判断灰化是否完全最可靠的方法。因为有些样品即使灰化完全,残留也不 一定是白色或灰白色,例如铁含量高的食品,残灰呈褐色:锰、铜含量高的食品,残灰呈蓝绿色: 而有时即使灰的表面呈白色或灰白色,但内部仍有炭粒存留。 7.灼烧温度不能超过600℃,否则会造成钾、钠、氯等易挥发成分的损失。 思老题: 1.测定食品的灰分的意义何在? 2.为什么样品在高温灼烧前,要先炭化至无烟? 3.样品经长时间灼烧后,灰分中仍有炭粒遗留的主要原因是什么?如何处理? 4.如何判断样品是否灰化完全?
蒸出水分再次灼烧直至无炭粒即灰化完全,冷至 200℃以下后,取出放入干燥器中冷却 30min 后, 准确称量。重复灼烧至前后两次称量相差不超过 0.5mg 为恒重。 五、结果计算 1. 数据记录表 空坩埚质量 残灰和坩埚质量/ m3/g /m1/g 样品和坩埚质量 /m2/g 1 2 3 恒重值 2. 计算公式 X= 100% 2 1 3 1 × − − m m m m 式中: X——样品中总灰分的含量; m1——空坩埚的质量,g; m2——样品和坩埚的质量,g; m3——残灰加和坩埚的质量,g。 计算结果保留三位有效数字。 六、注意事项 1. 样品炭化时要注意热源强度,防止产生大量泡沫溢出坩埚;只有在炭化完全,即不冒烟后才 能放入高温电炉中,且灼烧空坩埚与灼烧样品的条件应尽量一致,以消除系统误差。 2. 把坩埚放入高温炉或从炉中取出时,要在炉口停留片刻,使坩埚预热或冷却。防止因温度剧 变而使坩埚破裂。 3. 灼烧后的坩埚应冷却到 200℃以下再移入干燥器中,否则因热动对流作用,易造成残灰飞散, 且冷却速度慢,冷却后干燥器内形成较大真空,盖子不易打开; 4. 对于含糖分、淀粉、蛋白质较高的样品,为防止其发泡溢出,炭化前可加数滴纯植物油。 5. 新坩埚在使用前须在盐酸溶液(1+4)中煮沸 1~2h,然后用自来水和蒸馏水分别冲洗干净并 烘干。用过的旧坩埚经初步清洗后,可用废盐酸浸泡 20min 左右,再用水冲洗干净。 6. 反复灼烧至恒重是判断灰化是否完全最可靠的方法。因为有些样品即使灰化完全,残留也不 一定是白色或灰白色,例如铁含量高的食品,残灰呈褐色;锰、铜含量高的食品,残灰呈蓝绿色; 而有时即使灰的表面呈白色或灰白色,但内部仍有炭粒存留。 7. 灼烧温度不能超过 600℃,否则会造成钾、钠、氯等易挥发成分的损失。 思考题: 1. 测定食品的灰分的意义何在? 2. 为什么样品在高温灼烧前,要先炭化至无烟? 3. 样品经长时间灼烧后,灰分中仍有炭粒遗留的主要原因是什么?如何处理? 4. 如何判断样品是否灰化完全?

实验四食品中总酸度的测定(滴定法) 一、目的与要求 1.了解食品酸度的测定意义及原理 2.掌握滴定分析法的操作技能和正确判断滴定终点。 3.通过对实验结果的分析、了解影响测定准确性的因素 二、原理 食品中的酒石酸、苹果酸、柠檬酸、草酸、乙酸等其电离常数均大于103,可以用强碱标准溶 液直接滴定,用酚酞作指示剂,当滴定至终点(PH=8.2,溶液呈浅红色,30s不退色)时,根据所 消耗的标准碱溶液浓度和体积,可计算出样品中总酸含最。 三、仪器与试剂 1.仪器: (1)滴定装置: (2)移液管(50mL): (3)分析天平及常用玻璃仪器。 (4)研体 2.试剂 (1)NaOH标准溶液(0.Imol/L): ①配制:称取氢氧化钠(AR)120g于250mL烧杯中,加入蒸馏水100mL,振摇使其溶解, 冷却后置于聚乙烯塑料瓶中,密封,放置数日澄清后,取上清液5.6mL,加新煮沸过并己 冷却的蒸馏水至1000mL,摇匀。 ②标定:精密称取0.6g(准确至0.0001g)在105℃~110℃干燥至恒重的基准邻苯二甲酸氢 钾,加50mL新煮沸过的冷蒸馏水,振摇使其溶解,加二滴酚酞指示剂,用配制的NaOH 标准溶液滴定至溶液呈微红色30s不褪。同时做空白试验。 ③精确浓度计算: m×1000 C=g-y)x204.2 式中:C一标准NaOH溶液的浓度,molL: m—基准邻苯二甲酸氢钾的质量,g: V,一标定时所耗NaOH标准溶液的体积,mL: Vz- -空白试验中所耗NaOH标淮溶液的体积,mL: 2042 -邻苯二甲酸氢钾的摩尔质最,/mol (2)酚酞乙醇溶液(0.2%):称取酚酞0.2g溶解于100mL95%乙醇中。 (3)材料:鲜橙粉
实验四 食品中总酸度的测定(滴定法) 一、目的与要求 1. 了解食品酸度的测定意义及原理。 2. 掌握滴定分析法的操作技能和正确判断滴定终点。 3. 通过对实验结果的分析、了解影响测定准确性的因素。 二、原理 食品中的酒石酸、苹果酸、柠檬酸、草酸、乙酸等其电离常数均大于 10-8,可以用强碱标准溶 液直接滴定,用酚酞作指示剂,当滴定至终点(PH=8.2,溶液呈浅红色,30s 不退色)时,根据所 消耗的标准碱溶液浓度和体积,可计算出样品中总酸含量。 三、仪器与试剂 1. 仪器: (1)滴定装置; (2)移液管(50mL); (3)分析天平及常用玻璃仪器。 (4)研钵。 2. 试剂 (1)NaOH 标准溶液(0.1mol/L): ①配制:称取氢氧化钠(AR)120g 于 250mL 烧杯中,加入蒸馏水 100mL,振摇使其溶解, 冷却后置于聚乙烯塑料瓶中,密封,放置数日澄清后,取上清液 5.6mL,加新煮沸过并已 冷却的蒸馏水至 1000mL,摇匀。 ②标定:精密称取 0.6g(准确至 0.0001g)在 105℃~110℃干燥至恒重的基准邻苯二甲酸氢 钾,加 50mL 新煮沸过的冷蒸馏水,振摇使其溶解,加二滴酚酞指示剂,用配制的 NaOH 标准溶液滴定至溶液呈微红色 30s 不褪。同时做空白试验。 ③精确浓度计算: ( ) 204.2 1000 1 − 2 × × = V V m C 式中:C——标准 NaOH 溶液的浓度,mol/L; m——基准邻苯二甲酸氢钾的质量,g; V1——标定时所耗 NaOH 标准溶液的体积,mL; V2——空白试验中所耗 NaOH 标准溶液的体积,mL; 204.2——邻苯二甲酸氢钾的摩尔质量,g/mol。 (2)酚酞乙醇溶液(0.2%):称取酚酞 0.2g 溶解于 100mL95%乙醇中。 (3) 材料:鲜橙粉
四、测定步骤 1,样品处理 称取5~10g(精确至10mg)鲜橙粉样品,置于研体中,加少量无C0,蒸馏水,研磨成糊状 移入250mL的容量瓶中,用无C02蒸馏水稀释至刻度,充分摇匀,过滤,滤液备用。 2.样品分析 准确吸取上法制备滤液50mL于250mL的推形瓶内,加酚酞指示剂3~4滴,以 0.mol/LNaOH标准溶液至微红色30s不退为止。记录消耗0.Imol/L氢氧化钠标准滴定溶液的毫 升数(V)。 同一被测样品须测定两次 3空白试验 用水代替试液。以下按2操作。记录消耗0.1moL氢氧化钠标准滴定溶液的毫升数(V2)。 五、分析结果表达 1.数据记录表 第一次 第二次第三次 平均值 滴定时取样液体积VmL 滴定样品消耗标准NaOH溶液体积VvmL 空白试验消耗标准NaOH溶液体积/VmL 2.计算公式:总酸以每公斤(或每升)样品中酸的克数表示,按式 x=-V)xKxF ×1000 m 式中 -每公斤(或每升)样品中总酸的克数,gkg(或L): -氢氧化钠标准滴定溶液的浓度,molL: V一滴定试液时消耗氢氧化钠标准滴定溶液的体积,mL: Va- 空白试验时消耗氢氧化钠标准滴定溶液的体积,mL: -样品质量或体积,g(mL) 试液的稀释倍数 -酸的换算系数。各种酸的换算系数分别为:苹果酸,0.067:乙酸,0.060:酒石酸 0.075:柠檬酸,0.064:柠檬酸,0.070(含一分子结晶水):乳酸,0.090:盐酸,0.036: 磷酸,0.033。 大、注意事项 1.食品中的酸式多种有机弱酸的混合物,用强碱滴定测其含量时,滴定突跃不明显,其滴定终 点偏碱,一般在p8.2左右,故可选用酚酞作终点指示剂。 2.对于颜色较深的食品,因它使终点颜色变化不明显,可通过加水稀释,用活性炭脱色等方法
四、测定步骤 1. 样品处理 称取 5~10g(精确至 10mg)鲜橙粉样品,置于研钵中,加少量无 CO2蒸馏水,研磨成糊状, 移入 250 mL 的容量瓶中,用无 CO2 蒸馏水稀释至刻度,充分摇匀,过滤, 滤液备用。 2. 样品分析 准确吸取上法制备滤液 50mL 于 250mL 的锥形瓶内,加酚酞指示剂 3~4 滴,以 0.1mol/LNaOH 标准溶液至微红色 30s 不退为止。记录消耗 0.1mol/L 氢氧化钠标准滴定溶液的毫 升数(V1)。 同一被测样品须测定两次。 3. 空白试验 用水代替试液。以下按 2.操作。记录消耗 0.1mol/L 氢氧化钠标准滴定溶液的毫升数(V2)。 五、分析结果表达 1. 数据记录表 第一次 第二次 第三次 平均值 滴定时取样液体积/V/mL 滴定样品消耗标准 NaOH 溶液体积/ V1/mL 空白试验消耗标准 NaOH 溶液体积/ V2/mL 2. 计算公式:总酸以每公斤(或每升)样品中酸的克数表示,按式 ( ) 1000 1 2 × − × × = m c V V K F X 式中: X——每公斤(或每升)样品中总酸的克数,g/kg(或 g/L); c——氢氧化钠标准滴定溶液的浓度,mol/L; V1——滴定试液时消耗氢氧化钠标准滴定溶液的体积,mL; V2——空白试验时消耗氢氧化钠标准滴定溶液的体积,mL; m——样品质量或体积,g(mL) F——试液的稀释倍数; K——酸的换算系数。各种酸的换算系数分别为:苹果酸,0.067;乙酸,0.060;酒石酸, 0.075;柠檬酸,0.064;柠檬酸,0.070(含一分子结晶水);乳酸,0.090;盐酸,0.036; 磷酸,0.033。 六、注意事项 1.食品中的酸式多种有机弱酸的混合物,用强碱滴定测其含量时,滴定突跃不明显,其滴定终 点偏碱,一般在 pH8.2 左右,故可选用酚酞作终点指示剂。 2.对于颜色较深的食品,因它使终点颜色变化不明显,可通过加水稀释,用活性炭脱色等方法

处理后再滴定。若样液颜色过深或浑浊,则宜用电位滴定法。 3.样品浸渍、稀释用的蒸馏水不能含有C0:,因为C0:溶于水中成为酸性的C0形式,影响滴 终点时酚献颜色变化,对测定有干扰,故在测定之前将其除去,驱除C0,的方法:将蒸馏水煮沸 15min,并迅速冷却备用。必要时须经样液抽真空处理。 4.样品浸渍、稀释之用水量应根据样品中总酸含量米选择,为使误差不超过允许范围,一般要 求滴定时消耗0.1mol/LNa0H溶液不得少于5L,最好在10一15L。 5.计算结果精确到小数点后第二位。如两次测定结果差在允许范围内,则取两测定结果的算述 平均值报告结果。同一样品的两次测定值之差,不得超过两次测定平均值的2% 思考题: 1,标准溶液滴定食品总酸,为什么要用酚酞作指示剂? 对于颜色较深的样品,测定总酸度时终点不易观察,如何处理? 4.食品总酸度测定时,应该注意哪些问题? 实验五食品中粗脂肪含量的测定(索氏抽提法) 一、目的与要求 1、学习索氏抽提法测定脂肪的原理与方法. 2、掌握索氏抽提法基本操作要点及影响因素 二、原理 利用脂肪能溶于有机溶剂的性质,在索氏提取器中将样品用无水乙醚或石油醚等溶剂反复 萃取,提取样品中的脂肪后,蒸去溶剂,所得的物质即为脂肪或称粗脂肪。 三、仪器与试剂 1、仪器 (1)、索氏提取器如图3-3所示 (2)、电热恒温鼓风干燥箱 (3)、干燥器 冷凝 (4)、恒温水浴箱 2、试剂 (1)无水乙醚(不含过氧化物)或石油醚(沸程30-60°C) (2)滤纸筒 四、测定步骤 纸简 1、样品处理 (1)固体样品:准确称取均匀样品2-5g(精确至0.01mg),装入 滤纸筒内。 (2)液体或半固体:准确称取均匀样品5-10g(精确至0.01g), 图33常氏提取
处理后再滴定。若样液颜色过深或浑浊,则宜用电位滴定法。 3.样品浸渍、稀释用的蒸馏水不能含有 CO2 ,因为 CO2溶于水中成为酸性的 H2CO3形式,影响滴 定 终点时酚酞颜色变化,对测定有干扰,故在测定之前将其除去,驱除 CO2的方法:将蒸馏水煮沸 15min,并迅速冷却备用。必要时须经样液抽真空处理。 4.样品浸渍、稀释之用水量应根据样品中总酸含量来选择,为使误差不超过允许范围,一般要 求滴定时消耗 0.1 mol/L NaOH 溶液不得少于 5mL,最好在 10—15 mL。 5.计算结果精确到小数点后第二位。如两次测定结果差在允许范围内,则取两测定结果的算述 平均值报告结果。同一样品的两次测定值之差,不得超过两次测定平均值的 2%。 思考题: 1. 标准溶液滴定食品总酸,为什么要用酚酞作指示剂? 2. 实验结果若以 mol/L 表示食品总酸浓度,应如何计算? 3. 对于颜色较深的样品,测定总酸度时终点不易观察,如何处理? 4. 食品总酸度测定时,应该注意哪些问题? 实验五 食品中粗脂肪含量的测定(索氏抽提法) 一、目的与要求 1、 学习索氏抽提法测定脂肪的原理与方法. 2、 掌握索氏抽提法基本操作要点及影响因素. 二、原理 利用脂肪能溶于有机溶剂的性质,在索氏提取器中将样品用无水乙醚或石油醚等溶剂反复 萃取,提取样品中的脂肪后,蒸去溶剂,所得的物质即为脂肪或称粗脂肪。 三、仪器与试剂 1、 仪器 (1)、索氏提取器 如图 3-3 所示 (2)、电热恒温鼓风干燥箱 (3)、干燥器 (4)、恒温水浴箱 2、试剂 (1)无水乙醚(不含过氧化物)或石油醚(沸程 30-60°C) (2)滤纸筒 四、测定步骤 1、样品处理 (1) 固体样品: 准确称取均匀样品 2-5g(精确至 0.01mg),装入 滤纸筒内。 (2) 液体或半固体: 准确称取均匀样品 5-10g(精确至 0.01mg)