
实验五 pH法测定醋酸的电离 平衡衡常数 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 实验五 pH法测定醋酸的电离 平衡常数

实验目的 1.学习了解pH法测电离平衡常数的原理与方法。 2.学会pH计的使用方法及注意事项。 3.加强有效数字概念在数据处理上的正确运用,学 会实验误差原因分析。 4.训练实验报告表格化处理方法。 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 一、实验目的 1.学习了解pH法测电离平衡常数的原理与方法。 2.学会pH计的使用方法及注意事项。 3.加强有效数字概念在数据处理上的正确运用,学 会实验误差原因分析。 4.训练实验报告表格化处理方法

实验原理 pH法测定电离平衡常数的实验原理。 乙酸的电离平衡式 HAc台Ht+ACc 平衡浓度 Co-x 乙酸的电离平衡常数K:卫 因而只需测出溶液的H值即可求出乙酸的电离平衡常 数,但要强调此表达式是在忽略了水的电离平衡条件下得 到的,因而测定时乙酸溶液的浓度不能太稀。 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 二、实验原理 pH法测定电离平衡常数的实验原理。 乙酸的电离平衡式 HAc H+ + Ac- 平衡浓度 c0 - x x x 乙酸的电离平衡常数 因而只需测出溶液的pH值即可求出乙酸的电离平衡常 数,但要强调此表达式是在忽略了水的电离平衡条件下得 到的,因而测定时乙酸溶液的浓度不能太稀

在一定温度下利用酸度计测定乙酸溶液的pH值,而 溶液的pH值与乙酸溶液中H+浓度之间存在如下关系: pH=lgH]或H]=10pH 因此,若已知乙酸溶液的初始浓度C,并且利用酸 度计测定了乙酸溶液的H值,通过计算可以求出电离平 衡常数K值。 星 北京化工大学化学实验教学示范中
北京化工大学化学实验教学示范中心 在一定温度下利用酸度计测定乙酸溶液的pH值,而 溶液的pH值与乙酸溶液中H+浓度之间存在如下关系: pH=-lg[H+ ] 或 [H+ ]=10-pH 因此,若已知乙酸溶液的初始浓度C0,并且利用酸 度计测定了乙酸溶液的pH值,通过计算可以求出电离平 衡常数Ki值

三、操作要点 1.酸度计的准备 (1)打开酸度计的开关; (2)选择钮置于pH; (3)温度钮置于溶液温度; (4)用去离子水润洗复合电极,并用滤纸擦干,将其插入 pH=6.9的标准缓冲溶液,将斜率调至最大,用调节定位 旋钮使显示pH=6.9,然后再一次润洗复合电极并用滤纸 擦干,插入pH=4.0的标准缓冲溶液,调节斜率旋钮使显 示pH=4.0,重复上述操作,直至显示值与标准缓冲溶液 的H一致为止,此时酸度计校正好了。 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 三、操作要点 1.酸度计的准备 (1) 打开酸度计的开关; (2) 选择钮置于pH; (3) 温度钮置于溶液温度; (4) 用去离子水润洗复合电极,并用滤纸擦干,将其插入 pH=6.9的标准缓冲溶液,将斜率调至最大,用调节定位 旋钮使显示pH=6.9,然后再一次润洗复合电极并用滤纸 擦干,插入pH=4.0的标准缓冲溶液,调节斜率旋钮使显 示pH=4.0,重复上述操作,直至显示值与标准缓冲溶液 的pH一致为止,此时酸度计校正好了
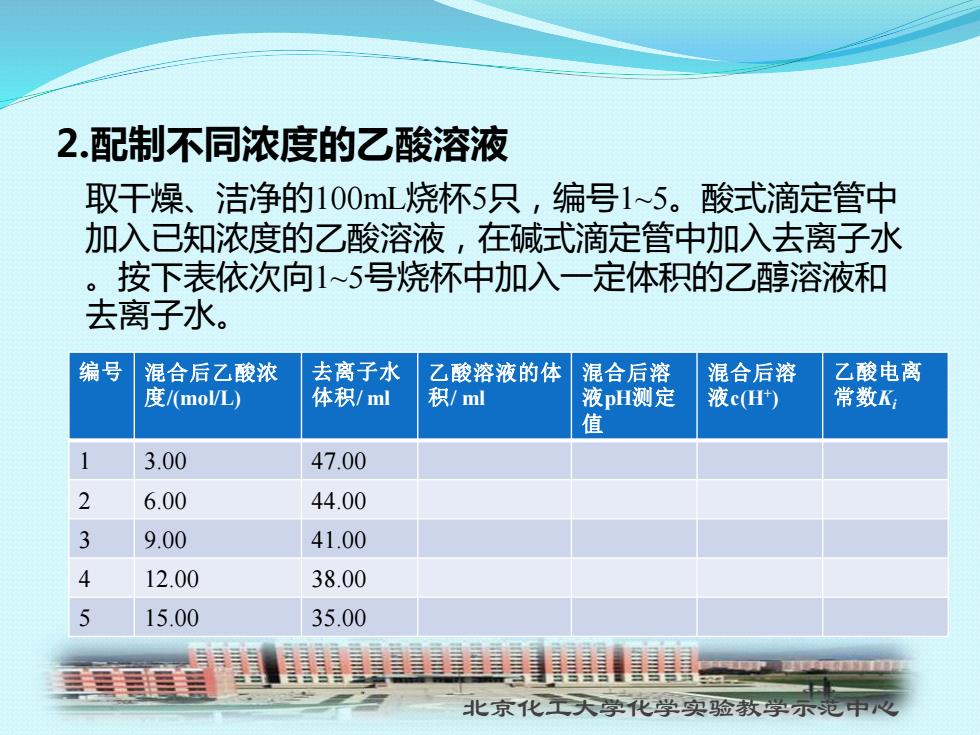
2配制不同浓度的乙酸溶液 取干燥、洁净的100mL烧杯5只,编号1~5。酸式滴定管中 加入已知浓度的乙酸溶液,在碱式滴定管中加入去离子水 。按下表依次向1~5号烧杯中加入一定体积的乙醇溶液和 去离子水。 编号 混合后乙酸浓 去离子水 乙酸溶液的体 混合后溶 混合后溶 乙酸电离 度/(moL) 体积/ml 积/ml 液pH测定 液cH 常数K 值 3.00 47.00 2 6.00 44.00 3 9.00 41.00 4 12.00 38.00 5 15.00 35.00 三三三 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 2.配制不同浓度的乙酸溶液 取干燥、洁净的100mL烧杯5只,编号1~5。酸式滴定管中 加入已知浓度的乙酸溶液,在碱式滴定管中加入去离子水 。按下表依次向1~5号烧杯中加入一定体积的乙醇溶液和 去离子水。 编号 混合后乙酸浓 度/(mol/L) 去离子水 体积/ ml 乙酸溶液的体 积/ ml 混合后溶 液pH测定 值 混合后溶 液c(H+ ) 乙酸电离 常数Ki 1 3.00 47.00 2 6.00 44.00 3 9.00 41.00 4 12.00 38.00 5 15.00 35.00

3.测定所配乙酸溶液的pH值 利用酸度计依次测定所配乙酸溶液的H值,并记录 在上表中。分别计算出1~5号溶液的电离平衡常数K,,取 平均值即为乙酸溶液的电离平衡常数。 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 3.测定所配乙酸溶液的pH值 利用酸度计依次测定所配乙酸溶液的pH值,并记录 在上表中。分别计算出1~5号溶液的电离平衡常数Ki,取 平均值即为乙酸溶液的电离平衡常数

四、思考题 1.测定乙酸电离常数的依据是什么?当乙酸浓度很稀时, 能用此法吗? 2.本实验是用酸度计测定溶液中H+的浓度的,能否利用酸 碱滴定法来测定溶液中的H+浓度? 3.按照此测定弱酸电离常数的方法,能否设计一个实验方 案来测定弱碱? 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 四、思考题 1. 测定乙酸电离常数的依据是什么?当乙酸浓度很稀时, 能用此法吗? 2. 本实验是用酸度计测定溶液中H+的浓度的,能否利用酸 碱滴定法来测定溶液中的H+浓度? 3. 按照此测定弱酸电离常数的方法,能否设计一个实验方 案来测定弱碱?