
实验十一 混合离子的分离 与定性分析 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 实验十一 混合离子的分离 与定性分析

一、实验目的 1.熟悉有关离子及其化合物的性质。 2.了解混合离子分离与检出的方法和操作。 3.分离与检出混合离子溶液中Ba2+、Fe3+、Co2+、Ni2+、 Cr3+、A3+、Zn2+等7种离子。 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 一、实验目的 1.熟悉有关离子及其化合物的性质。 2.了解混合离子分离与检出的方法和操作。 3.分离与检出混合离子溶液中Ba2+ 、Fe3+ 、Co2+ 、Ni2+ 、 Cr3+ 、Al3+ 、Zn2+等7种离子

实验原理 1.离子鉴定(检出)就是确定某种元素或离子是否存在,其 原则为 (1)大多是在水溶液中进行的反应; (2)选择变化迅速而明显的反应。如颜色的改变,沉淀的 生成与溶解气体的产生等 例如: Ba2+:Ba2++SO42-=BaSO4V(灵敏性) NH4++OH→NH↑+HO(选择性) Co2++4SCN→[Co(NCS)4]2(特效反应) 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 二、实验原理 1. 离子鉴定(检出)就是确定某种元素或离子是否存在,其 原则为 (1)大多是在水溶液中进行的反应; (2)选择变化迅速而明显的反应。如颜色的改变,沉淀的 生成与溶解,气体的产生等. 例如: Ba2+:Ba2+ + SO4 2- = BaSO4 (灵敏性) NH4+ + OH-→NH3↑+ H2O (选择性) Co2+ + 4 SCN-→[Co(NCS)4 ] 2- (特效反应)

2.混合离子分离常用的方法是沉淀分离法 此方法主要是根据溶度积规则,利用沉淀反应,达到 分离目的。 3.分离与检出反应,只有在一定条件下才能进 行,条件主要指:(1)溶液酸度 (2)反应物的浓度 (3)反应湿度 (4)促成或妨碍此反应的物质的存在等 北京化工大学化学实验教学示范中
北京化工大学化学实验教学示范中心 2. 混合离子分离常用的方法是沉淀分离法 此方法主要是根据溶度积规则,利用沉淀反应,达到 分离目的。 3. 分离与检出反应,只有在一定条件下才能进 行, 条件主要指:(1)溶液酸度 (2)反应物的浓度 (3)反应湿度 (4)促成或妨碍此反应的物质的存在等
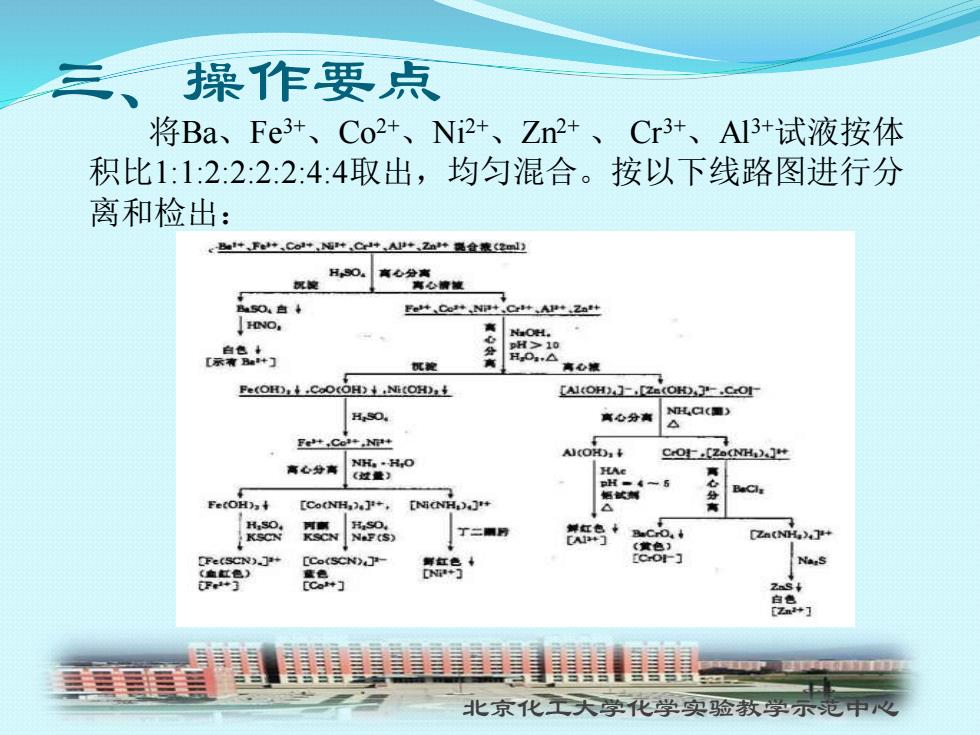
三、操作要点 将Ba、Fe3+、Co2+、Ni2+、Zn2+、Cr3+、A13+试液按体 积比1:1:2:2:2:2:4:4取出,均匀混合。按以下线路图进行分 离和检出: +F+.Co++,C++2a鼻金流2l山 H,S0. 商心分离 海心被被 Fe+,Cot+,NP+,Cr+,AP+.2at+ HNO, 白色 示有B+门 C旋 分寓 高心被 [AI(OH)]-.[Ze H,SO. 离心分离 C9C■3 FetCol+,NP+ .[z NH. 商心分高 NH..HiO (过量) 畅试解们 [Co(NH+.[NiCH CZA(NH) CCe(SCN) 红号 三三 比京 学实验教学示范中
北京化工大学化学实验教学示范中心 三、操作要点 将Ba、Fe3+ 、Co2+ 、Ni2+ 、Zn2+ 、 Cr3+ 、Al3+试液按体 积比1:1:2:2:2:2:4:4取出,均匀混合。按以下线路图进行分 离和检出:

四、思考题 1.在分离Fe3+、Co2+、Ni2+、Cr3+、A3+、Zn2+时,为什么 要加入过量的碱?此时加入HO,的目的是什么?反应 完全后,过量的HO2为什么要加热分解掉? 2.检出Co2+时,加入NaF的目的是什么? 3.通过计算说明反应[ZnNH3)4]2++S2一ZnS↓+4NH3能 够向右进行。 4.通过计算说明反应[Fe(NCS)n]3-n+6F台[FeF63-+ nSCN向右进行的程度如何? 北京化工大学化学实验教学示范中
北京化工大学化学实验教学示范中心 四、思考题 1.在分离Fe3+ 、Co2+ 、Ni2+ 、Cr3+ 、Al3+ 、Zn2+时,为什么 要加入过量的碱?此时加入H2O2的目的是什么?反应 完全后,过量的H2O2为什么要加热分解掉? 2.检出Co2+时,加入NaF的目的是什么? 3.通过计算说明反应[Zn(NH3 )4 ] 2+ + S2- ZnS + 4NH3能 够向右进行。 4.通过计算说明反应[Fe(NCS)n ] 3-n + 6F- [FeF6 ] 3- + nSCN-向右进行的程度如何?