
乙酸乙酯的制备 (实验前讲解课) 主讲教师 于景华副教授 北京化工大学化学实验教学示范中心
主讲教师 于景华 副教授 北京化工大学化学实验教学示范中心 (实验前讲解课) 乙酸乙酯的制备

实验目的 北条化立大学 化学实验教学中心 北京化工大学 化学实验教学中心 ·学习羧酸与醇制备酯的反应原理和方法 ·掌握酯化反应连续制备酯的操作方法 ●了解控制反应条件对合成反应的影响
实验目的 学习羧酸与醇制备酯的反应原理和方法 掌握酯化反应连续制备酯的操作方法 了解控制反应条件对合成反应的影响 北京化工大学 化学实验教学中心 北京化工大学 化学实验教学中心
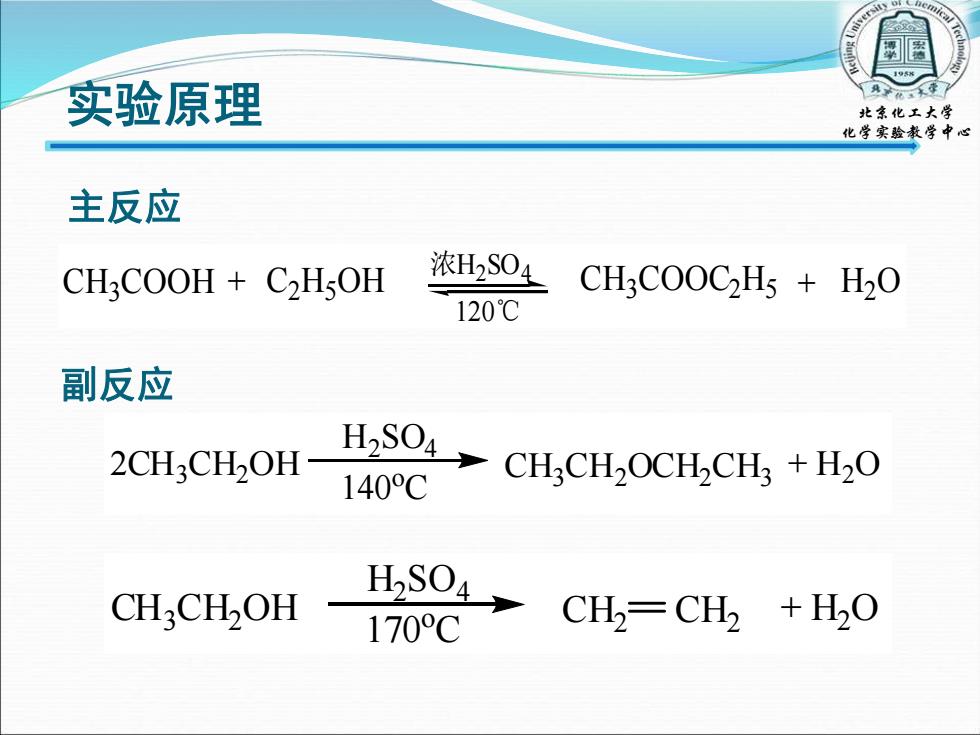
实验原理 北章化工大学 化学实验教学中心 主反应 CH3COOH C2H5OH 浓H2S04 CHCOOCH5 H2O 120℃ 副反应 2CH:CH2OH H2S04 140C CHCH2OCH CH:+H2O CHCH2OH 170C CH2-CH2 +H2O
实验原理 主反应 C H3C O O H + C 2 H5O H 浓 H 2 S O 4 120℃ C H3C O O C2 H5 + H 2 O 副反应2CH3CH2OH 140oC CH3CH2OCH2CH3 + H2O H2SO4 CH3CH2OH 170oC + H2O H2SO4 CH2 CH2 北京化工大学 化学实验教学中心
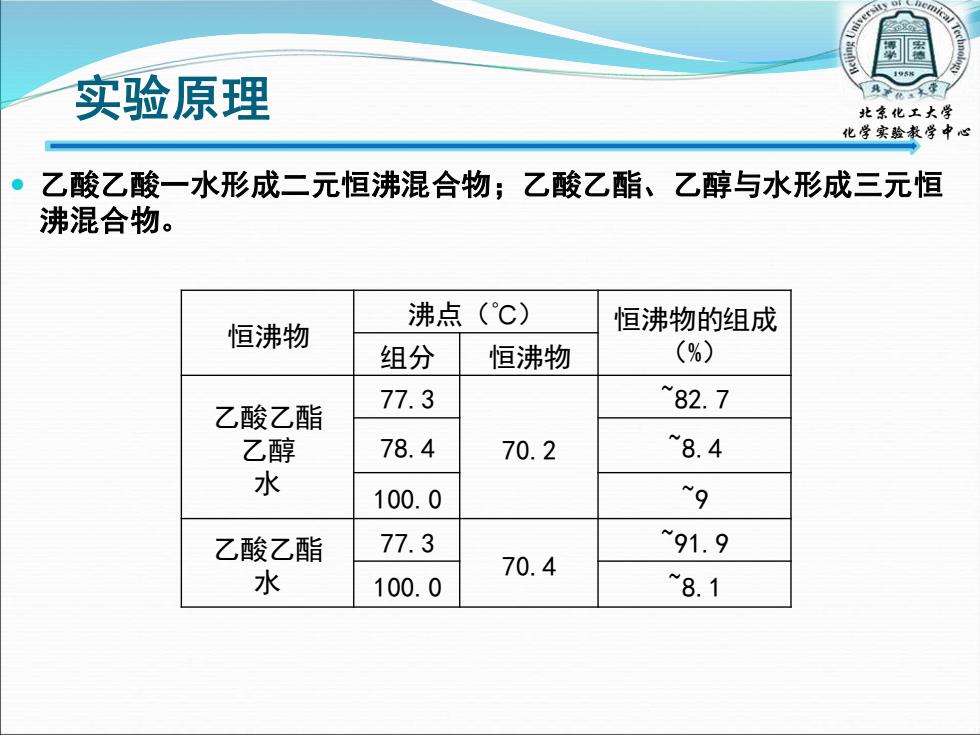
实验原理 北条化立大学 化学实验教学中心 乙酸乙酸一水形成二元恒沸混合物;乙酸乙酯、乙醇与水形成三元恒 沸混合物。 沸点(℃) 恒沸物 恒沸物的组成 组分 恒沸物 (%) 77.3 82.7 乙酸乙酯 乙醇 78.4 70.2 8.4 水 100.0 9 乙酸乙酯 77.3 91.9 水 70.4 100.0 8.1
实验原理 乙酸乙酸一水形成二元恒沸混合物;乙酸乙酯、乙醇与水形成三元恒 沸混合物。 恒沸物 沸点(℃) 恒沸物的组成 组分 恒沸物 (%) 乙酸乙酯 乙醇 水 77.3 70.2 ~82.7 78.4 ~8.4 100.0 ~9 乙酸乙酯 水 77.3 70.4 ~91.9 100.0 ~8.1 北京化工大学 化学实验教学中心

实验原理 北章化工大学 化学实验教学中心 ·由于酯化反应是可逆反应,为提高酯的产率,采用 增加醇的用量及不断将产物酯和水蒸出的措施。 ●反应中,用浓硫酸做催化剂。 ·反应温度过高,会促使副反应发生,生成乙醚、烯 等
由于酯化反应是可逆反应,为提高酯的产率,采用 增加醇的用量及不断将产物酯和水蒸出的措施。 反应中,用浓硫酸做催化剂。 反应温度过高,会促使副反应发生,生成乙醚、烯 等。 实验原理 北京化工大学 化学实验教学中心

实验原理 北条化立大学 化学实验教学中心 根据反应原理选择仪器 ●△→电加热套 ●控温(120℃)温度计150℃ ·产物蒸出一75℃弯管,冷凝、接收装置 ·连续生产+滴加装置(滴液漏斗) ●三口瓶
实验原理 根据反应原理选择仪器 Δ 电加热套 控温(120℃) 温度计150℃ 产物蒸出 75℃弯管,冷凝、接收装置 连续生产 滴加装置(滴液漏斗) 三口瓶 北京化工大学 化学实验教学中心

19 反应装置 北章化工大学 化学实验教学中心 干燥的仪器 干燥的仪器 精制 制备
反应装置 干燥的仪器 制备 精制 干燥的仪器 北京化工大学 化学实验教学中心

操作步骤 北条化立大学 化学实验教学中心 乙醇 3ml 浓H2S04 3ml 、干燥的仪器 沸石 2粒 干燥精制仪器 三口瓶 不漏气 滴加 馏出液 搭装置 水银戏在液面下、 分液 距瓶底0.5-1cm 公, 升至110C 混合液 10min加饱和Na2C03 留上层 滴加与蒸出速度大致相等 至无C02放出 乙醇 20ml 约90min (120℃~125℃) 冰乙酸 14.3ml 滴液漏斗 PH试纸 加等体积 加等体积 加干燥剂 饱和CaCl2 滤出干燥剂 精制 酯层为中性 饱和NaCI K2C03 普通蒸馏 如酸性至中性止 分液留上层 分液留上层 至澄清透明, 于干燥锥形瓶中 静置 7480°C 馏分
操作步骤 乙醇 3ml 浓 H2SO4 3ml 沸石 2粒 搭装置 三口瓶 乙醇 20ml 冰乙酸 14.3ml 滴液漏斗 水银球在液面下、 距瓶底0.5~1cm 不漏气 ,升至110°C 滴加 混合液 滴加与蒸出速度大致相等 约90min 10min 加饱和Na2CO3 馏出液 至无CO2放出 分液 留上层 (120℃ ~125℃) 干燥的仪 干燥的仪器 干燥精制仪器 酯层为中性 如酸性至中性止 加等体积 饱和CaCl2 分液留上层 分液留上层 于干燥锥形瓶中 加干燥剂 K2CO3 至澄清透明, 静置 精制 普通蒸馏 74~80°C 馏 分 加等体积 饱和NaCl PH试纸 滤出干燥剂 北京化工大学 化学实验教学中心

操作重点及注意事项 北亲化工大学 化学实验教学中心 ·温度不宜过高,120至125℃,否则会增加副产物乙醚的含量。 ·滴加速度太快会使醋酸和乙醇来不及作用而被蒸出。 ·碳酸钠必须洗去,否则下一步用饱和氯化钙洗去醇时,会产生 絮状的碳酸钙沉淀,造成分离的困难。 ·为减少酯在水中的溶解度(每17份水溶解1份乙酸乙酯), 故这里用饱和食盐水洗涤。 ·饱和氯化钙溶液可洗去未参加反应而蒸出的乙醇。乙醇须洗净, 否则它能与乙酸乙酯、水等形成共沸物,前馏分增多,降低产 率
操作重点及注意事项 温度不宜过高, 120至125℃,否则会增加副产物乙醚的含量。 滴加速度太快会使醋酸和乙醇来不及作用而被蒸出。 碳酸钠必须洗去,否则下一步用饱和氯化钙洗去醇时,会产生 絮状的碳酸钙沉淀,造成分离的困难。 为减少酯在水中的溶解度(每 17 份水溶解 1 份乙酸乙酯), 故这里用饱和食盐水洗涤。 饱和氯化钙溶液可洗去未参加反应而蒸出的乙醇。乙醇须洗净, 否则它能与乙酸乙酯、水等形成共沸物,前馏分增多,降低产 率。 北京化工大学 化学实验教学中心

思考题 北亲化工大学 化学实验教学中心 ·在本实验中硫酸起什么作用? ·为什么要用过量的乙醇? ·蒸出的粗乙酸乙酯中主要有哪些杂质? ·能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸 馏液? ·用饱和氯化钙溶液洗涤,能除去什么?为什么要用饱 和食盐水洗涤?是否可用水代替?
思考题 在本实验中硫酸起什么作用? 为什么要用过量的乙醇 ? 蒸出的粗乙酸乙酯中主要有哪些杂质? 能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸 馏液? 用饱和氯化钙溶液洗涤,能除去什么?为什么要用饱 和食盐水洗涤?是否可用水代替? 北京化工大学 化学实验教学中心