
实验三硫酸亚铁缺的制备及 Fe3+含量测定 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 实验三 硫酸亚铁铵的制备及 Fe3+含量测定

实验目的 1.掌握制备复盐硫酸亚铁铵的原理和方法。 2.参考基本操作的相关内容,巩固无机制备的操作技 术,如称量、水浴加热、蒸发结晶、减压过滤等。 3.学会目视比色法测定F(II)含量分析方法、掌握移液 管、比色管的使用。 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 一、实验目的 1. 掌握制备复盐硫酸亚铁铵的原理和方法。 2. 参考基本操作的相关内容,巩固无机制备的操作技 术,如称量、水浴加热、蒸发结晶、减压过滤等。 3. 学会目视比色法测定Fe(III)含量分析方法、掌握移液 管、比色管的使用

实验原理 1.硫酸亚铁铵的制备 硫酸亚铁铵俗称摩尔盐,为浅绿色单斜晶体,其溶 解较小,易从浓的FSO,和NH4)2SO4混合液中结晶析出 。本实验的制备原理如下: Fe+HSO4=FeS04+H2↑ (NHA)2SO+6H2O+FeSO=(NHA)2SOFeSO6H2O 北京 化学实验教学示范中心
北京化工大学化学实验教学示范中心 二、实验原理 1.硫酸亚铁铵的制备 硫酸亚铁铵俗称摩尔盐,为浅绿色单斜晶体,其溶 解较小,易从浓的FeSO4和(NH4 )2SO4混合液中结晶析出 。本实验的制备原理如下: Fe + H2SO4=FeSO4 + H2↑ (NH4 )2SO4 + 6H2O + FeSO4= (NH4 )2SO4·FeSO4·6H2O

2.目视比色法测定Fe3+的含量 硫酸亚铁铵中F3+的含量多少,是影响其质量的重要 指标之一。本实验测定产品中的F3+含量,是应用其与 KSCN作用生成血红色的配合物: Fe3++nSCN-=Fe(SCN)3-n F3+愈多,血红色愈深。故可以根据其血红色的深浅,确 定比较Fe3+的相对多少。即将样品溶液与标准Fe3+系列溶液 作对比,以确定产品级别。 北京化工大学化学实验教学示范中
北京化工大学化学实验教学示范中心 2.目视比色法测定Fe3+的含量 硫酸亚铁铵中Fe3+的含量多少,是影响其质量的重要 指标之一。本实验测定产品中的Fe3+含量,是应用其与 KSCN作用生成血红色的配合物: Fe3++nSCN- = Fe(SCN)n 3-n Fe3+愈多,血红色愈深。故可以根据其血红色的深浅,确 定比较Fe3+的相对多少。即将样品溶液与标准Fe3+系列溶液 作对比,以确定产品级别
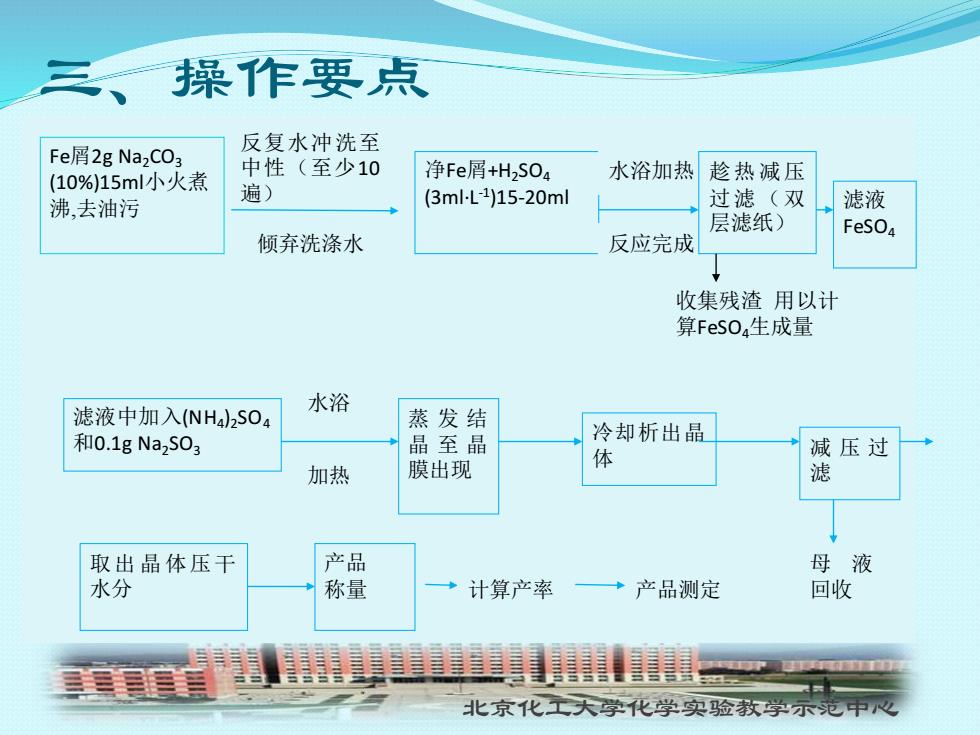
三、一操作要点 反复水冲洗至 Fe屑2gNa2C03 (10%)15ml小火煮 中性(至少10 净Fe屑+H2S0a 水浴加热 趁热减压 遍) 沸,去油污 (3mlL-1)15-20ml 过滤(双 滤液 层滤纸) FeSO4 倾弃洗涤水 反应完成 收集残渣用以计 算FeS0,生成量 滤液中加入(NH4)2SO4 水浴 蒸发结 和0.1gNa2S03 晶至晶 冷却析出晶 体 减压过 加热 膜出现 滤 取出晶体压干 产品 母液 水分 称量 计算产率 →产品测定 回收 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 三、操作要点 Fe屑2g Na2CO3 (10%)15ml小火煮 沸,去油污 反复水冲洗至 中性(至少10 遍) 倾弃洗涤水 净Fe屑+H2SO4 (3ml·L-1 )15-20ml 水浴加热 反应完成 趁热 减压 过滤 (双 层滤纸) 滤液 FeSO4 收集残渣 用以计 算FeSO4生成量 滤液中加入(NH4 )2SO4 和0.1g Na2SO3 水浴 加热 产品 称量 冷却析出晶 体 蒸 发 结 晶 至 晶 膜出现 减 压 过 滤 母 液 回收 取出 晶 体压干 水分 计算产率 产品测定

四、思考题 1.本实验在制备FSO4的过程中为什么强调溶液必须保证 强酸性? 2.在产品检验时,配制溶液为什么要用不含氧的去离子 水?除氧方法是怎样的? 3.在计算硫酸亚铁和硫酸亚铁铵的理论产量时,各以什么 物质用量为标准?为什么? 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 四、思考题 1. 本实验在制备FeSO4的过程中为什么强调溶液必须保证 强酸性? 2 . 在产品检验时,配制溶液为什么要用不含氧的去离子 水?除氧方法是怎样的? 3. 在计算硫酸亚铁和硫酸亚铁铵的理论产量时,各以什么 物质用量为标准?为什么?