
实验八配位化合物的 形成和性质实验 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 实验八 配位化合物的 形成和性质实验

实验目的 1.了解不同类型配离子的形式和形成过程的特征,认识简 单离子与配离子的区别; 2.理解配离子稳定常数和不稳定常数的意义,理解配离子 离解平衡与酸碱平衡、沉淀-溶解平衡、氧化-还原平衡 之间的关系: 3.初步了解螯合物的形成和特性,应用螯合物鉴定几种离 子的方法: 4.初步了解配合物的异构现象,拓宽知识领域。 北京 学化学实验教学示范中心
北京化工大学化学实验教学示范中心 一、实验目的 1. 了解不同类型配离子的形式和形成过程的特征,认识简 单离子与配离子的区别; 2. 理解配离子稳定常数和不稳定常数的意义,理解配离子 离解平衡与酸-碱平衡、沉淀-溶解平衡、氧化-还原平衡 之间的关系; 3. 初步了解螯合物的形成和特性,应用螯合物鉴定几种离 子的方法; 4. 初步了解配合物的异构现象,拓宽知识领域

实验原理 1.配合物的形成 由一个简单的正离子作为形成体与几个中性分子或 它种负离子作为配位体形成的复杂离子,叫做配离子。带 正电荷的配离子叫正配离子,带负电荷的配离子叫负配离 子,含配离子的化合物就是配合物。 2.配离子的解离平衡及其移动 例如:[CuNH3)4]2+→Cu2++4NH3 3.螯合物的形成 螯合物是具有中心离子与多齿配体形成的环状结构的配 合物。 北京化工大学化学实验教学示范中
北京化工大学化学实验教学示范中心 二、实验原理 1.配合物的形成 由一个简单的正离子作为形成体与几个中性分子或 它种负离子作为配位体形成的复杂离子,叫做配离子。带 正电荷的配离子叫正配离子,带负电荷的配离子叫负配离 子,含配离子的化合物就是配合物。 2.配离子的解离平衡及其移动 例如:[Cu(NH3 )4 ] 2+ →Cu2+ + 4NH3 3.螯合物的形成 螯合物是具有中心离子与多齿配体形成的环状结构的配 合物
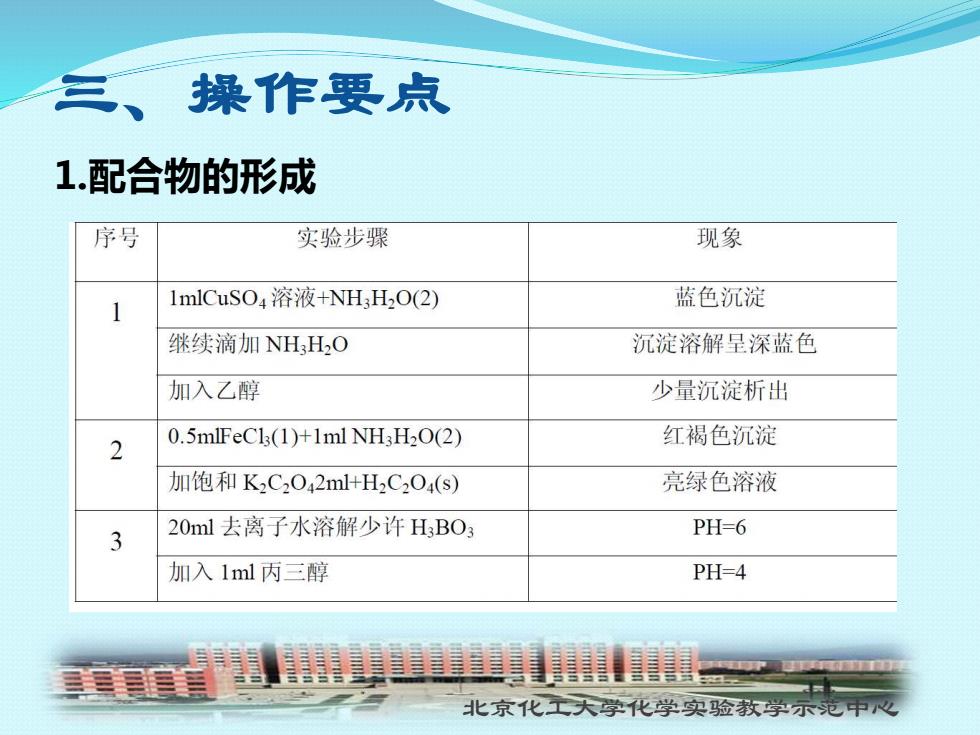
三、操作要点 1.配合物的形成 序号 实验步骤 现象 1 mlCuSO4溶液+NH,H2O(2) 蓝色沉淀 继续滴加NH3H2O 沉淀溶解呈深蓝色 加入乙醇 少量沉淀析出 2 0.5mlFeCl3(1)+1ml NH3H2O(2) 红褐色沉淀 加饱和K2C2042ml+H2C,O4(s) 亮绿色溶液 3 20ml去离子水溶解少许HBO3 PH-6 加入1ml丙三醇 PH=4 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 三、操作要点 1.配合物的形成
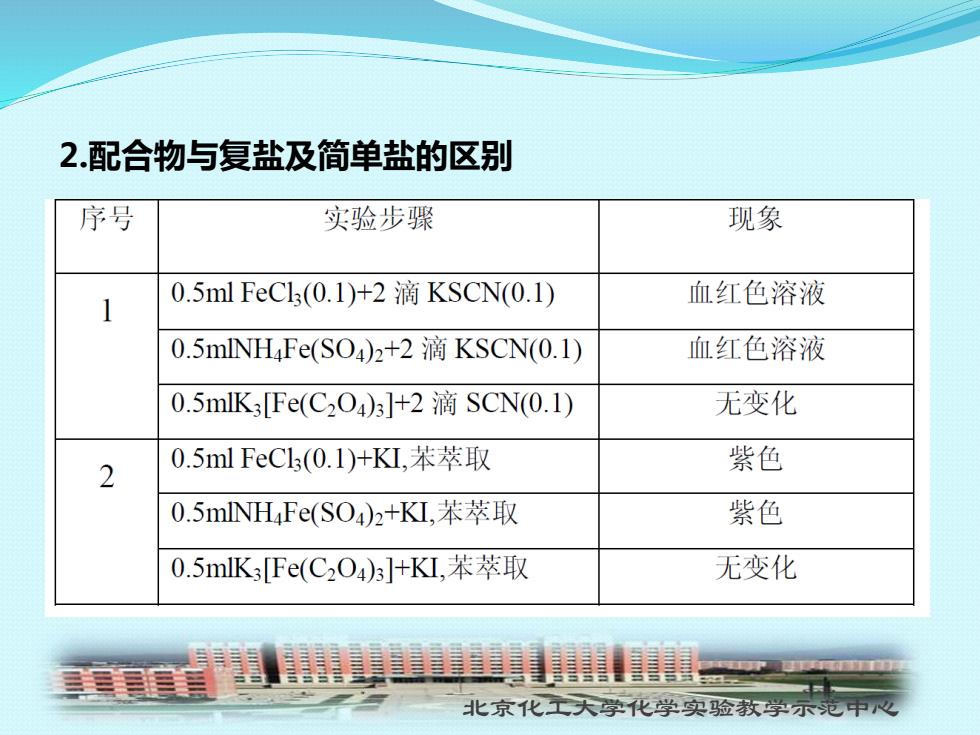
2配合物与复盐及简单盐的区别 序号 实验步骤 现象 1 0.5 ml FeC1(0.1)+2滴KSCN(0.1) 血红色溶液 0.5mlNHFe(SO)2+2 KSCN(0.1) 血红色溶液 0.5mlK3[Fe(C2O)3]+2 SCN(0.1) 无变化 0.5 ml FeCl3(0.1)+KL,苯萃取 2 紫色 0.5 mlNHFe(SO4)2+KL,苯萃取 紫色 0.5mlK3[Fe(C2O4)3]+KI,苯萃取 无变化 北京化工天学化学实验教学示范中心
北京化工大学化学实验教学示范中心 2.配合物与复盐及简单盐的区别
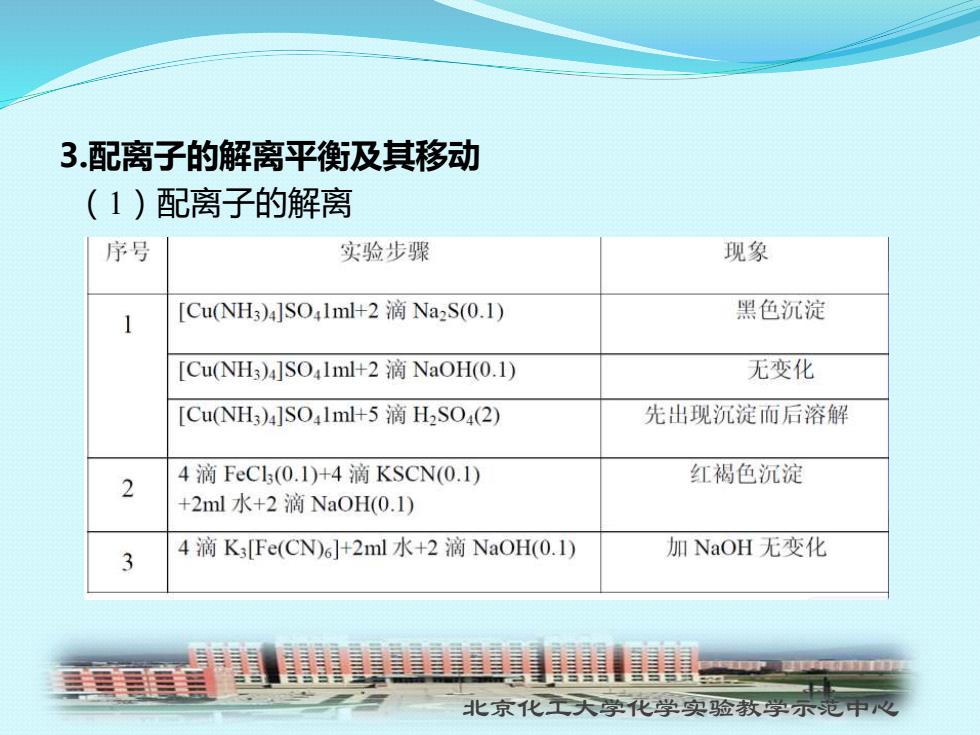
3.配离子的解离平衡及其移动 (1)配离子的解离 序号 实验步骤 现象 [Cu(NH3)4]SO,1ml+2 Na2S(0.1) 黑色沉淀 [Cu(NH3)4]SO1ml+2 NaOH(0.1) 无变化 [Cu(NH3)4]SO41ml+5 H2SO4(2) 先出现沉淀而后溶解 4滴FeCl(0.1)+4滴KSCN(0.1) 2 红褐色沉淀 +2ml水+2滴NaOH(0.1) 4滴K3Fe(CN)6]+2ml水+2滴NaOH(0.1) 加NaOH无变化 3 三美岛 北京化工天学化学实验教学示范中心
北京化工大学化学实验教学示范中心 3.配离子的解离平衡及其移动 (1)配离子的解离
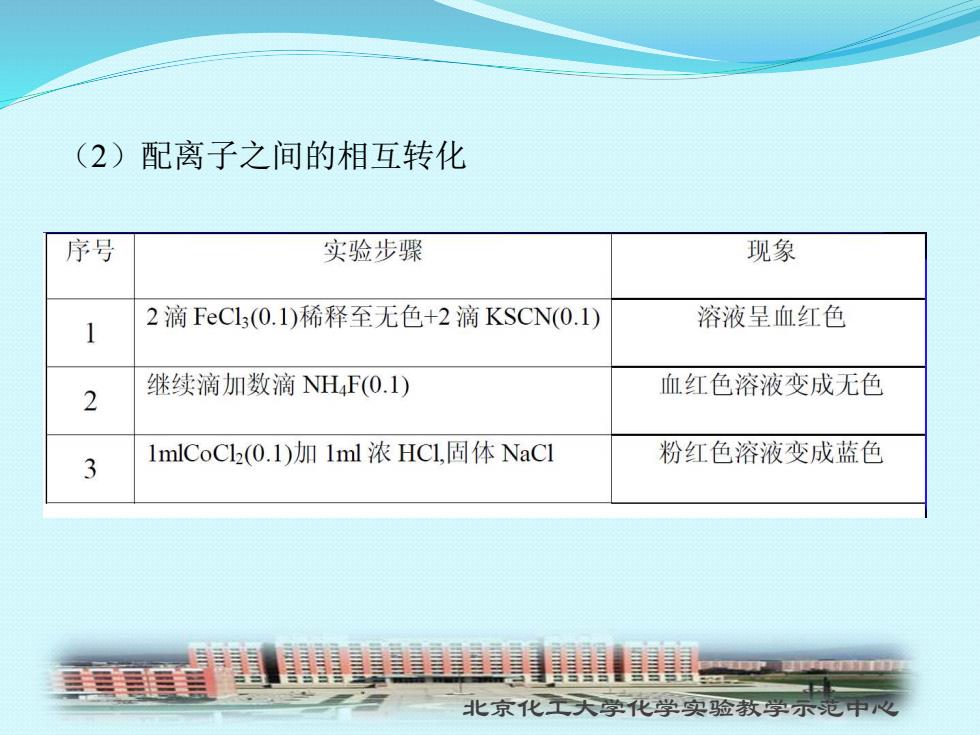
(2)配离子之间的相互转化 序号 实验步骤 现象 2滴FeCl3(0.1)稀释至无色+2滴KSCN(0.1I) 溶液呈血红色 继续滴加数滴NH(O.1) 2 血红色溶液变成无色 1mlCoC2(0.1)加1ml浓HCL,固体NaC1 粉红色溶液变成蓝色 3 北京化工天学化学实验教学示范中心
北京化工大学化学实验教学示范中心 (2)配离子之间的相互转化

(3)配合平衡和氧化-还原反应之间的关系 序号 实验步骤 现象 数滴FeCl(0.1)+数滴KI(0.1)+5滴苯 苯层呈紫色 2 数滴FeCls(0.1)+NHF(s)十数滴KI(0.1)十5滴苯 苯层无色 3 5滴CoC(0.I)+10滴EDTA+5滴K[Fe(CN)6] 溶液由红色变为紫罗 兰色 目美目自目印 北京化工大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 (3)配合平衡和氧化-还原反应之间的关系
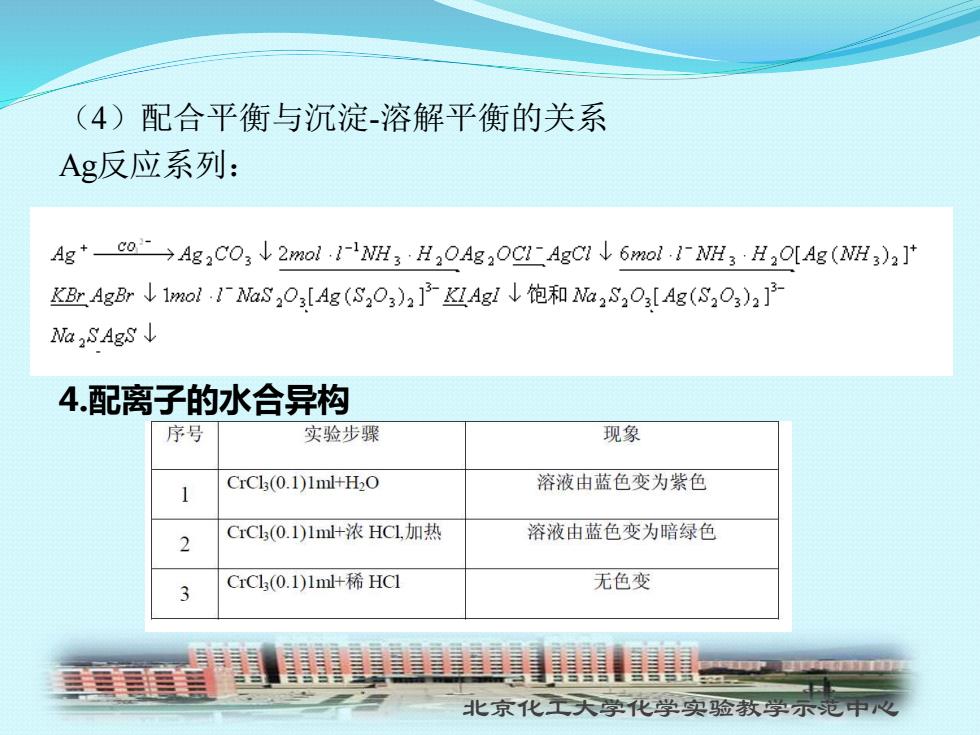
(4)配合平衡与沉淀-溶解平衡的关系 Ag反应系列: Ag+co→Ag2C03↓2mol·12WH3H20Ag20C1AgC2↓6mo1.12MH3H2O[Ag(WH,)2] KAg↓1mol.1aS,0:[Ag(S,O)2]Ag1↓饱和M2S203[Ag(S2O3)2]F 1Wa2SAgS↓ 4.配离子的水合异构 序号 实验步骤 现象 1 CrCls(0.1)1ml+H2O 溶液由蓝色变为紫色 2 CrCl(0.1)1ml+浓HCL,加热 溶液由蓝色变为暗绿色 CrCl(0.1)1m+稀HCl 无色变 北京化工大学化学实验教学示范中
北京化工大学化学实验教学示范中心 (4)配合平衡与沉淀-溶解平衡的关系 Ag反应系列: 4.配离子的水合异构

5.螯合物的形成和N2+、Mg2+的鉴定 序号 实验步骤 现象 颜色由绿色变为鲜红色 1 2滴NiS04(0.1)+2滴HH2O(2)+ 1滴丁二肟(1%) 5滴Mgs04(0.1)+1mlPH=10缓 颜色由酒红变为蓝色 2 冲溶液+3滴铬黑T+EDTA 北京化大学化学实验教学示范中心
北京化工大学化学实验教学示范中心 5.螯合物的形成和Ni2+ 、Mg2+的鉴定