
5.3理想气体压强和温度公式 5.3理想气体压强和温度公式 一理想气体的微观模型 (1)忽略分子体积。 (②)分子运动服从牛顿运动定律。 (3)除碰撞外,没有相互作用。 分子统计假设 1)速度各不相同,由于碰撞而变化。 2)平衡态时,数密度分布均匀。 3)平衡态时,速度沿各方向分布均匀。 前页后页目录 1
前页 后页 目录 1 5.3 理想气体压强和温度公式 一. 理想气体的微观模型 (1) 忽略分子体积。 (2) 分子运动服从牛顿运动定律。 (3) 除碰撞外,没有相互作用。 分子统计假设 1) 速度各不相同,由于碰撞而变化。 2) 平衡态时,数密度分布均匀。 3) 平衡态时,速度沿各方向分布均匀。 5.3 理想气体压强和温度公式

5,3理想气体压强和温度公式 N Vx Ux= i=l =0 i=1 -≠0 N 0x=0y=02=0 -= N ∑(++) 2 i=l N =++ 3 前页后页目录 2
前页 后页 目录 2 5.3 理想气体压强和温度公式 1 0 = = = N ix i x N v v = = = 0 v v v x y z 2 2 1 0 = = N ix i x N v v 2 2 2 v v v x y z = = 2 2 =1 = N i i N v v 2 2 2 2 v v v v = + + x y z 2 2 1 3 v v x = 2 2 2 =1 + + = ( ) N ix iy iz i N v v v
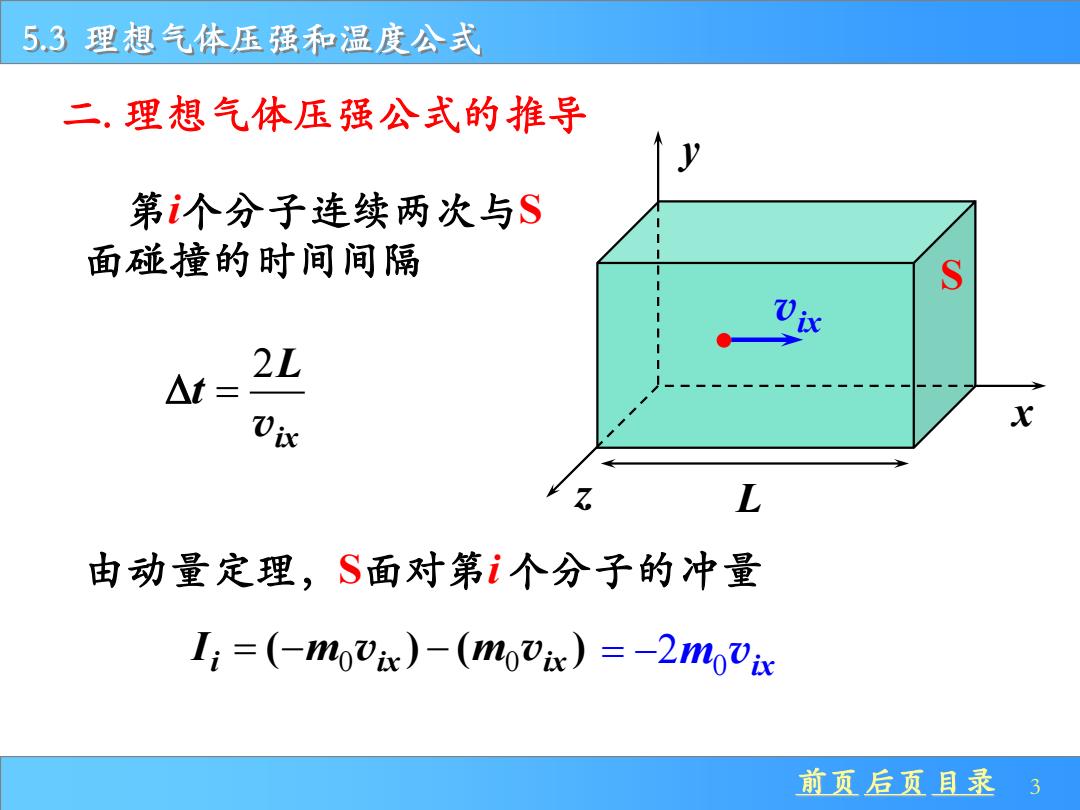
5.3理想气体压强和温度公式 二,理想气体压强公式的推导 第i个分子连续两次与S 面碰撞的时间间隔 S 0 At= 2L Vix 由动量定理,S面对第i个分子的冲量 Ii=(-movix)-(movix)=-2m0vix 前页后页目录3
前页 后页 目录 3 5.3 理想气体压强和温度公式 二. 理想气体压强公式的推导 x y z vix S L 第i个分子连续两次与S 面碰撞的时间间隔 2 = ix L t v 由动量定理,S面对第i个分子的冲量 = − − 0 0 ( ) ( ) i ix ix I m m v v 0 = −2m vix

5.3理想气体压强和温度公式 第i个分子对S面的冲量 I=-Ii=2m0vix 第i个分子对S面的平均冲力 29=m0元 △t 2L1Vix L S面所受平均力 L 前页后页目录4
前页 后页 目录 4 5.3 理想气体压强和温度公式 第i 个分子对S面的冲量 I I i i = − 第i 个分子对S面的平均冲力 = i i I F t 0 2 2 = / ix ix m L v v 2 0 = m ix L v S面所受平均力 =1 = N i i F F 2 0 =1 = N ix i m L v 0 = 2m vix

5,3理想气体压强和温度公式 S面上气体压强 mo i=l S台SLV N 21 =nmoV=。nmo)1 3 分子平均平动动能 11 %a2 21 6kt= N台2 movi= 2 理想气体的压强 2,1 2 p=3吃m,0) p=n6kt 前页后页目录 5
前页 后页 目录 5 5.3 理想气体压强和温度公式 S面上气体压强 = F p S 2 0 =1 = N ix i m SL v 2 1 0 N ix N m i V N = = v 2 = nm0vx 2 0 1 3 = nm v 分子平均平动动能 2 0 1 2 = m v 理想气体的压强 2 0 2 1 3 2 p n m = ( ) v 2 3 = kt p n 2 0 1 1 1 2 kt N i i m N = = v

5.3理想气体压强和温度公式 2 p-3nekt p=nkT 三.温度的本质和统计意义 3 分子平均平动动能 理想气体温度T= 26t 3k 统计意义 气体温度是气体分子平均平动动能的量度。 前页后页目录6
前页 后页 目录 6 5.3 理想气体压强和温度公式 p nkT = 分子平均平动动能 3 2 kt = kT 理想气体温度 2 3 = kt T k 统计意义 气体温度是气体分子平均平动动能的量度。 2 3 = kt p n 三. 温度的本质和统计意义

5.3理想气体压强和温度公式 四.气体分子的方均根速率 由分子平均平动动能8=)m,02=3kT 1 2 方均根速率 3kT 3RT mo M 前页后页目录 7
前页 后页 目录 7 5.3 理想气体压强和温度公式 由分子平均平动动能 2 0 1 3 2 2 kt = = m kT v 方均根速率 2 0 3 = kT m v 3RT M = 四. 气体分子的方均根速率
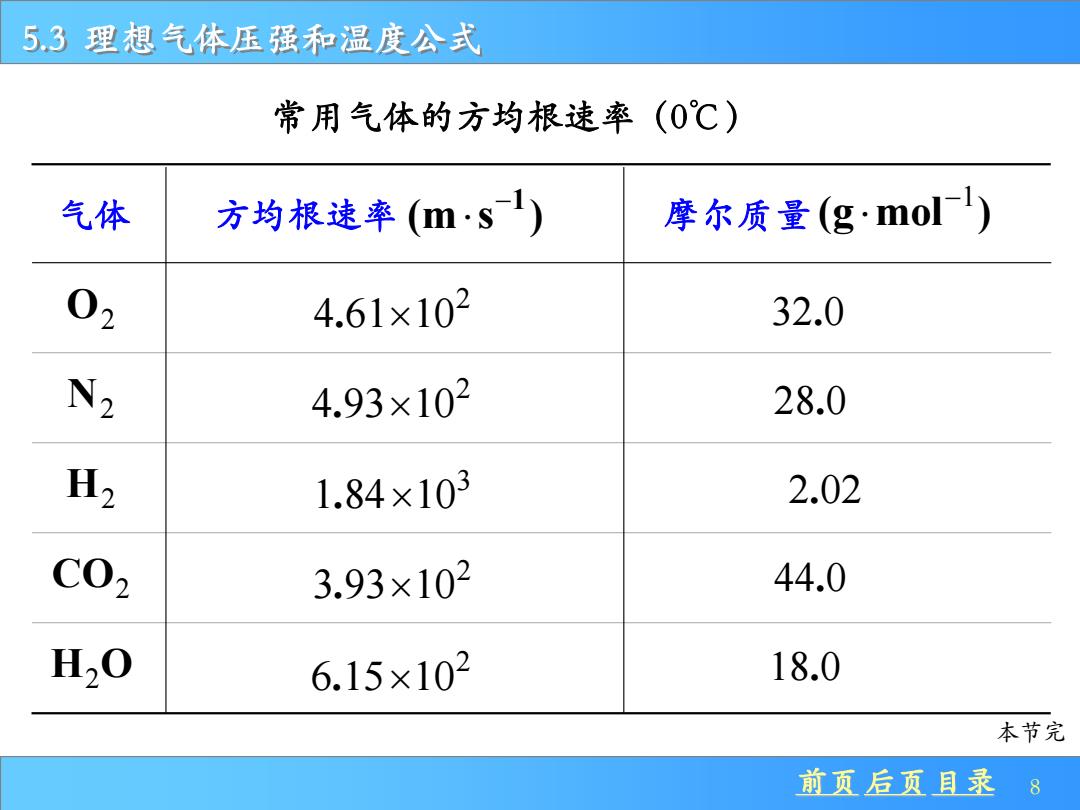
5.3理想气体压强和温度公式 常用气体的方均根速率(0℃) 气体 方均根速率(ms1) 摩尔质量(g·mol 02 4.61×102 32.0 N2 4.93×102 28.0 H2 1.84×103 2.02 C02 3.93×102 44.0 H,0 6.15×102 18.0 本节完 前页后页目录 8
前页 后页 目录 8 5.3 理想气体压强和温度公式 气体 方均根速率 − 1 (m s ) 摩尔质量 −1 (g mol ) O2 2 4 61 10 . 32 0. N2 2 4 93 10 . 28 0. H2 3 1 84 10 . 2 02 . CO2 2 3 93 10 . 44 0. H O2 2 6 15 10 . 18 0. 常用气体的方均根速率(0℃) 本节完