
目录 学科基础课程…… 无机化学I课程教学大纲 无机化学Ⅱ课程教学大纲 无机化学实验Ⅰ课程教学大纲 10 无机化学实验Ⅱ课程教学大纲 13 分析化学课程教学大纲... 16 分析化学实验课程教学大纲 20 有机化学I课程教学大纲.... 24 有机化学Ⅱ课程教学大纲.… 31 有机化学实验I课程教学大纲 36 有机化学实验Ⅱ课程教学大纲 39 物理化学I课程教学大纲.。 42 物理化学Ⅱ课程教学大纲..... 46 物理化学实验课程教学大纲............ 50 化工原理课程教学大纲 54 化工原理实验课程教学大纲… 58 仪器分析课程教学大纲....... 61 仪器分析实验课程教学大纲 66 结构化学课程教学大纲 70 工程制图与CDI课程教学大纲.。 74 专业教育课程(必修) .78 光化学导论课程教学大纲 78 能源化学导论课程教学大纲.............. 82 纳米化学课程教学大纲............... 86 应用化学综合实验课程教学大纲,,. gl 专业教育课程(选修). .95 发光原理与应用课程教学大纲........ 95 光催化原理与应用课程教学大纲. 99 光化学专业实验课程教学大纲............... 104 应用电化学课程教学大纲……… 107 1
1 目 录 学科基础课程............................................................................................................................1 无机化学Ⅰ课程教学大纲 ..................................................... 1 无机化学Ⅱ课程教学大纲 ..................................................... 5 无机化学实验Ⅰ课程教学大纲 ................................................ 10 无机化学实验Ⅱ课程教学大纲 ................................................ 13 分析化学课程教学大纲 ...................................................... 16 分析化学实验课程教学大纲 .................................................. 20 有机化学Ⅰ课程教学大纲 .................................................... 24 有机化学Ⅱ课程教学大纲 .................................................... 31 有机化学实验Ⅰ课程教学大纲 ................................................ 36 有机化学实验Ⅱ课程教学大纲 ................................................ 39 物理化学Ⅰ课程教学大纲 .................................................... 42 物理化学Ⅱ课程教学大纲 .................................................... 46 物理化学实验课程教学大纲 .................................................. 50 化工原理课程教学大纲 ...................................................... 54 化工原理实验课程教学大纲 .................................................. 58 仪器分析课程教学大纲 ...................................................... 61 仪器分析实验课程教学大纲 .................................................. 66 结构化学课程教学大纲 ...................................................... 70 工程制图与 CAD I 课程教学大纲 .............................................. 74 专业教育课程(必修)..........................................................................................................78 光化学导论课程教学大纲 .................................................... 78 能源化学导论课程教学大纲 .................................................. 82 纳米化学课程教学大纲 ...................................................... 86 应用化学综合实验课程教学大纲 .............................................. 91 专业教育课程(选修)..........................................................................................................95 发光原理与应用课程教学大纲 ................................................ 95 光催化原理与应用课程教学大纲 .............................................. 99 光化学专业实验课程教学大纲 ............................................... 104 应用电化学课程教学大纲 ................................................... 107

燃料电池原理与应用课程教学大纲 111 能源化学专业实验课程教学大纲 115 基础化学强化实验课程教学大纲 119 化学前沿论坛课程教学大纲 123 计算化学实验课程教学大纲 126 稀土化学导论课程教学大纲 129 生物化学课程教学大纲··· 133 高分子化学与物理课程教学大纲 137 高等有机化学课程教学大纲 141 化工过程模拟课程教学大纲...· 145 专业英语课程教学大纲 150 文献检索课程教学大纲 154 特色(大光电)课程… .158 锂离子电池课程教学大纲 158 光电化学课程教学大纲 163 化学科研方法课程教学大纲 166 基础实践课程. .170 工程训练课程教学大纲..... 170 专业实践课程… .177 实验室安全训练课程教学大纲 177 认识实习教学大纲 180 文献检索实训课程教学大纲· 183 计算机实习课程教学大纲 186 化工过程设计课程教学大纲 189 生产实习课程教学大纲 192 虚拟仿真实习课程教学大纲 195 科研训练教学大纲……… 197 综合实践课程 .199 毕业设计(论文)教学大纲 199 2
2 燃料电池原理与应用课程教学大纲 ........................................... 111 能源化学专业实验课程教学大纲 ............................................. 115 基础化学强化实验课程教学大纲 ............................................. 119 化学前沿论坛课程教学大纲 ................................................. 123 计算化学实验课程教学大纲 ................................................. 126 稀土化学导论课程教学大纲 ................................................. 129 生物化学课程教学大纲 ..................................................... 133 高分子化学与物理课程教学大纲 ............................................. 137 高等有机化学课程教学大纲 ................................................. 141 化工过程模拟课程教学大纲 ................................................. 145 专业英语课程教学大纲 ..................................................... 150 文献检索课程教学大纲 ..................................................... 154 特色(大光电)课程............................................................................................................158 锂离子电池课程教学大纲 ................................................... 158 光电化学课程教学大纲 ..................................................... 163 化学科研方法课程教学大纲 ................................................. 166 基础实践课程........................................................................................................................170 工程训练Ⅲ课程教学大纲 ................................................... 170 专业实践课程........................................................................................................................177 实验室安全训练课程教学大纲 ............................................... 177 认识实习教学大纲 ......................................................... 180 文献检索实训课程教学大纲 ................................................. 183 计算机实习课程教学大纲 ................................................... 186 化工过程设计课程教学大纲 ................................................. 189 生产实习课程教学大纲 ..................................................... 192 虚拟仿真实习课程教学大纲 ................................................. 195 科研训练教学大纲 ......................................................... 197 综合实践课程........................................................................................................................199 毕业设计(论文)教学大纲 ................................................. 199
学科基础课程 无机化学〡课程教学大纲 一、课程基本信息 课程编码 070721101 开课单位 化学与环境工程学院 无机化学1 课程名称 Inorganic Chemistry 课程学时 40 课程学分 2.5 课程类别 学科基础课 课程性质 必修 开课学期 课内实验学时 0 适用专业 应用化学 选用教材 《无机化学》 先修课程 无 考核方式 闭卷考试 制定人 朱忠丽 制定时间 2018.07 二、课程性质及目标 本课程是应用化学专业的第一门化学专业基础课。它是培养化学类专业工程技术人才的整 体知识结构及能力结构的重要组成部分,同时也是后继化学课程的基础。通过本课程的教学, 使学生掌握物质结构的基础理论、化学反应的基本原理、元素化学的基本知识和实验的基本技 能:培养学生具有解决一般无机化学问题,独立进行无机化学实验,自学无机化学书刊的能力。 本课程拟达到的课程目标:学生能够掌握元素周期律、近代物质结构理论、化学热力学、 电离平衡、氧化还原等基本原理,以及重要元素和化合物的主要性质、结构和用途:培养对无 机化学问题进行理论分析和计算的能力,以及利用参考资料的能力:树立辩证唯物主义和历史 唯物主义观点,在科学思维上得到训练和培养。 三、课程日标及对毕业要求的支撑 1.在工程实践中主动应用无机化学学科的专业基础知识来解决应用化学专业领域的相关现 象(毕业要求1获取和应用化学知识的能力): 2.能够运用物质结构的基础理论、化学反应的基本原理、元素化学的基本知识对本专业领 域问题进行判断、分析和研究,并形成解决方案(毕业要求2问题分析的能力)。 四、课程的教学内容、基本要求与学时分配 1
1 学科基础课程 无机化学Ⅰ课程教学大纲 一、课程基本信息 课程编码 070721101 开课单位 化学与环境工程学院 课程名称 无机化学Ⅰ Inorganic Chemistry Ⅰ 课程学时 40 课程学分 2.5 课程类别 学科基础课 课程性质 必修 开课学期 1 课内实验学时 0 适用专业 应用化学 选用教材 《无机化学》 先修课程 无 考核方式 闭卷考试 制定人 朱忠丽 制定时间 2018.07 二、课程性质及目标 本课程是应用化学专业的第一门化学专业基础课。它是培养化学类专业工程技术人才的整 体知识结构及能力结构的重要组成部分,同时也是后继化学课程的基础。通过本课程的教学, 使学生掌握物质结构的基础理论、化学反应的基本原理、元素化学的基本知识和实验的基本技 能;培养学生具有解决一般无机化学问题,独立进行无机化学实验,自学无机化学书刊的能力。 本课程拟达到的课程目标:学生能够掌握元素周期律、近代物质结构理论、化学热力学、 电离平衡、氧化还原等基本原理,以及重要元素和化合物的主要性质、结构和用途;培养对无 机化学问题进行理论分析和计算的能力,以及利用参考资料的能力;树立辩证唯物主义和历史 唯物主义观点,在科学思维上得到训练和培养。 三、课程目标及对毕业要求的支撑 1. 在工程实践中主动应用无机化学学科的专业基础知识来解决应用化学专业领域的相关现 象(毕业要求 1 获取和应用化学知识的能力); 2. 能够运用物质结构的基础理论、化学反应的基本原理、元素化学的基本知识对本专业领 域问题进行判断、分析和研究,并形成解决方案(毕业要求 2 问题分析的能力)。 四、课程的教学内容、基本要求与学时分配
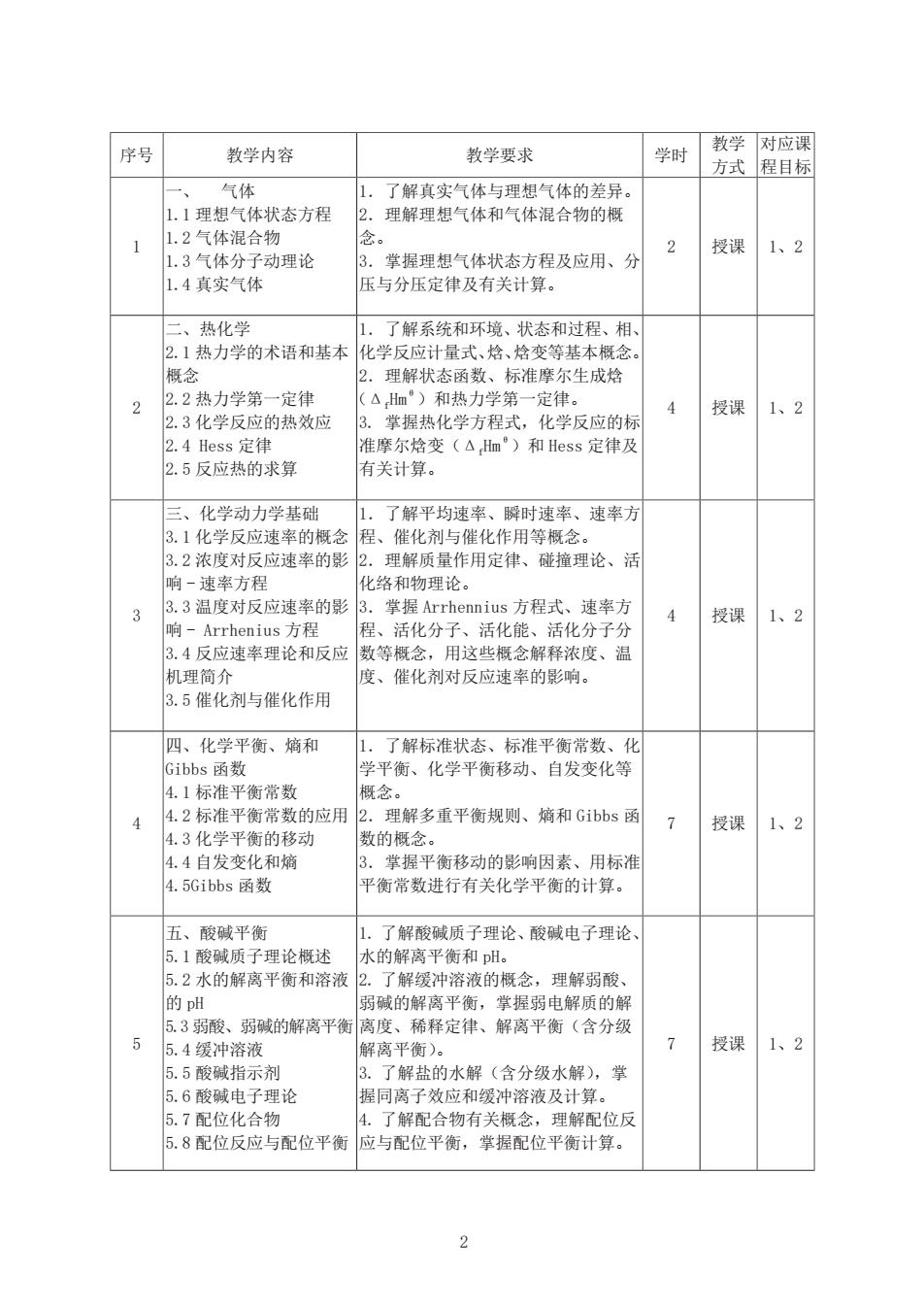
序号 对应课 教学内容 教学要求 学时 教学 方式 程目标 气体 了解真实气体与理想气体的差异。 1.1理想气体状态方程 2. 理解理想气体和气体混合物的概 1.2气体混合物 念。 2 授课 1、2 1.3气体分子动理论 3. 掌握理想气体状态方程及应用、分 1.4真实气体 压与分压定律及有关计算。 二、热化学 1. 了解系统和环境、状态和过程、相、 2.1热力学的术语和基本 化学反应计量式、焓、焓变等基本概念。 概念 2. 理解状态函数、标准摩尔生成焓 2 2.2热力学第一定律 (△Hlm°)和热力学第一定律。 授课 1、2 2.3化学反应的热效应 3. 掌握热化学方程式,化学反应的标 2.4Hess定律 准摩尔焓变(△Hm°)和Hess定律及 2.5反应热的求算 有关计算。 三、化学动力学基础 1.了解平均速率、瞬时速率、速率方 3.1化学反应速率的概念 程、催化剂与催化作用等概念。 3.2浓度对反应速率的影 2.理解质量作用定律、碰撞理论、活 响-速率方程 化络和物理论。 3 3.3温度对反应速率的影 3.掌握Arrhennius方程式、速率方 授课 1、2 响-Arrhenius方程 程、活化分子、活化能、活化分子分 3.4反应速率理论和反应 数等概念,用这些概念解释浓度、温 机理简介 度、催化剂对反应速率的影响。 3.5催化剂与催化作用 四、化学平衡、熵和 1. 了解标准状态、标准平衡常数、化 Gibbs函数 学平衡、化学平衡移动、自发变化等 4.1标准平衡常数 概念。 4 4.2标准平衡常数的应用 2.理解多重平衡规则、熵和Gibbs函 7 授课 1、2 4.3化学平衡的移动 数的概念。 4.4自发变化和熵 3. 掌握平衡移动的影响因素、用标准 4.5 Gibbs函数 平衡常数进行有关化学平衡的计算。 五、酸碱平衡 1. 了解酸碱质子理论、酸碱电子理论 5.1酸碱质子理论概述 水的解离平衡和pH。 5.2水的解离平衡和溶液 2.了解缓冲溶液的概念,理解弱酸、 的pH 弱碱的解离平衡,掌握弱电解质的解 5.3弱酸、弱碱的解离平衡 离度、稀释定律、解离平衡(含分级 5 5.4缓冲溶液 解离平衡)。 7 授课 1、2 5.5酸碱指示剂 3.了解盐的水解(含分级水解),掌 5.6酸碱电子理论 握同离子效应和缓冲溶液及计算。 5.7配位化合物 4.了解配合物有关概念, 理解配位反 5.8配位反应与配位平衡 应与配位平衡,掌握配位平衡计算。 2
2 序号 教学内容 教学要求 学时 教学 方式 对应课 程目标 1 一、 气体 1.1 理想气体状态方程 1.2 气体混合物 1.3 气体分子动理论 1.4 真实气体 1.了解真实气体与理想气体的差异。 2.理解理想气体和气体混合物的概 念。 3.掌握理想气体状态方程及应用、分 压与分压定律及有关计算。 2 授课 1、2 2 二、热化学 2.1 热力学的术语和基本 概念 2.2 热力学第一定律 2.3 化学反应的热效应 2.4 Hess 定律 2.5 反应热的求算 1.了解系统和环境、状态和过程、相、 化学反应计量式、焓、焓变等基本概念。 2.理解状态函数、标准摩尔生成焓 (ΔfHmθ)和热力学第一定律。 3. 掌握热化学方程式,化学反应的标 准摩尔焓变(ΔfHmθ)和 Hess 定律及 有关计算。 4 授课 1、2 3 三、化学动力学基础 3.1 化学反应速率的概念 3.2 浓度对反应速率的影 响 - 速率方程 3.3 温度对反应速率的影 响 - Arrhenius 方程 3.4 反应速率理论和反应 机理简介 3.5 催化剂与催化作用 1.了解平均速率、瞬时速率、速率方 程、催化剂与催化作用等概念。 2.理解质量作用定律、碰撞理论、活 化络和物理论。 3.掌握 Arrhennius 方程式、速率方 程、活化分子、活化能、活化分子分 数等概念,用这些概念解释浓度、温 度、催化剂对反应速率的影响。 4 授课 1、2 4 四、化学平衡、熵和 Gibbs 函数 4.1 标准平衡常数 4.2 标准平衡常数的应用 4.3 化学平衡的移动 4.4 自发变化和熵 4.5Gibbs 函数 1.了解标准状态、标准平衡常数、化 学平衡、化学平衡移动、自发变化等 概念。 2.理解多重平衡规则、熵和 Gibbs 函 数的概念。 3.掌握平衡移动的影响因素、用标准 平衡常数进行有关化学平衡的计算。 7 授课 1、2 5 五、酸碱平衡 5.1 酸碱质子理论概述 5.2 水的解离平衡和溶液 的 pH 5.3 弱酸、弱碱的解离平衡 5.4 缓冲溶液 5.5 酸碱指示剂 5.6 酸碱电子理论 5.7 配位化合物 5.8 配位反应与配位平衡 1. 了解酸碱质子理论、酸碱电子理论、 水的解离平衡和 pH。 2. 了解缓冲溶液的概念,理解弱酸、 弱碱的解离平衡,掌握弱电解质的解 离度、稀释定律、解离平衡(含分级 解离平衡)。 3. 了解盐的水解(含分级水解),掌 握同离子效应和缓冲溶液及计算。 4. 了解配合物有关概念,理解配位反 应与配位平衡,掌握配位平衡计算。 7 授课 1、2
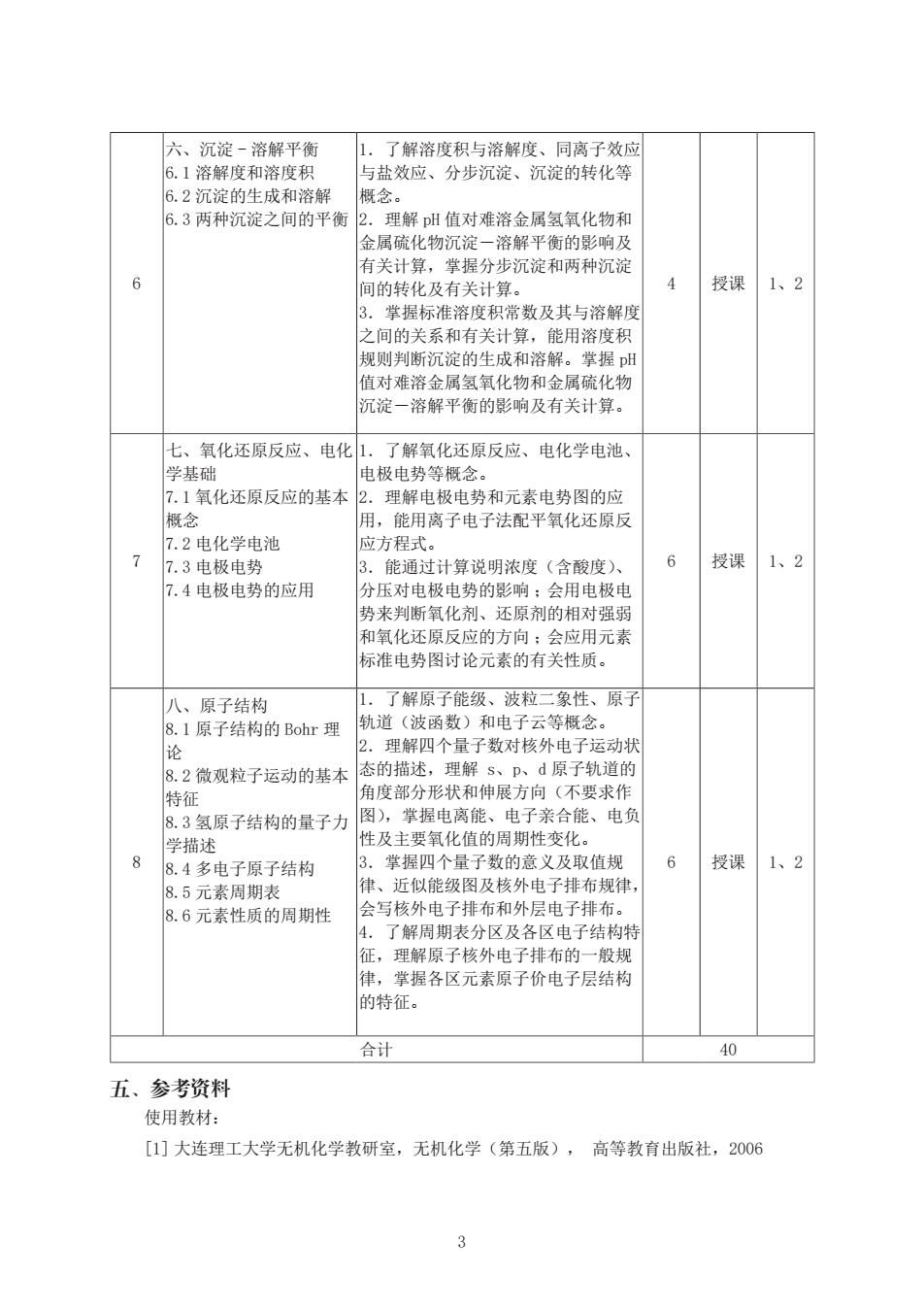
六、沉淀-溶解平衡 了解溶度积与溶解度、同离子效应 6.1溶解度和溶度积 与盐效应、分步沉淀、沉淀的转化等 6.2沉淀的生成和溶解 概念。 6.3两种沉淀之间的平衡 2.理解pH值对难溶金属氢氧化物和 金属硫化物沉淀一溶解平衡的影响及 有关计算,掌握分步沉淀和两种沉淀 6 间的转化及有关计算。 授课 1、2 3.掌握标准溶度积常数及其与溶解度 之间的关系和有关计算,能用溶度积 规则判断沉淀的生成和溶解。掌握pH 值对难溶金属氢氧化物和金属硫化物 沉淀一溶解平衡的影响及有关计算。 七、氧化还原反应、电化1.了解氧化还原反应、电化学电池、 学基础 电极电势等概念。 7.1氧化还原反应的基本 2.理解电极电势和元素电势图的应 概念 用,能用离子电子法配平氧化还原反 7.2电化学电池 应方程式。 7 7.3电极电势 3.能通过计算说明浓度(含酸度)、 6 授课 1、2 7.4电极电势的应用 分压对电极电势的影响:会用电极电 势来判断氧化剂、还原剂的相对强弱 和氧化还原反应的方向:会应用元素 标准电势图讨论元素的有关性质。 八、原子结构 1.了解原子能级、波粒二象性、原子 8.1原子结构的Bohr理 轨道(波函数)和电子云等概念。 论 2.理解四个量子数对核外电子运动状 8.2微观粒子运动的基本 态的描述,理解s、p、d原子轨道的 特征 角度部分形状和伸展方向(不要求作 8.3氢原子结构的量子力 图),掌握电离能、电子亲合能、电负 学描述 性及主要氧化值的周期性变化。 8.4多电子原子结构 3. 掌握四个量子数的意义及取值规 6 授课 1、2 8.5元素周期表 律、近似能级图及核外电子排布规律, 8.6元素性质的周期性 会写核外电子排布和外层电子排布。 4. 了解周期表分区及各区电子结构特 征,理解原子核外电子排布的一般规 律,掌握各区元素原子价电子层结构 的特征。 合计 40 五、参考资料 使用教材: [1]大连理工大学无机化学教研室,无机化学(第五版),高等教育出版社,2006
3 6 六、沉淀 - 溶解平衡 6.1 溶解度和溶度积 6.2 沉淀的生成和溶解 6.3 两种沉淀之间的平衡 1.了解溶度积与溶解度、同离子效应 与盐效应、分步沉淀、沉淀的转化等 概念。 2.理解 pH 值对难溶金属氢氧化物和 金属硫化物沉淀-溶解平衡的影响及 有关计算,掌握分步沉淀和两种沉淀 间的转化及有关计算。 3.掌握标准溶度积常数及其与溶解度 之间的关系和有关计算,能用溶度积 规则判断沉淀的生成和溶解。掌握 pH 值对难溶金属氢氧化物和金属硫化物 沉淀-溶解平衡的影响及有关计算。 4 授课 1、2 7 七、氧化还原反应、电化 学基础 7.1 氧化还原反应的基本 概念 7.2 电化学电池 7.3 电极电势 7.4 电极电势的应用 1.了解氧化还原反应、电化学电池、 电极电势等概念。 2.理解电极电势和元素电势图的应 用,能用离子电子法配平氧化还原反 应方程式。 3.能通过计算说明浓度(含酸度)、 分压对电极电势的影响 ;会用电极电 势来判断氧化剂、还原剂的相对强弱 和氧化还原反应的方向 ;会应用元素 标准电势图讨论元素的有关性质。 6 授课 1、2 8 八、原子结构 8.1 原子结构的 Bohr 理 论 8.2 微观粒子运动的基本 特征 8.3 氢原子结构的量子力 学描述 8.4 多电子原子结构 8.5 元素周期表 8.6 元素性质的周期性 1.了解原子能级、波粒二象性、原子 轨道(波函数)和电子云等概念。 2.理解四个量子数对核外电子运动状 态的描述,理解 s、p、d 原子轨道的 角度部分形状和伸展方向(不要求作 图),掌握电离能、电子亲合能、电负 性及主要氧化值的周期性变化。 3.掌握四个量子数的意义及取值规 律、近似能级图及核外电子排布规律, 会写核外电子排布和外层电子排布。 4.了解周期表分区及各区电子结构特 征,理解原子核外电子排布的一般规 律,掌握各区元素原子价电子层结构 的特征。 6 授课 1、2 合计 40 五、参考资料 使用教材: [1] 大连理工大学无机化学教研室,无机化学(第五版), 高等教育出版社,2006

主要参考教材: [1]迟玉兰等,无机化学释疑与习题解析(第二版),高等教育出版社,2006 [2]大连理工大学无机化学教研室,无机化学学习指导(第五版),大连理工大学出版社, 2006 [3]北京师范大学无机化学教研室,无机化学(第四版),高等教育出版社,2010 [4]武汉大学,吉林大学等,无机化学(第三版),高等教育出版社,2002 六、考核与成绩评定 1、课程以课堂授课方式完成,理论授课48学时,采用“启发式”和“讨论式”等教学方 式提升教学的效果。 2、《无机化学(上)》课程的考核采用期末闭卷笔试的考核形式,促进学习目标的达成: (1)平时成绩(包括随堂测试、作业等) (2)期末考试 3、成绩评定 平时成绩 期末考试 20% 80% 七、课程日标达成评价 课程目标的实际达成效果计算方式如下,达成值越高,教学效果越好。 课程目标达成度= 学生相应环节得分平均值 该环节的满分 毕业要求指标达成度=Σ课程目标达成度×课程目标在毕业要求指标点的权重 制定人:朱忠丽 审核人:杨铭 4
4 主要参考教材: [1] 迟玉兰等,无机化学释疑与习题解析(第二版),高等教育出版社,2006 [2] 大连理工大学无机化学教研室,无机化学学习指导(第五版),大连理工大学出版社, 2006 [3] 北京师范大学无机化学教研室,无机化学(第四版),高等教育出版社,2010 [4] 武汉大学,吉林大学等,无机化学(第三版),高等教育出版社,2002 六、考核与成绩评定 1、课程以课堂授课方式完成,理论授课 48 学时,采用“启发式”和“讨论式”等教学方 式提升教学的效果。 2、《无机化学(上)》课程的考核采用期末闭卷笔试的考核形式,促进学习目标的达成: (1)平时成绩(包括随堂测试、作业等) (2)期末考试 3、成绩评定 平时成绩 期末考试 20% 80% 七、课程目标达成评价 课程目标的实际达成效果计算方式如下,达成值越高,教学效果越好。 课程目标达成度= 学生相应环节得分平均值 毕业要求指标达成度 = ∑课程目标达成度 × 课程目标在毕业要求指标点的权重 制定人:朱忠丽 审核人:杨 铭 该环节的满分

无机化学川课程教学大纲 一、 课程基本信息 课程编码 070721102 开课单位 化学与环境工程学院 (中文)无机化学Ⅱ 课程名称 (英文)Inorganic ChemistryⅡ 课程学时 40 课程学分 2.5 课程类别 学科基础课 课程性质 必修 开课学期 2 课内实验学时 0 适用专业 应用化学 选用教材 《无机化学》 先修课程 无机化学(上) 考核方式 闭卷考试 制定人 朱忠丽 制定时间 2018.07 二、课程性质及目标 本课程是应用化学专业的第一门化学专业基础课。它是培养化学类专业工程技术人才的整 体知识结构及能力结构的重要组成部分,同时也是后继化学课程的基础。通过本课程的教学, 使学生掌握物质结构的基础理论、化学反应的基本原理、元素化学的基本知识和实验的基本技 能:培养学生具有解决一般无机化学问题,独立进行无机化学实验,自学无机化学书刊的能力。 本课程拟达到的课程目标:掌握元素周期律、近代物质结构理论、化学热力学、电离平衡、 氧化还原等基本原理,以及重要元素和化合物的主要性质、结构和用途:培养对无机化学问题 进行理论分析和计算的能力,以及利用参考资料的能力:树立辩证唯物主义和历史唯物主义观 点,在科学思维上得到训练和培养。 三、课程目标及对毕业要求的支撑 1.在工程实践中主动应用无机化学学科的专业基础知识来解决应用化学专业领域的相关 现象(毕业要求1获取和应用化学知识的能力): 2.能够运用物质结构的基础理论、化学反应的基本原理、元素化学的基本知识对本专业领 域问题进行判断、分析和研究,并形成解决方案(毕业要求2问题分析的能力)。 四、课程的教学内容、基本要求与学时分配
5 无机化学Ⅱ课程教学大纲 一、课程基本信息 课程编码 070721102 开课单位 化学与环境工程学院 课程名称 (中文)无机化学Ⅱ (英文)Inorganic Chemistry Ⅱ 课程学时 40 课程学分 2.5 课程类别 学科基础课 课程性质 必修 开课学期 2 课内实验学时 0 适用专业 应用化学 选用教材 《无机化学》 先修课程 无机化学(上) 考核方式 闭卷考试 制定人 朱忠丽 制定时间 2018.07 二、课程性质及目标 本课程是应用化学专业的第一门化学专业基础课。它是培养化学类专业工程技术人才的整 体知识结构及能力结构的重要组成部分,同时也是后继化学课程的基础。通过本课程的教学, 使学生掌握物质结构的基础理论、化学反应的基本原理、元素化学的基本知识和实验的基本技 能;培养学生具有解决一般无机化学问题,独立进行无机化学实验,自学无机化学书刊的能力。 本课程拟达到的课程目标:掌握元素周期律、近代物质结构理论、化学热力学、电离平衡、 氧化还原等基本原理,以及重要元素和化合物的主要性质、结构和用途;培养对无机化学问题 进行理论分析和计算的能力,以及利用参考资料的能力;树立辩证唯物主义和历史唯物主义观 点,在科学思维上得到训练和培养。 三、课程目标及对毕业要求的支撑 1. 在工程实践中主动应用无机化学学科的专业基础知识来解决应用化学专业领域的相关 现象(毕业要求 1 获取和应用化学知识的能力); 2. 能够运用物质结构的基础理论、化学反应的基本原理、元素化学的基本知识对本专业领 域问题进行判断、分析和研究,并形成解决方案(毕业要求 2 问题分析的能力)。 四、课程的教学内容、基本要求与学时分配
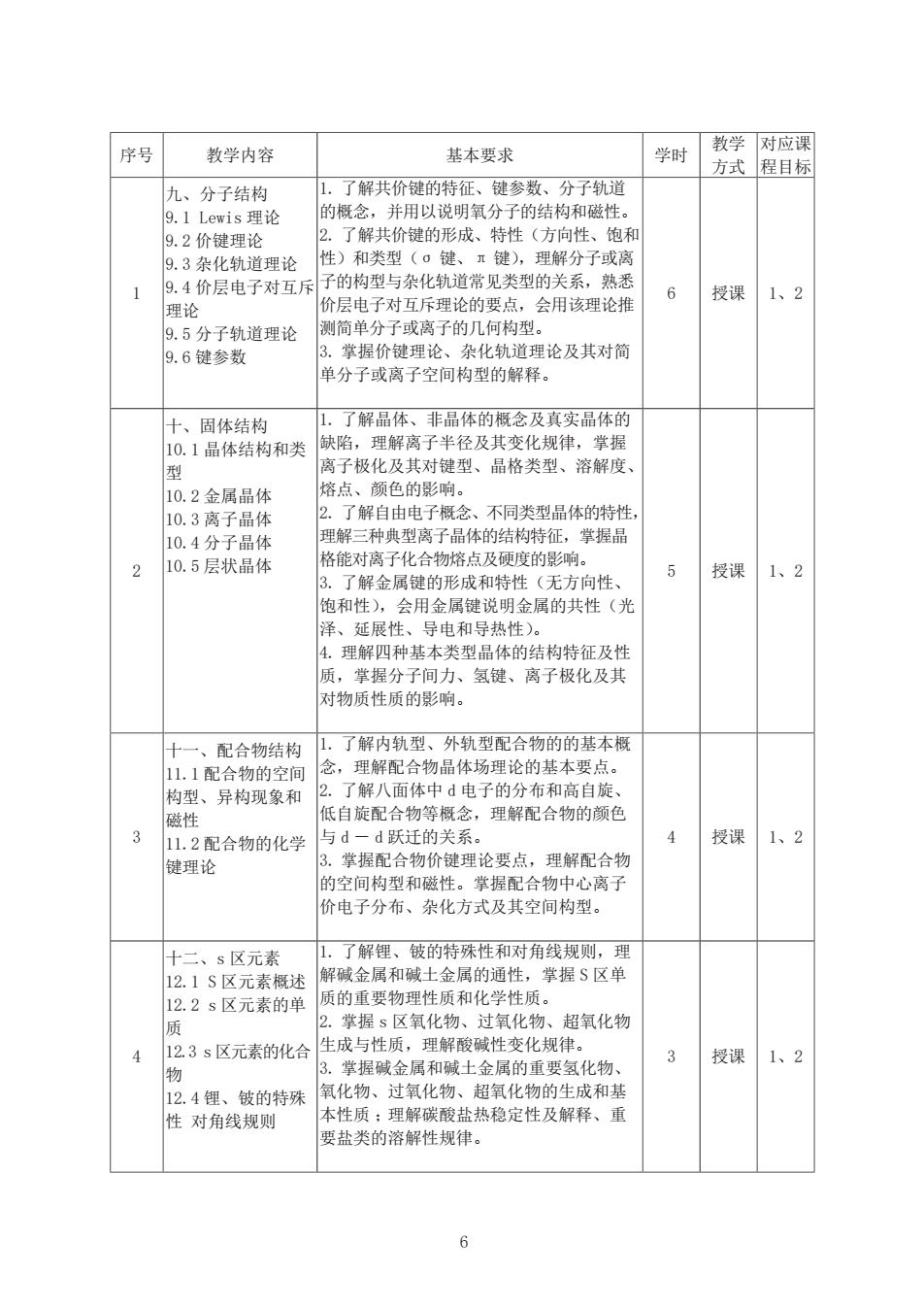
序号 教学内容 基本要求 学时 教学 对应课 方式 程目标 九、分子结构 1.了解共价键的特征、键参数、分子轨道 9.1 Lewis理论 的概念,并用以说明氧分子的结构和磁性。 9.2价键理论 2.了解共价键的形成、特性(方向性、饱和 9.3杂化轨道理论 性)和类型(σ键、兀键),理解分子或离 9.4价层电子对互斥 子的构型与杂化轨道常见类型的关系,熟悉 1 6 授课 1、2 理论 价层电子对互斥理论的要点,会用该理论推 9.5分子轨道理论 测简单分子或离子的几何构型。 9.6键参数 3.掌握价键理论、杂化轨道理论及其对简 单分子或离子空间构型的解释。 十、固体结构 1.了解晶体、非晶体的概念及真实晶体的 10.1晶体结构和类 缺陷,理解离子半径及其变化规律,掌握 型 离子极化及其对键型、晶格类型、溶解度、 10.2金属晶体 熔点、颜色的影响。 10.3离子晶体 2.了解自由电子概念、不同类型晶体的特性, 10.4分子晶体 理解三种典型离子晶体的结构特征,掌握晶 10.5层状晶体 格能对离子化合物熔点及硬度的影响。 5 授课 1、2 3.了解金属键的形成和特性(无方向性、 饱和性),会用金属键说明金属的共性(光 泽、延展性、导电和导热性)。 4.理解四种基本类型晶体的结构特征及性 质,掌握分子间力、氢键、离子极化及其 对物质性质的影响。 十一、配合物结构 1. 了解内轨型、外轨型配合物的的基本概 11.1配合物的空间 念,理解配合物晶体场理论的基本要点。 构型、异构现象和 2.了解八面体中d电子的分布和高自旋、 磁性 低自旋配合物等概念,理解配合物的颜色 3 11.2配合物的化学 与d一d跃迁的关系。 4 授课 1、2 键理论 3 掌握配合物价键理论要点,理解配合物 的空间构型和磁性。掌握配合物中心离子 价电子分布、杂化方式及其空间构型。 十二、s区元素 1.了解锂、铍的特殊性和对角线规则,理 12.1S区元素概述 解碱金属和碱土金属的通性,掌握S区单 12.2s区元素的单 质的重要物理性质和化学性质。 质 2.掌握s区氧化物、过氧化物、超氧化物 4 12.3s区元素的化合 生成与性质,理解酸碱性变化规律。 3 授课 1、2 物 3.掌握碱金属和碱土金属的重要氢化物、 12.4锂、铍的特殊 氧化物、过氧化物、超氧化物的生成和基 性对角线规则 本性质:理解碳酸盐热稳定性及解释、重 要盐类的溶解性规律
6 序号 教学内容 基本要求 学时 教学 方式 对应课 程目标 1 九、分子结构 9.1 Lewis 理论 9.2 价键理论 9.3 杂化轨道理论 9.4 价层电子对互斥 理论 9.5 分子轨道理论 9.6 键参数 1. 了解共价键的特征、键参数、分子轨道 的概念,并用以说明氧分子的结构和磁性。 2. 了解共价键的形成、特性(方向性、饱和 性)和类型(σ 键、π 键),理解分子或离 子的构型与杂化轨道常见类型的关系,熟悉 价层电子对互斥理论的要点,会用该理论推 测简单分子或离子的几何构型。 3. 掌握价键理论、杂化轨道理论及其对简 单分子或离子空间构型的解释。 6 授课 1、2 2 十、固体结构 10.1 晶体结构和类 型 10.2 金属晶体 10.3 离子晶体 10.4 分子晶体 10.5 层状晶体 1. 了解晶体、非晶体的概念及真实晶体的 缺陷,理解离子半径及其变化规律,掌握 离子极化及其对键型、晶格类型、溶解度、 熔点、颜色的影响。 2. 了解自由电子概念、不同类型晶体的特性, 理解三种典型离子晶体的结构特征,掌握晶 格能对离子化合物熔点及硬度的影响。 3. 了解金属键的形成和特性(无方向性、 饱和性),会用金属键说明金属的共性(光 泽、延展性、导电和导热性)。 4. 理解四种基本类型晶体的结构特征及性 质,掌握分子间力、氢键、离子极化及其 对物质性质的影响。 5 授课 1、2 3 十一、配合物结构 11.1 配合物的空间 构型、异构现象和 磁性 11.2 配合物的化学 键理论 1. 了解内轨型、外轨型配合物的的基本概 念,理解配合物晶体场理论的基本要点。 2. 了解八面体中 d 电子的分布和高自旋、 低自旋配合物等概念,理解配合物的颜色 与 d - d 跃迁的关系。 3. 掌握配合物价键理论要点,理解配合物 的空间构型和磁性。掌握配合物中心离子 价电子分布、杂化方式及其空间构型。 4 授课 1、2 4 十二、s 区元素 12.1 S 区元素概述 12.2 s 区元素的单 质 12.3 s 区元素的化合 物 12.4 锂、铍的特殊 性 对角线规则 1. 了解锂、铍的特殊性和对角线规则,理 解碱金属和碱土金属的通性,掌握 S 区单 质的重要物理性质和化学性质。 2. 掌握 s 区氧化物、过氧化物、超氧化物 生成与性质,理解酸碱性变化规律。 3. 掌握碱金属和碱土金属的重要氢化物、 氧化物、过氧化物、超氧化物的生成和基 本性质 ;理解碳酸盐热稳定性及解释、重 要盐类的溶解性规律。 3 授课 1、2
十三、p区元素(一)1.了解硼族元素的通性,理解缺电子原子 13.1p区元素概述 和缺电子化合物的概念,掌握乙硼烷的结 13.2硼族元素 构和重要性质。了解硼的卤化物的结构和 13.3碳族元素 水解,掌握硼酸、硼砂的的晶体结构和性质! 2.熟悉铝及其重要化合物的性质。 3. 了解碳族元素的通性,掌握碳单质的结 构、二氧化碳、碳酸及其盐的重要性质, 5 能用离子极化理论说明碳酸盐的热稳定性: 授课 1、2 4.了解硅单质、二氧化硅、硅酸及其盐、 硅的卤化物的重要性质。 5.了解锡、铅的氧化物,理解锡、铅氢氧 化物的酸碱性及其变化规律:掌握Sn(Ⅱ) 的还原性和Pb(IV)的氧化性:理解锡、 铅硫化物的颜色、生成和溶解性。 十四、P区元素(二) 1.了解氮族元素的通性,熟悉氮分子的结 14.1氮族元素 构和特殊稳定性。掌握氮的结构和性质、 14.2氧族元素 铵盐的性质。了解联氨、羟胺的重要性质。 熟悉氮的氧化物的结构,掌握硝酸的结构 和性质、硝酸盐和亚硝酸盐的性质。 2.了解磷的单质、氢化物、氧化物、卤化 物的结构和性质,熟悉磷酸及其盐的性质。 了解亚磷酸和次磷酸的结构和性质。 3.掌握砷、锑、铋氧化物及其水合物的酸 碱性及其变化规律。熟悉砷、锑、铋硫化 物的颜色、生成和溶解及砷、锑的硫代酸盐 6 掌握砷、锑、铋化合物氧化还原性的变化 5 授课 1、2 规律和重要反应。 4.了解氧族元素的通性、氧单质的结构和 性质,掌握过氧化氢的结构、性质和重要 反应。 5.熟悉硫单质的结构和性质,掌握硫化氢 的性质、金属硫化物的溶解性。了解多硫 化物的性质,熟悉二氧化硫、三氧化硫的 结构,掌握亚硫酸及其盐、硫酸及其盐的 性质。了解焦硫酸盐、连二亚硫酸盐的性 质。掌握硫代硫酸盐、过二硫酸盐的结构 和性质。 十五、p区元素(三) 1.了解p区元素化合物性质的递变规律, 15.1卤素 掌握卤素含氧化合物的性质。 7 15.2稀有气体 2.熟悉卤素的通性、卤素单质的制备和性 授课 质。掌握卤化氢的制备及其还原性、酸性、 1、2 稳定性的变化规律。 7
7 5 十三、p 区元素(一) 13.1 p 区元素概述 13.2 硼族元素 13.3 碳族元素 1. 了解硼族元素的通性,理解缺电子原子 和缺电子化合物的概念,掌握乙硼烷的结 构和重要性质。了解硼的卤化物的结构和 水解,掌握硼酸、硼砂的的晶体结构和性质。 2. 熟悉铝及其重要化合物的性质。 3. 了解碳族元素的通性,掌握碳单质的结 构、二氧化碳、碳酸及其盐的重要性质, 能用离子极化理论说明碳酸盐的热稳定性。 4. 了解硅单质、二氧化硅、硅酸及其盐、 硅的卤化物的重要性质。 5. 了解锡、铅的氧化物,理解锡、铅氢氧 化物的酸碱性及其变化规律 ;掌握 Sn( Ⅱ ) 的还原性和 Pb ( Ⅳ ) 的氧化性 ;理解锡、 铅硫化物的颜色、生成和溶解性。 4 授课 1、2 6 十四、P 区元素(二) 14.1 氮族元素 14.2 氧族元素 1. 了解氮族元素的通性,熟悉氮分子的结 构和特殊稳定性。掌握氮的结构和性质、 铵盐的性质。了解联氨、羟胺的重要性质。 熟悉氮的氧化物的结构,掌握硝酸的结构 和性质、硝酸盐和亚硝酸盐的性质。 2. 了解磷的单质、氢化物、氧化物、卤化 物的结构和性质,熟悉磷酸及其盐的性质。 了解亚磷酸和次磷酸的结构和性质。 3. 掌握砷、锑、铋氧化物及其水合物的酸 碱性及其变化规律。熟悉砷、锑、铋硫化 物的颜色、生成和溶解及砷、锑的硫代酸盐。 掌握砷、锑、铋化合物氧化还原性的变化 规律和重要反应。 4. 了解氧族元素的通性、氧单质的结构和 性质,掌握过氧化氢的结构、性质和重要 反应。 5. 熟悉硫单质的结构和性质,掌握硫化氢 的性质、金属硫化物的溶解性。了解多硫 化物的性质,熟悉二氧化硫、三氧化硫的 结构,掌握亚硫酸及其盐、硫酸及其盐的 性质。了解焦硫酸盐、连二亚硫酸盐的性 质。掌握硫代硫酸盐、过二硫酸盐的结构 和性质。 5 授课 1、2 7 十五、p 区元素(三) 15.1 卤素 15.2 稀有气体 1. 了解 p 区元素化合物性质的递变规律, 掌握卤素含氧化合物的性质。 2. 熟悉卤素的通性、卤素单质的制备和性 质。掌握卤化氢的制备及其还原性、酸性、 稳定性的变化规律。 3 授课 1、2
3.掌握氯的含氧酸及其盐的性质(酸性、 氧化还原性、热稳定性)及其变化规律。 熟悉溴、碘的含氧酸的基本性质。 4.了解稀有气体的重要性质及其变化规律 稀有气体化合物及其几何构型。 十六、d区元素(一) 1.了解d区元素通性,掌握铬、锰、铁、钴、 16.1d区元素概述 镍及其化合物的性质。 16.2钛钒 2.熟悉Cr(Ⅲ)氧化物、氢氧化物的溶解 16.3铬钼钨多酸 性和两性,了解Cr(Ⅲ)在碱性介质中的 型配合物 还原性,理解Cr(Ⅵ)在酸碱介质中的存 16.4锰族元素 在形态及相互变化,掌握Cr(Ⅵ)在酸性 8 16.5铁钴镍 介质中的氧化性。 授课 1、2 3.了解Mn(ⅡIVIVI)的重要化合物,理 解Mn的元素电势图,掌握KMnO4在不同介 质中的氧化性及还原产物。 4.了解Fe(ⅡⅢ)、Co(Ⅱ)、Ni(Ⅱ)的 重要化合物及配合物的性质。 十七、d区元素(二) 1.了解铜族元素的通性。 17.1铜族元素 2.掌握铜的氧化物、氢氧化物、重要铜盐 17.2锌族元素 的性质,Cu(I)和Cu(Ⅱ)的相互转化, 铜的重要配合物,水溶液中Cu2的重要反 应。 3.熟悉银的氧化物、氢氧化物的性质,了 解银的重要配合物,掌握水溶液中Ag的重 要反应。 9 4 授课 1、2 4.了解锌族元素的通性,熟悉锌的重要配 合物,掌握氢氧化锌的性质、水溶液中Z 的重要反应。 5.熟悉镉的重要化合物的性质。 6.熟悉汞的重要化合物的性质,掌握 Hg(I)和Hg(Ⅱ)间的相互转化,熟悉水 溶液中Hg2,Hg22的重要反应。 十八、f区元素 1.了解镧系元素核外电子排布特点、稀土 18.1镧系元素 元素及其重要化合物的特点。 10 2.了解锕系元素的通性,钍和铀的重要化 授课 1、2 合物。 3.了解核化学的概念。 合计 40 五、参考资料 8
8 3. 掌握氯的含氧酸及其盐的性质(酸性、 氧化还原性、热稳定性)及其变化规律。 熟悉溴、碘的含氧酸的基本性质。 4. 了解稀有气体的重要性质及其变化规律、 稀有气体化合物及其几何构型。 8 十六、d 区元素(一) 16.1 d 区元素概述 16.2 钛 钒 16.3 铬 钼 钨 多酸 型配合物 16.4 锰族元素 16.5 铁 钴 镍 1. 了解 d 区元素通性,掌握铬、锰、铁、钴、 镍及其化合物的性质。 2. 熟悉 Cr( Ⅲ ) 氧化物、氢氧化物的溶解 性和两性,了解 Cr( Ⅲ ) 在碱性介质中的 还原性,理解 Cr( Ⅵ ) 在酸碱介质中的存 在形态及相互变化,掌握 Cr( Ⅵ ) 在酸性 介质中的氧化性。 3. 了解 Mn( ⅡⅣⅥⅦ ) 的重要化合物,理 解 Mn 的元素电势图,掌握 KMnO4 在不同介 质中的氧化性及还原产物。 4. 了解 Fe( ⅡⅢ )、Co( Ⅱ )、Ni( Ⅱ ) 的 重要化合物及配合物的性质。 4 授课 1、2 9 十七、d 区元素(二) 17.1 铜族元素 17.2 锌族元素 1. 了解铜族元素的通性。 2. 掌握铜的氧化物、氢氧化物、重要铜盐 的性质,Cu( Ⅰ ) 和 Cu( Ⅱ ) 的相互转化, 铜的重要配合物,水溶液中 Cu2+ 的重要反 应。 3. 熟悉银的氧化物、氢氧化物的性质,了 解银的重要配合物,掌握水溶液中 Ag+ 的重 要反应。 4. 了解锌族元素的通性,熟悉锌的重要配 合物,掌握氢氧化锌的性质、水溶液中 Zn2+ 的重要反应。 5. 熟悉镉的重要化合物的性质。 6. 熟悉汞的重要化合物的性质,掌握 Hg( Ⅰ ) 和 Hg( Ⅱ ) 间的相互转化,熟悉水 溶液中 Hg2+,Hg22+ 的重要反应。 4 授课 1、2 10 十八、f 区元素 18.1 镧系元素 1. 了解镧系元素核外电子排布特点、稀土 元素及其重要化合物的特点。 2. 了解锕系元素的通性,钍和铀的重要化 合物。 3. 了解核化学的概念。 2 授课 1、2 合计 40 五、参考资料