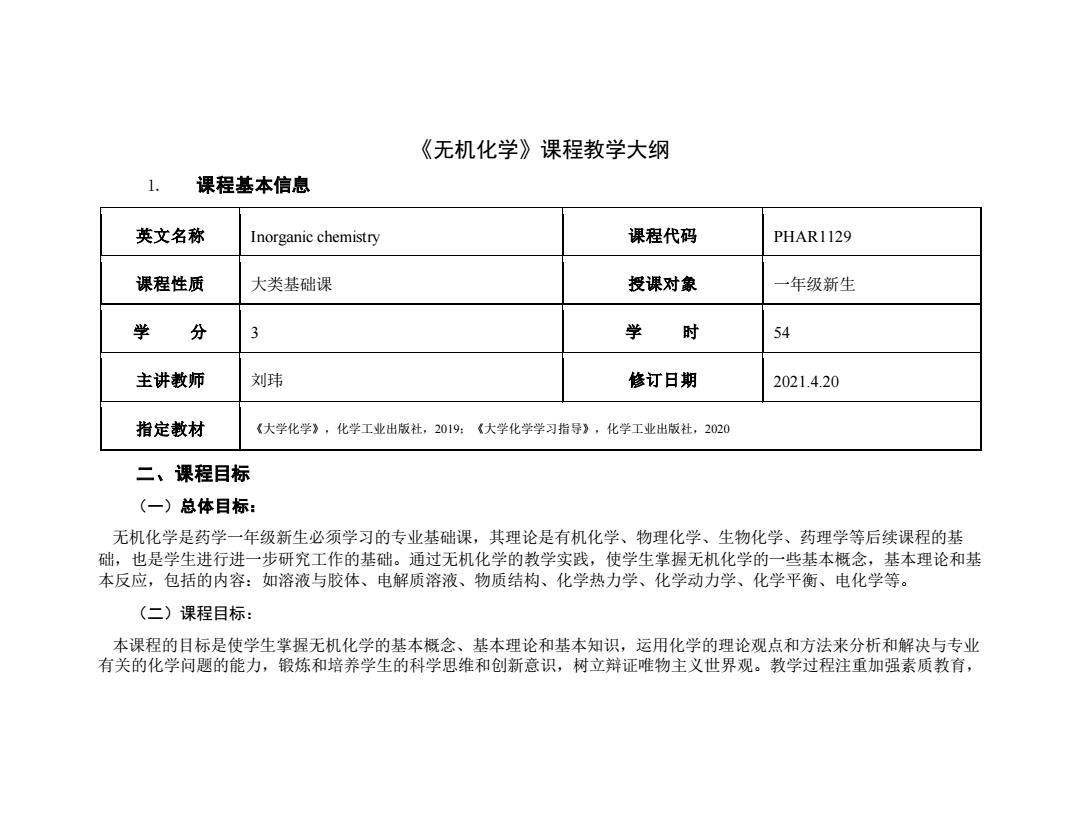
《无机化学》课程教学大纲 1.课程基本信息 英文名称 Inorganic chemistry 课程代码 PHAR1129 课程性质 大类基础课 授课对象 一年级新生 学 分 3 学 时 54 主讲教师 刘玮 修订日期 2021.4.20 指定教材 《大学化学》,化学工业出版社,2019:《大学化学学习指导》,化学工业出版社,2020 二、课程目标 (一)总体目标: 无机化学是药学一年级新生必须学习的专业基础课,其理论是有机化学、物理化学、生物化学、药理学等后续课程的基 础,也是学生进行进一步研究工作的基础。通过无机化学的教学实践,使学生掌握无机化学的一些基本概念,基本理论和基 本反应,包括的内容:如溶液与胶体、电解质溶液、物质结构、化学热力学、化学动力学、化学平衡、电化学等。 (二)课程目标: 本课程的目标是使学生掌握无机化学的基本概念、基本理论和基本知识,运用化学的理论观点和方法来分析和解决与专业 有关的化学问题的能力,锻炼和培养学生的科学思维和创新意识,树立辩证唯物主义世界观。教学过程注重加强素质教育
《无机化学》课程教学大纲 1. 课程基本信息 英文名称 Inorganic chemistry 课程代码 PHAR1129 课程性质 大类基础课 授课对象 一年级新生 学 分 3 学 时 54 主讲教师 刘玮 修订日期 2021.4.20 指定教材 《大学化学》,化学工业出版社,2019;《大学化学学习指导》,化学工业出版社,2020 二、课程目标 (一)总体目标: 无机化学是药学一年级新生必须学习的专业基础课,其理论是有机化学、物理化学、生物化学、药理学等后续课程的基 础,也是学生进行进一步研究工作的基础。通过无机化学的教学实践,使学生掌握无机化学的一些基本概念,基本理论和基 本反应,包括的内容:如溶液与胶体、电解质溶液、物质结构、化学热力学、化学动力学、化学平衡、电化学等。 (二)课程目标: 本课程的目标是使学生掌握无机化学的基本概念、基本理论和基本知识,运用化学的理论观点和方法来分析和解决与专业 有关的化学问题的能力,锻炼和培养学生的科学思维和创新意识,树立辩证唯物主义世界观。教学过程注重加强素质教育

培养学生自主学习能力、合作能力、创新能力和知识应用能力:培养学生正确的学习观、世界观、人生观和价值观,通过 “产学研用”理论联系实际,激发学生自主学习热情。通过对课堂概念的深入讨论,提升知识点的高阶性。 课程目标1:理论基础 1.1.为后续有机化学、物理化学、生物化学、药理学等课程的打好基础。 1.2.打好进行进一步研究工作的基础。 课程目标2:能力目标 2.1使学生掌握无机化学的基本概念、基本理论和基本知识,运用化学的理论观点和方法来分析和解决与药学专业有关 的化学问题的能力。 2.2锻炼和培养学生的科学思维和创新意识,树立辩证唯物主义世界观。 课程目标3:情感目标 3.1提高学生整体素质,培养学生自主学习能力、合作能力、创新能力和知识应用能力。 3.2培养学生正确的学习观、世界观、人生观和价值观。 3.3通过“产学研用”理论联系实际,激发学生自主学习热情。 (三)课程目标与毕业要求、课程内容的对应关系 表1:课程目标与课程内容、毕业要求的对应关系表 课程目标 课程子目标 对应课程内容 对应毕业要求 课程目标1 1.1 本课程1-9章内容 药学相关专业
培养学生自主学习能力、合作能力、创新能力和知识应用能力;培养学生正确的学习观、世界观、人生观和价值观,通过 “产学研用”理论联系实际,激发学生自主学习热情。通过对课堂概念的深入讨论,提升知识点的高阶性。 课程目标 1: 理论基础 1.1.为后续有机化学、物理化学、生物化学、药理学等课程的打好基础。 1.2.打好进行进一步研究工作的基础。 课程目标 2:能力目标 2.1 使学生掌握无机化学的基本概念、基本理论和基本知识,运用化学的理论观点和方法来分析和解决与药学专业有关 的化学问题的能力。 2.2 锻炼和培养学生的科学思维和创新意识,树立辩证唯物主义世界观。 课程目标 3:情感目标 3.1 提高学生整体素质,培养学生自主学习能力、合作能力、创新能力和知识应用能力。 3.2 培养学生正确的学习观、世界观、人生观和价值观。 3.3 通过“产学研用”理论联系实际,激发学生自主学习热情。 (三)课程目标与毕业要求、课程内容的对应关系 表 1:课程目标与课程内容、毕业要求的对应关系表 课程目标 课程子目标 对应课程内容 对应毕业要求 课程目标 1 1.1 本课程 1-9 章内容 药学相关专业
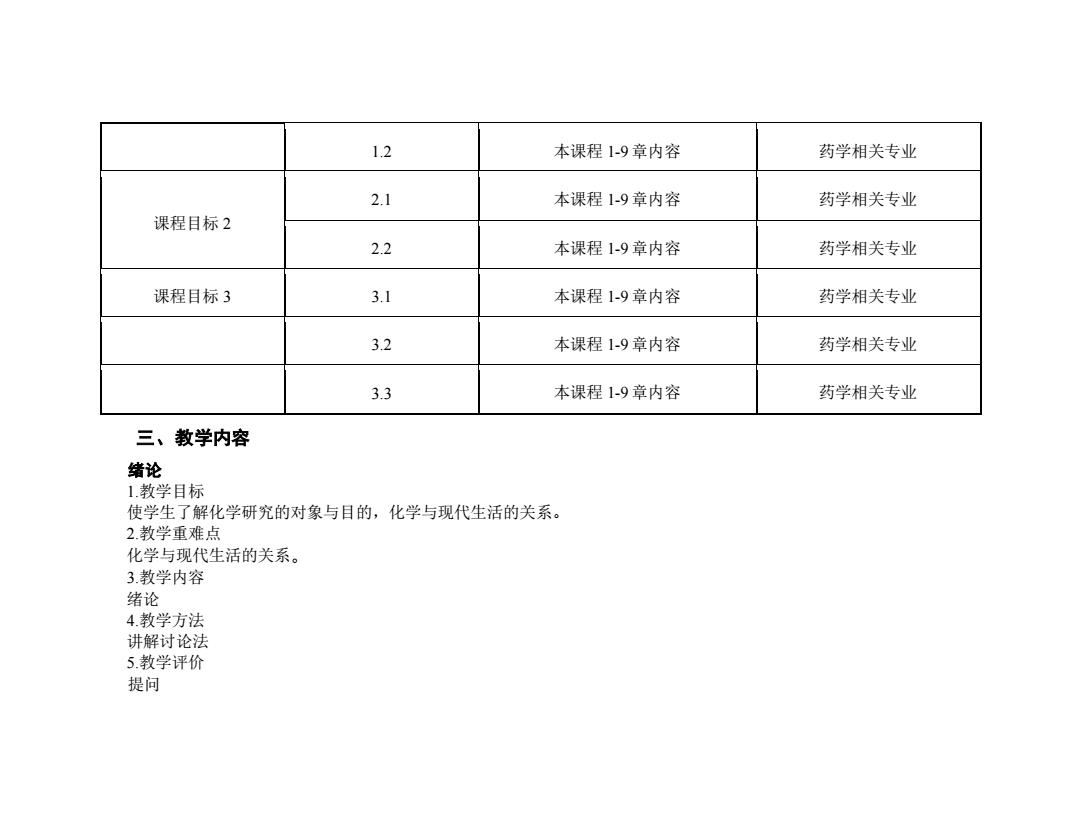
1.2 本课程1-9章内容 药学相关专业 2.1 本课程1-9章内容 药学相关专业 课程目标2 2.2 本课程1-9章内容 药学相关专业 课程目标3 3.1 本课程1-9章内容 药学相关专业 3.2 本课程1-9章内容 药学相关专业 3.3 本课程1-9章内容 药学相关专业 三、教学内容 绪论 1.教学目标 使学生了解化学研究的对象与目的,化学与现代生活的关系。 2.教学重难点 化学与现代生活的关系。 3教学内容 绪论 4.教学方法 讲解讨论法 5.教学评价 提问
1.2 本课程 1-9 章内容 药学相关专业 课程目标 2 2.1 本课程 1-9 章内容 药学相关专业 2.2 本课程 1-9 章内容 药学相关专业 课程目标 3 3.1 本课程 1-9 章内容 药学相关专业 3.2 本课程 1-9 章内容 药学相关专业 3.3 本课程 1-9 章内容 药学相关专业 三、教学内容 绪论 1.教学目标 使学生了解化学研究的对象与目的,化学与现代生活的关系。 2.教学重难点 化学与现代生活的关系。 3.教学内容 绪论 4.教学方法 讲解讨论法 5.教学评价 提问

1. 气体与溶液 1.教学目标 了解分散系的分类,掌握溶液组成标度的表示法其计算。熟悉稀溶液的蒸气压下降、溶液的沸点升高、凝固点降低和渗 透压等依数性。了解晶体渗透压和胶体渗透压。熟悉溶液的蒸气压下降,溶液的沸点升高,溶胶的性质。 2.教学重难点 溶液组成标度的概念。稀溶液的蒸气压下降、溶液的沸点升高、凝固点降低和渗透压的概念及计算。 3.教学内容 第一节气体 第二节分散系 第三节溶液组成的标度 第四节稀溶液的依数性 4.教学方法 翻转课堂分组讨论、讲解法 5.教学评价 分组比赛、慕课堂作业、课后作业、思维导图等。 第二章化学热力学基础 1教学目标 掌握状态函数等基本概念。掌握用自由能变来判断化学反应的方法。掌握热力学能(内能)、焓、熵和吉布斯自由能 等概念。掌握盖斯定律及其计算,利用生成焓计算反应焓的方法。 理解热力学第一定律、热力学第二定律。 熟悉标准平衡常数的表示方法及其与标准吉布斯自由能的关系,化学平衡的有关计算、化学平衡的移动。熟悉燃烧焓计 算反应焓的方法。 了解化学反应等温方程,熵值大小的比较、实验平衡常数。 2.教学重难点 化学反应的标准摩尔焓变、标准摩尔熵变和标准摩尔吉布斯自由能变等基本概念及其计算方法和判断。标准平衡常数及化学 平衡的移动。 3.教学内容
1. 气体与溶液 1.教学目标 了解分散系的分类,掌握溶液组成标度的表示法其计算。熟悉稀溶液的蒸气压下降、溶液的沸点升高、凝固点降低和渗 透压等依数性。了解晶体渗透压和胶体渗透压。熟悉溶液的蒸气压下降,溶液的沸点升高,溶胶的性质。 2.教学重难点 溶液组成标度的概念。稀溶液的蒸气压下降、溶液的沸点升高、凝固点降低和渗透压的概念及计算。 3.教学内容 第一节 气体 第二节 分散系 第三节 溶液组成的标度 第四节 稀溶液的依数性 4.教学方法 翻转课堂分组讨论、讲解法 5.教学评价 分组比赛、慕课堂作业、课后作业、思维导图等。 第二章 化学热力学基础 1.教学目标 掌握状态函数等基本概念。掌握用自由能变来判断化学反应的方法。掌握热力学能(内能)、焓、熵和吉布斯自由能 等概念。掌握盖斯定律及其计算,利用生成焓计算反应焓的方法。 理解热力学第一定律、热力学第二定律。 熟悉标准平衡常数的表示方法及其与标准吉布斯自由能的关系,化学平衡的有关计算、化学平衡的移动。熟悉燃烧焓计 算反应焓的方法。 了解化学反应等温方程,熵值大小的比较、实验平衡常数。 2.教学重难点 化学反应的标准摩尔焓变、标准摩尔熵变和标准摩尔吉布斯自由能变等基本概念及其计算方法和判断。标准平衡常数及化学 平衡的移动。 3.教学内容

第一节基本概念及术语 第二节热力学第一定律 第三节热化学 第四节热力学第二定律 第五节吉布斯函数及应用 第六节化学平衡 第七节化学平衡的移动 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第三章化学动力学基础 1.教学目标 掌握浓度对反应速率的因素,速率常数,一级、二级和零级反应特征及有关计算、质量作用定律,基元反应概念,反应 级数,温度对速率的影响。 熟悉化学反应速度的表示方法、催化剂对速率的影响、活化能与活化分子概念。 了解速率理论。 2.教学重难点 化学反应速率的表示。质量作用定律和零级、一级、二级反应的特征。浓度、温度对化学反应速率的影响。 3.教学内容 第一节化学反应速率的表示法 第二节反应速率理论简介 第三节浓度对化学反应速率的影响 第四节温度对化学反应速率的影响 第五节催化剂对化学反应速率的影响 4.教学方法 分组讨论、讲解法
第一节 基本概念及术语 第二节 热力学第一定律 第三节 热化学 第四节 热力学第二定律 第五节 吉布斯函数及应用 第六节 化学平衡 第七节 化学平衡的移动 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第三章 化学动力学基础 1.教学目标 掌握浓度对反应速率的因素,速率常数,一级、二级和零级反应特征及有关计算、质量作用定律,基元反应概念,反应 级数,温度对速率的影响。 熟悉化学反应速度的表示方法、催化剂对速率的影响、活化能与活化分子概念。 了解速率理论。 2.教学重难点 化学反应速率的表示。质量作用定律和零级、一级、二级反应的特征。浓度、温度对化学反应速率的影响。 3.教学内容 第一节 化学反应速率的表示法 第二节 反应速率理论简介 第三节 浓度对化学反应速率的影响 第四节 温度对化学反应速率的影响 第五节 催化剂对化学反应速率的影响 4.教学方法 分组讨论、讲解法

5.教学评价 慕课堂作业、课后作业、思维导图等。 第四章原子结构 1.教学目标 掌握四个量子数及其表达的核外电子的运动状态。 理解原子核外电子运动的特点(量子化和波粒二象性),波函数和原子轨道的含义,几率密度中和电子云,氢质子的S、 P、d波函数的角度分布及电子云图形,屏蔽效应,钻穿效应,多电子原子的能级。 熟悉原子核外电子的运动规律和排布规律,pauli不相客原理,能量最低原理,Hud规则,原子的电子构型和元素周期 表,电子构型与元素某些性质(原子半径、电离能、电子亲和能、电负性)的周期性。 2.教学重难点 波粒二象性。四个量子数的物理意义、取值和光谱符号。 原子核外电子的排布式。原子结构和元素周期表的关系、电负性的概念。 3.教学内容 第一节原子核外电子运动特征 第二节氢原子核外电子运动状态 第三节多电子原子核外电子运动状态 第四节原子结构与元素周期性 4.教学方法 分组讨论、讲解法 5.教学评价 选择题竞赛、幕课堂作业、课后作业、思维导图等。 第五章分子结构 1.教学目标 掌握价键理论和杂化轨道理论、分子轨道理论的基本要点 理解键的极性与分子的极性、分子的空间构型、氢键的概念、特性、种类及其对物质性质的影响、氢键在生命科学中的 重要意义。 2.教学重难点
5.教学评价 慕课堂作业、课后作业、思维导图等。 第四章 原子结构 1.教学目标 掌握四个量子数及其表达的核外电子的运动状态。 理解原子核外电子运动的特点(量子化和波粒二象性),波函数和原子轨道的含义,几率密度中和电子云,氢质子的 s、 p、d 波函数的角度分布及电子云图形,屏蔽效应,钻穿效应,多电子原子的能级。 熟悉原子核外电子的运动规律和排布规律,pauli不相客原理,能量最低原理,Hund 规则,原子的电子构型和元素周期 表,电子构型与元素某些性质(原子半径、电离能、电子亲和能、电负性)的周期性。 2.教学重难点 波粒二象性。四个量子数的物理意义、取值和光谱符号。 原子核外电子的排布式。原子结构和元素周期表的关系、电负性的概念。 3.教学内容 第一节 原子核外电子运动特征 第二节 氢原子核外电子运动状态 第三节 多电子原子核外电子运动状态 第四节 原子结构与元素周期性 4.教学方法 分组讨论、讲解法 5.教学评价 选择题竞赛、慕课堂作业、课后作业、思维导图等。 第五章 分子结构 1.教学目标 掌握价键理论和杂化轨道理论、分子轨道理论的基本要点 理解键的极性与分子的极性、分子的空间构型、氢键的概念、特性、种类及其对物质性质的影响、氢键在生命科学中的 重要意义。 2.教学重难点

共价键的类型(σ键,π键)、共价键的特性、杂化轨道理论特点,s即,Sp,sp杂化以及等性和不等性杂化、分子轨道能级 图等。 3教学内容 第一节离子键 第二节共价键 第三节金属键 第四节分子间力和氢键 第五节晶体结构 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第六章酸碱平衡 1教学目标 掌握酸碱质子理论的基本内容及应用,缓冲溶液的组成和作用原理,掌握一元弱酸、弱碱H浓度和pH值计算以及缓冲 溶液pH值计算。 熟悉同离子效应,多元弱酸、弱碱的H+浓度计算,缓冲溶液的配制方法,缓冲容量的概念及缓冲容量与总浓度、缓冲 比的关系。 了解电解质溶液表观解离度、活度、活度系数、离子强度、盐效应、缓冲溶液H值校正等概念,了解缓冲容量的计 算。 2.教学重难点 一元、多元酸碱pH值计算、缓冲溶液pH值计算 3.教学内容 第一节强电解质溶液理论 第二节酸碱质子论 第三节水溶液中的酸碱平衡 第四节质子转移平衡有关计算
共价键的类型(σ 键,π 键)、共价键的特性、杂化轨道理论特点,sp,sp2 ,sp3杂化以及等性和不等性杂化、分子轨道能级 图等。 3.教学内容 第一节 离子键 第二节 共价键 第三节 金属键 第四节 分子间力和氢键 第五节 晶体结构 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第六章 酸碱平衡 1.教学目标 掌握酸碱质子理论的基本内容及应用,缓冲溶液的组成和作用原理,掌握一元弱酸、弱碱 H+浓度和 pH 值计算以及缓冲 溶液 pH 值计算。 熟悉同离子效应,多元弱酸、弱碱的 H+浓度计算,缓冲溶液的配制方法,缓冲容量的概念及缓冲容量与总浓度、缓冲 比的关系。 了解电解质溶液表观解离度、活度、活度系数、离子强度、盐效应、缓冲溶液 pH 值校正等概念,了解缓冲容量的计 算。 2.教学重难点 一元、多元酸碱 pH 值计算、缓冲溶液 pH 值计算 3.教学内容 第一节 强电解质溶液理论 第二节 酸碱质子论 第三节 水溶液中的酸碱平衡 第四节 质子转移平衡有关计算

第五节缓冲溶液 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第七章沉淀溶解平衡 1.教学目标 掌握难溶强电解质的沉淀溶解平衡及表达式。 熟悉溶度积与溶解度的换算溶度积规则及应用利用溶度积规则讨论沉淀的生成与溶解。 2.教学重难点 沉淀的生成与溶解的相关计算 3教学内容 第一节溶度积 第二节沉淀溶解平衡的移动 分组讨论 5.教学评价 慕课堂作业、课后作业 第八章配位化合物与配位平衡 1.教学目标 掌握配位化合物的定义、组成、类型和命名,配位平衡的概念,配位平衡常数和配位平衡的移动,酸度、沉淀平衡和氧 化还原平衡对配位平衡的影响,其他配位平衡的影响及有关计算。 熟悉常见螯合物,配合物价键理论的要点、配合物的杂化轨道和配合物的空间构型,内轨配合物和外轨配合物,磁矩及 其在判断配合物的杂化类型和空间构型中的应用,晶体场理论的基本要点及其在解释配合物性质上应用,螯合效应及影响螯 合物稳定性的因素。 2.教学重难点 内、外轨杂化、晶体场理论基本要点以及配位平衡的移动相关计算 3.教学内容
第五节 缓冲溶液 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第七章 沉淀溶解平衡 1.教学目标 掌握难溶强电解质的沉淀溶解平衡及表达式。 熟悉溶度积与溶解度的换算 溶度积规则及应用利用溶度积规则讨论沉淀的生成与溶解。 2.教学重难点 沉淀的生成与溶解的相关计算 3.教学内容 第一节 溶度积 第二节 沉淀溶解平衡的移动 分组讨论 5.教学评价 慕课堂作业、课后作业。 第八章 配位化合物与配位平衡 1.教学目标 掌握配位化合物的定义、组成、类型和命名,配位平衡的概念,配位平衡常数和配位平衡的移动,酸度、沉淀平衡和氧 化还原平衡对配位平衡的影响,其他配位平衡的影响及有关计算。 熟悉常见螯合物,配合物价键理论的要点、配合物的杂化轨道和配合物的空间构型,内轨配合物和外轨配合物,磁矩及 其在判断配合物的杂化类型和空间构型中的应用,晶体场理论的基本要点及其在解释配合物性质上应用,螯合效应及影响螯 合物稳定性的因素。 2.教学重难点 内、外轨杂化、晶体场理论基本要点以及配位平衡的移动相关计算 3.教学内容

第一节配合物的一些基本概念 第二节化学键理论 第三节配位解离平衡 第四节螯合物 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第九章氧化还原反应与氯化还原平衡 1.教学目标 掌握氧化还原反应的基本概念,标准电极电势表的使用,能斯特方程式及有关计算,电极电势在判断反应方向和限度方 面的应用,离子电子法配平氧化还原反应。 熟悉原电池的组成及表示方法,氧化数的概念,元素电势图及其应用。 了解氧化数法配平氧化还原反应电极电势的产生原理和测量,能斯特方程的推导。 2.教学重难点 标准电极电势、能斯特方程式相关计算在判断反应方向和限度方面的应用。 3教学内容 第一节氧化还原基本概念 第二节氧化还原方程式配平 第三节原电池 第四节电极电势以及电池电动势 第五节能斯特方程 第六节电极电势以及电池电动势的应用 第七节元素电势图及应用 4.教学方法 分组讨论、讲解法 5.教学评价
第一节 配合物的一些基本概念 第二节 化学键理论 第三节 配位解离平衡 第四节 螯合物 4.教学方法 分组讨论、讲解法 5.教学评价 慕课堂作业、课后作业、思维导图等。 第九章 氧化还原反应与氧化还原平衡 1.教学目标 掌握氧化还原反应的基本概念,标准电极电势表的使用,能斯特方程式及有关计算,电极电势在判断反应方向和限度方 面的应用,离子电子法配平氧化还原反应。 熟悉原电池的组成及表示方法,氧化数的概念,元素电势图及其应用。 了解氧化数法配平氧化还原反应 电极电势的产生原理和测量,能斯特方程的推导。 2.教学重难点 标准电极电势、能斯特方程式相关计算在判断反应方向和限度方面的应用。 3.教学内容 第一节 氧化还原基本概念 第二节 氧化还原方程式配平 第三节 原电池 第四节 电极电势以及电池电动势 第五节 能斯特方程 第六节 电极电势以及电池电动势的应用 第七节 元素电势图及应用 4.教学方法 分组讨论、讲解法 5.教学评价
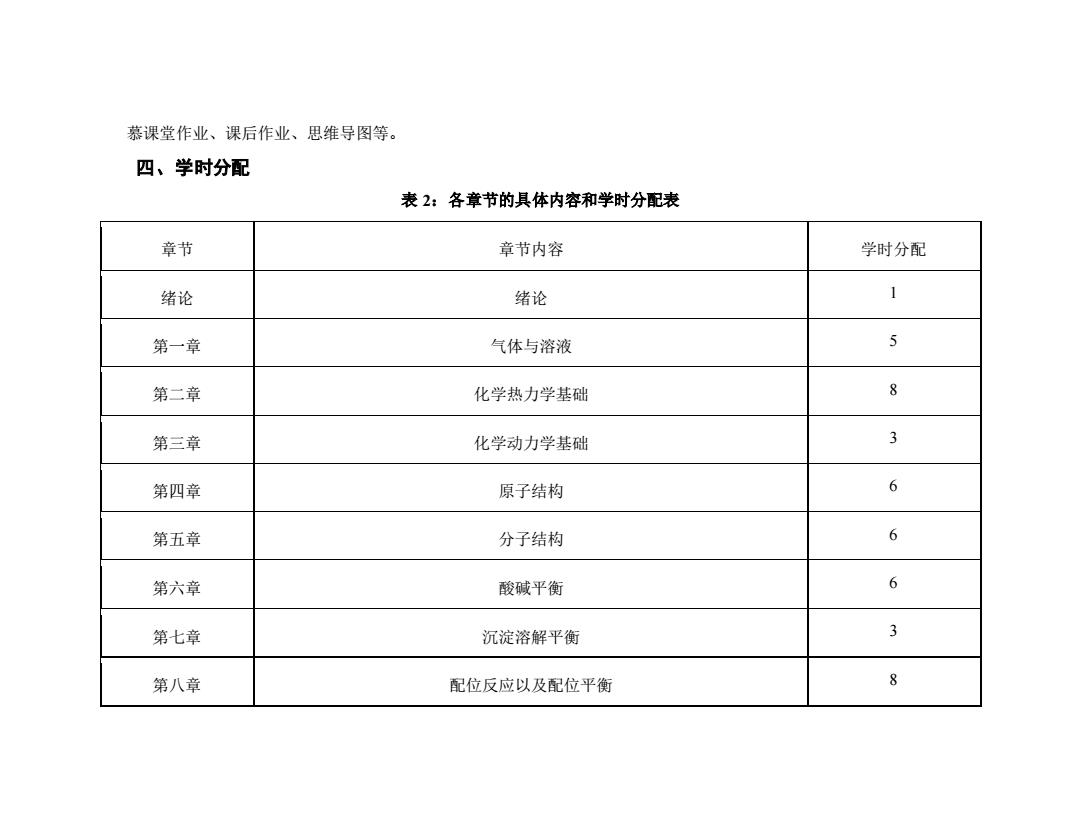
慕课堂作业、课后作业、思维导图等。 四、学时分配 表2:各章节的具体内容和学时分配表 章节 章节内容 学时分配 绪论 绪论 1 第一章 气体与溶液 5 第二章 化学热力学基础 8 第三章 化学动力学基础 3 第四章 原子结构 6 第五章 分子结构 6 第六章 酸碱平衡 第七章 沉淀溶解平衡 3 第八章 配位反应以及配位平衡 8
慕课堂作业、课后作业、思维导图等。 四、学时分配 表 2:各章节的具体内容和学时分配表 章节 章节内容 学时分配 绪论 绪论 1 第一章 气体与溶液 5 第二章 化学热力学基础 8 第三章 化学动力学基础 3 第四章 原子结构 6 第五章 分子结构 6 第六章 酸碱平衡 6 第七章 沉淀溶解平衡 3 第八章 配位反应以及配位平衡 8