
第一章原子模型初探 1.1原子论及原子的一般特性 1.2电子的发现和汤姆逊的原子模型 1.3 α粒子散射实验和卢瑟福原子模型 1.4玻尔原子模型 1.5类氢原子体系 1.6弗兰克-赫兹实验
第一章 原子模型初探 1.1 原子论及原子的一般特性 1.2 电子的发现和汤姆逊的原子模型 1.3 粒子散射实验和卢瑟福原子模型 1.4 玻尔原子模型 1.5 类氢原子体系 1.6 弗兰克-赫兹实验

1.1原子论及原子的一般特性 1.1.1原子论的发展历史 一、中国古代的原子论 原子论: √《尚书》 (前1046-前771年) :“五行说” 老子(约前571-471)《道德经》:“道生一,一生二,二生三,三 生万物” 墨子(约前468-376):“端,体之无序而最前者也”;“端,无间 也”;“非半弗著斤(kan)则不动,说在端” 子思(前483-402):“语小,天下莫能破焉” 惠施(前390-317):“至小无内,谓之小一” 无限可分: √公孙龙(前320-250):“一尺之捶,日取其半,万世不竭
1.1 原子论及原子的一般特性 1.1.1 原子论的发展历史 一、中国古代的原子论 《尚书》(前1046前771年) :“五行说” 老子(约前571471 ) 《道德经》:“道生一,一生二,二生三,三 生万物” 墨子(约前468376) :“端,体之无序而最前者也”;“端,无间 也”;“非半弗著斤(kan)则不动,说在端” 子思(前483402) :“语小,天下莫能破焉” 惠施(前390317) :“至小无内,谓之小一” 公孙龙(前320250):“一尺之捶,日取其半,万世不竭”。 原子论: 无限可分:

二、古希腊的原子论 原子论: √ 德谟克利特(约前460-371):一切物质都是由分立的原子组成,原 子这种微粒是不可再分的 无限可分: /亚里士多德(约前384-322):物质是连续的,是可以无限分割的。 三、近代 1806年,法国普鲁斯脱“定组成定律(定比定律)”:一种化合物, 不论它是如何制备的,其组成的元素间都有一定的质量比; 1807年,英国道尔顿“倍比定律”:在化学反应中,每种化合物都有 一定不变的组成,各化合物中元素的量都成一定的整数比; 1808年,道尔顿“原子论”:物质是由少数几种原子组成,同种元素 的原子都具有相同的质量和性质,不同元素原子的性质和质量各不相 同,且原子在一切化学变化中不可再分; 1808年,盖·吕萨克“简比定律”; 1811年,阿伏伽德罗定律; 1826年的布朗运动实验; 1833年法拉第提出的电解定律; 1869年门捷列夫的元素周期表.… 19世纪末,原子论被普遍接受!
德谟克利特(约前460371):一切物质都是由分立的原子组成,原 子这种微粒是不可再分的 亚里士多德(约前384322):物质是连续的,是可以无限分割的。 原子论: 无限可分: 二、古希腊的原子论 1806年,法国普鲁斯脱“定组成定律 (定比定律)”:一种化合物, 不论它是如何制备的,其组成的元素间都有一定的质量比; 1807年,英国道尔顿“倍比定律”:在化学反应中,每种化合物都有 一定不变的组成,各化合物中元素的量都成一定的整数比; 1808年,道尔顿“原子论”:物质是由少数几种原子组成,同种元素 的原子都具有相同的质量和性质,不同元素原子的性质和质量各不相 同,且原子在一切化学变化中不可再分; 1808年,盖吕萨克“简比定律” ; 1811年,阿伏伽德罗定律; 1826年的布朗运动实验; 1833年法拉第提出的电解定律; 1869年门捷列夫的元素周期表… 三、近代 19世纪末,原子论被普遍接受!

1.1.2原子的经典性质 食盐 ,) A m= NA Fe、Au、Ag、Cu的半径分别为1.56、1.74、1.65、1.45A。 原子量u:1u=1.66053873(13)×10-27kg。 原子的质量分布范围在1~300u
1.1.2 原子的经典性质 1/3 1 2 A A r N A A m N Fe、Au、Ag、Cu的半径分别为1.56、1.74、1.65、1.45Å。 原子量u: 1u=1.66053873(13)10-27kg。 原子的质量分布范围在1~300 u
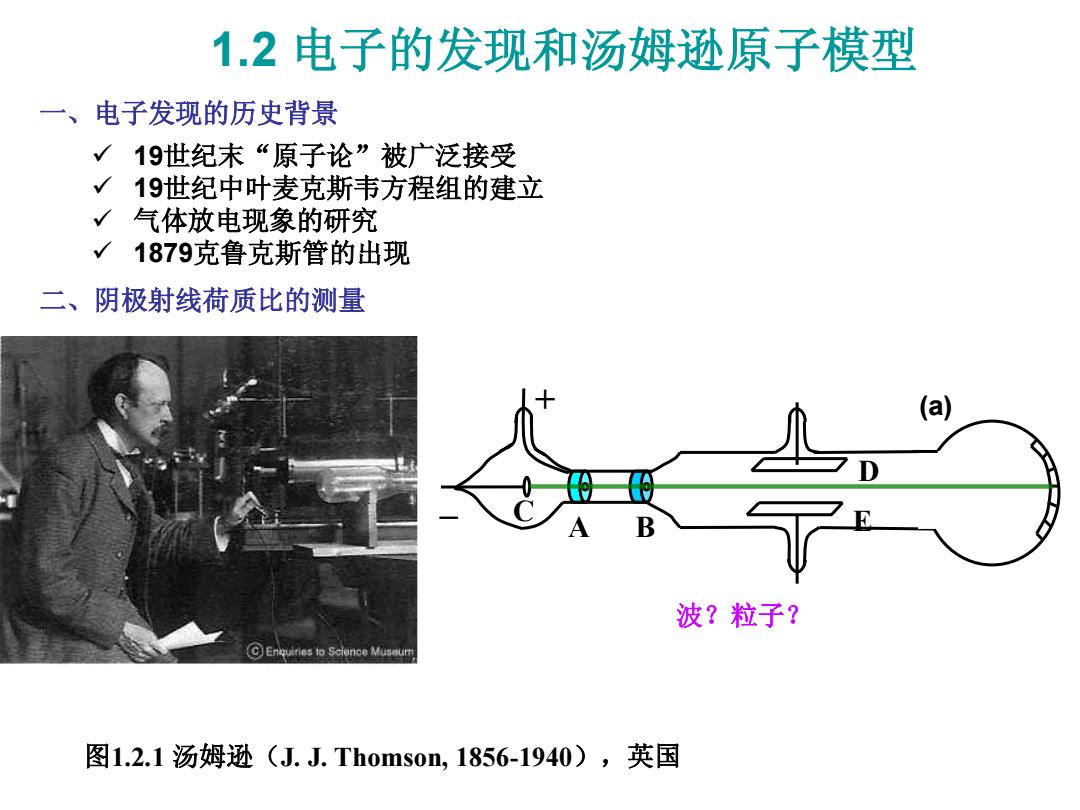
1.2电子的发现和汤姆逊原子模型 一、电子发现的历史背景 √19世纪末“原子论”被广泛接受 19世纪中叶麦克斯韦方程组的建立 √ 气体放电现象的研究 1879克鲁克斯管的出现 二、阴极射线荷质比的测量 (a) B 波?粒子? CEnquires to Science Museum 图1.2.1汤姆逊(J.J.Thoms0m,1856-1940),英国
1.2 电子的发现和汤姆逊原子模型 19世纪末“原子论”被广泛接受 19世纪中叶麦克斯韦方程组的建立 气体放电现象的研究 1879克鲁克斯管的出现 一、电子发现的历史背景 二、阴极射线荷质比的测量 + _ C A B D E (a) 图1.2.1 汤姆逊(J. J. Thomson, 1856-1940),英国 波?粒子?

y=y+y2 1 at"+attz 2 d2y qV1L-1/2 m VIL md U V qVIL dB mdv2 L (b) 荧光屏 9= yD m dlL B2 t 7.6×1010Ckg 阴极射线的电荷量是氢离子的1000倍; 阴极射线的质量是氢离子的千分之一 1.758820174×1011C/Kg 原子是可分的!
t1 t2 L l +_ y1 y2 y 荧光屏 m (b) t1 t2 L l +_ y1 y2 y 荧光屏 m (b) 1 2 2 1 1 22 2 12 1 / 2 2 y y y at at t qV l qV l L l md md qVlL md 2 q d y m VlL V dB 2 q V m dlLB y 7.6 1010C/kg 1.758820174 1011C/kg 阴极射线的电荷量是氢离子的1000倍; 阴极射线的质量是氢离子的千分之一 原子是可分的!

电子是否存在于所有原子中呢? √把阴极射线管充上不同的微量气体,例如二氧化碳、空气、氢气等,发现: 阴极射线的荷质比与所充气体无关。 /改变阴极的材料,分别改用铝、铁、铜等做阴极,发现: 阴极射线的荷质比与阴极材料无关。 极射线这种粒子!→ 电子 2的1000倍。 测量出阴极射线所带的电荷与氢离子所带的电荷 淮一的一个可能的漏洞!完美的实验! DAT ANG.NET 由乙 威尔逊,1927诺贝尔物理奖 问题: 电子和正电荷部分如何构成原子? 正电荷 汤姆逊原子模型 电中性、原子大小、稳定性、部分光谱 图1.2.3汤姆逊的原子模型
把阴极射线管充上不同的微量气体,例如二氧化碳、空气、氢气等,发现: 阴极射线的荷质比与所充气体无关。 改变阴极的材料,分别改用铝、铁、铜等做阴极,发现: 阴极射线的荷质比与阴极材料无关。 意味着所有原子中都有阴极射线这种粒子! 唯一的漏洞: 阴极射线的电荷量可能是氢离子的1000倍。 测量? 1899年,汤姆逊用威尔逊云室,测量出阴极射线所带的电荷与氢离子所带的电荷 相同。 图1.2.3 汤姆逊的原子模型 堵住了唯一的一个可能的漏洞!完美的实验! 问题: 电子和正电荷部分如何构成原子? 汤姆逊原子模型 电中性、原子大小、稳定性、部分光谱 电子是否存在于所有原子中呢? 电子 威尔逊,1927诺贝尔物理奖

成功原因: 承认阴极射线是粒子 历史条件具备:真空技术的发展 √ 敢于突破旧观念的束缚 不断进取(改变气体、阴极材料、测出电子电荷) 电子发现的过程: 放电实验 实验 新问题 发现问题:阴极射线的本质? 分析 提出假说: 阴极射线是粒子 假说 实验证实:测量荷质比 新实验 验证假说 验证假说 1 新问题:电子普遍存在? 理论 新实验: 验证假说 理论
承认阴极射线是粒子 历史条件具备:真空技术的发展 敢于突破旧观念的束缚 不断进取(改变气体、阴极材料、测出电子电荷) 成功原因: 电子发现的过程: 放电实验 发现问题:阴极射线的本质? 提出假说:阴极射线是粒子 实验证实:测量荷质比 验证假说 新问题:电子普遍存在? 新实验:验证假说 理论 实验 新问题 分析 假说 新实验 验证假说 理论

问题: 实验显示,每一个原子都有非常多的光谱线,而不是有限的几条! 汤姆逊原子模型在当时获得了广泛的认 The Nobel Prize in Physics 1906 "in recognition of the great merits of his theoretical and experimental investigations on the conduction of electricity by gases" 学生: 卢瑟福(1908年诺贝尔化学奖) 威尔逊(1927年诺贝尔物理奖) 汤姆逊(G.P.Thomson,1937年诺贝尔物理) 电子透过多晶金箔的衍射图
实验显示,每一个原子都有非常多的光谱线,而不是有限的几条! 问题: 汤姆逊原子模型在当时获得了广泛的认可! The Nobel Prize in Physics 1906 "in recognition of the great merits of his theoretical and experimental investigations on the conduction of electricity by gases" 学生: 卢瑟福(1908年诺贝尔化学奖) 威尔逊(1927年诺贝尔物理奖) 汤姆逊(G. P. Thomson, 1937年诺贝尔物理)

1.30粒子散射实验和卢瑟福原子模型 粒子散射实验的历史背景 √汤姆逊原子模型被广泛接受 √放射性的发现 1.3.1粒子散射实验 卢瑟福(E.Rutherford, 1871-1937),新西兰 Q粒子束 荧光屏 显微镜 放射源 金箔 √绝大多数粒子经过金属箔的散射 后,只有很小角度的偏转,偏转 角度小于2° √有大约1/8000的粒子的散射角 度大于90°
放射源 金箔 1.3 粒子散射实验和卢瑟福原子模型 汤姆逊原子模型被广泛接受 放射性的发现 粒子散射实验的历史背景 1.3.1 粒子散射实验 卢瑟福(E. Rutherford, 1871-1937),新西兰 绝大多数粒子经过金属箔的散射 后,只有很小角度的偏转,偏转 角度小于2; 有大约1/8000的粒子的散射角 度大于90