
《鱼类生理学》实验教学大纲 1.实验课程号:20453B1sy 2,课程属性: 3.实验属性:非独立设课 4.学时:总学时:60、总学分:35、实验学时:20 5.实验应开学期:春季 6.先修课程:动物学、鱼类学、动物解剖与组织胚胎学、动物生物化学 7,适用专业:水产养殖、水族科学与技术 一、课程的性质与任务 《鱼类生理学实验》是与《鱼类生理学》相配套的专业基础课,与理论课既互为补充.又 相对独立。鱼类生理学实验课的任务是 1,通过经典实验对学生进行《鱼类生理学》实验基本技能训练: 2,通过基础性、验证性和综合性实验,达到训练学生的动手能力、观察、分析问题和归 纳能力: 3.通过设计性实验培养学生的创新精神、严谨治学和团队精神,以提高学生的综合素 质;为后续课程学习打下坚实的基础。 二、实验的目的与基本要求 1.掌握鱼类生理实验常规仪器和基本实验技术的操作。 2掌握鱼类生理学实验常用标本的制备和某些生理指标测定的方法。 3掌握实验项目的基本原理,学会结果分析与归纳,并能正确写出实验报告。 4.通过实验学习和掌握鱼类生理学的理论。 5.学习和了解鱼类生理学研究性实验设计的基本方法和原则。并能独立进行实验。 三、实验考核方式及办法 实验课成绩占总成绩的30%。实验课考核、评估的项目包括上课次数、上课纪律、实验态 度、回答问题情况、动手能力、技能掌握情况、协作精神、实验结果、实验报告、讨论发 言、打扫卫生及安全保护等。根据综合评定给出优、良、中、及格和不及格五等,并在鱼 类生理学成绩总评时折合成相应的分数。 四、实验项目一览表
《鱼类生理学》实验教学大纲 1.实验课程号:20453B1sy 2.课程属性: 3.实验属性:非独立设课 4.学时:总学时:60、总学分:3.5、实验学时:20 5.实验应开学期:春季 6.先修课程:动物学、鱼类学、动物解剖与组织胚胎学、动物生物化学 7.适用专业:水产养殖、水族科学与技术 一、课程的性质与任务 《鱼类生理学实验》是与《鱼类生理学》相配套的专业基础课,与理论课既互为补充,又 相对独立。鱼类生理学实验课的任务是: 1.通过经典实验对学生进行《鱼类生理学》实验基本技能训练; 2.通过基础性、验证性和综合性实验,达到训练学生的动手能力、观察、分析问题和归 纳能力; 3.通过设计性实验培养学生的创新精神、严谨治学和团队精神,以提高学生的综合素 质;为后续课程学习打下坚实的基础。 二、实验的目的与基本要求 1.掌握鱼类生理实验常规仪器和基本实验技术的操作。 2.掌握鱼类生理学实验常用标本的制备和某些生理指标测定的方法。 3.掌握实验项目的基本原理,学会结果分析与归纳,并能正确写出实验报告。 4.通过实验学习和掌握鱼类生理学的理论。 5.学习和了解鱼类生理学研究性实验设计的基本方法和原则,并能独立进行实验。 三、实验考核方式及办法 实验课成绩占总成绩的 30%。实验课考核、评估的项目包括上课次数、上课纪律、实验态 度、回答问题情况、动手能力、技能掌握情况、协作精神、实验结果、实验报告、讨论发 言、打扫卫生及安全保护等。根据综合评定给出优、良、中、及格和不及格五等,并在鱼 类生理学成绩总评时折合成相应的分数。 四、实验项目一览表
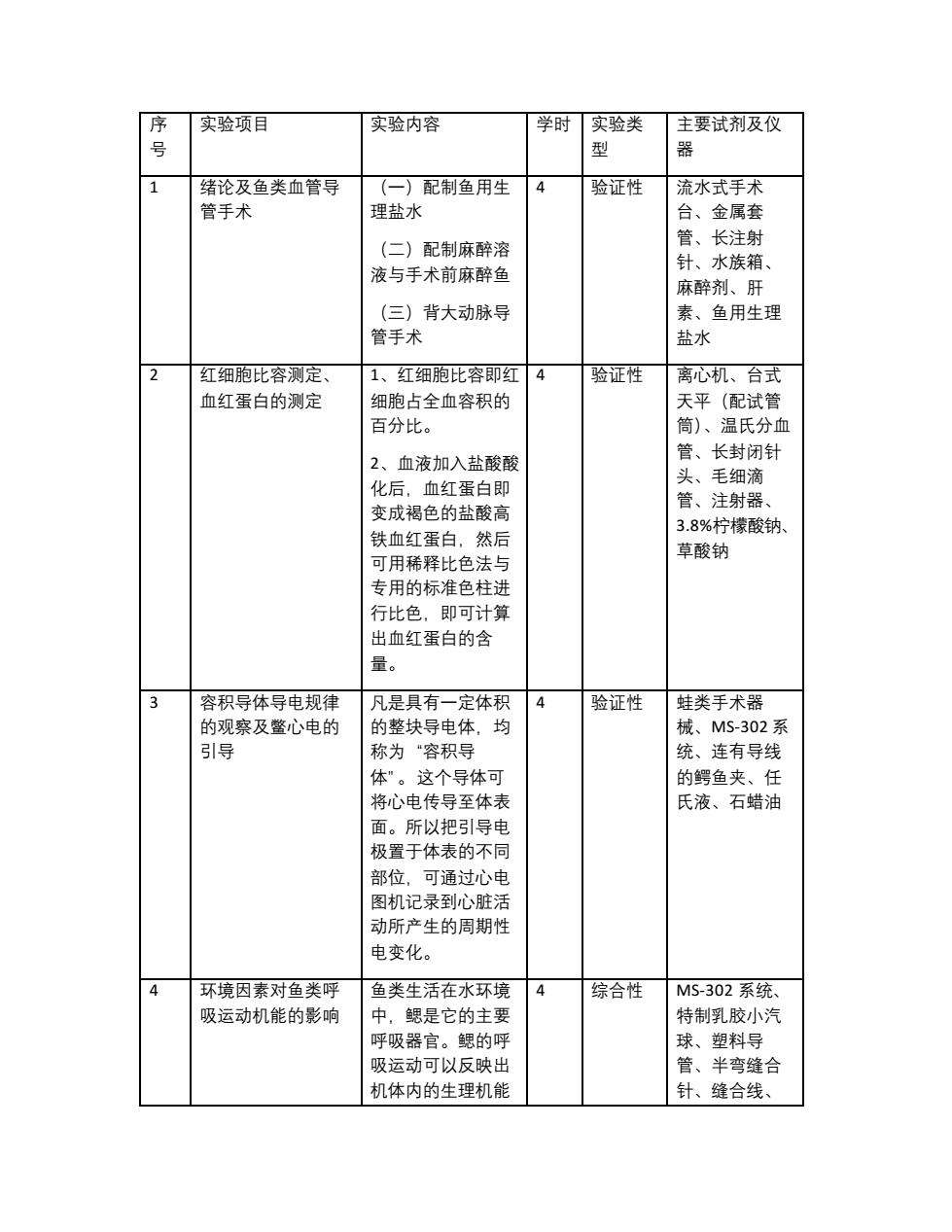
序 实验项目 实验内容 学时实验类 主要试剂及仪 1 绪论及鱼类血管导 (一)配制鱼用生 4 验证性 流水式手术 管手术 理盐水 台。金届查 (二)配制麻醉溶 管、长注射 针、水族箱 液与手术前麻醉鱼 麻醉剂、肝 (三)背大动脉导 素、鱼用生理 管手术 盐水 2 红细胞比容测定 1、T细的比容即T4 验证性 离心机、台式 血红蛋白的测定 细胞占全血容积的 天平(配试管 百分比。 筒)、温氏分血 管.长封闭针 2、血液加入盐酸酸 头、 毛细滴 化后,血红蛋白即 管、注射器、 变成褐色的盐酸高 铁血红蛋白,然后 3.8%柠檬酸钠 可用稀释比色法与 草酸钠 专用的标准色柱进 行比色,即可计算 出血红蛋白的含 量。 3 容积导体导申规律 凡是且有一定体积 4 验证性 蛙米手术器 的观察及鳖心电的 的整块导电体 均 械、MS-302系 引导 称为·容积导 统、连有导线 体”。这个导体可 的鳄鱼夹、任 将心电传导至体表 氏液、石蜡油 面。所以把导电 极置于体表的不同 部位,可通过心电 图机记录到心脏活 动所产生的周期性 申变化。 环境因素对鱼类呼 鱼类生活在水环境 4 综合性 MS-302系统、 吸运动机能的影响 中.男是它的主要 特制乳胶川小汽 呼吸器官。鳃的呵 球、塑料导 吸运动可以反映出 管、半弯缝合 机体内的生理机能 针、缝合线
序 号 实验项目 实验内容 学时 实验类 型 主要试剂及仪 器 1 绪论及鱼类血管导 管手术 (一)配制鱼用生 理盐水 (二)配制麻醉溶 液与手术前麻醉鱼 (三)背大动脉导 管手术 4 验证性 流水式手术 台、金属套 管、长注射 针、水族箱、 麻醉剂、肝 素、鱼用生理 盐水 2 红细胞比容测定、 血红蛋白的测定 1、红细胞比容即红 细胞占全血容积的 百分比。 2、血液加入盐酸酸 化后,血红蛋白即 变成褐色的盐酸高 铁血红蛋白,然后 可用稀释比色法与 专用的标准色柱进 行比色,即可计算 出血红蛋白的含 量。 4 验证性 离心机、台式 天平(配试管 筒)、温氏分血 管、长封闭针 头、毛细滴 管、注射器、 3.8%柠檬酸钠、 草酸钠 3 容积导体导电规律 的观察及鳖心电的 引导 凡是具有一定体积 的整块导电体,均 称为“容积导 体”。这个导体可 将心电传导至体表 面。所以把引导电 极置于体表的不同 部位,可通过心电 图机记录到心脏活 动所产生的周期性 电变化。 4 验证性 蛙类手术器 械、MS-302 系 统、连有导线 的鳄鱼夹、任 氏液、石蜡油 4 环境因素对鱼类呼 吸运动机能的影响 鱼类生活在水环境 中,鳃是它的主要 呼吸器官。鳃的呼 吸运动可以反映出 机体内的生理机能 4 综合性 MS-302 系统、 特制乳胶小汽 球、塑料导 管、半弯缝合 针、缝合线
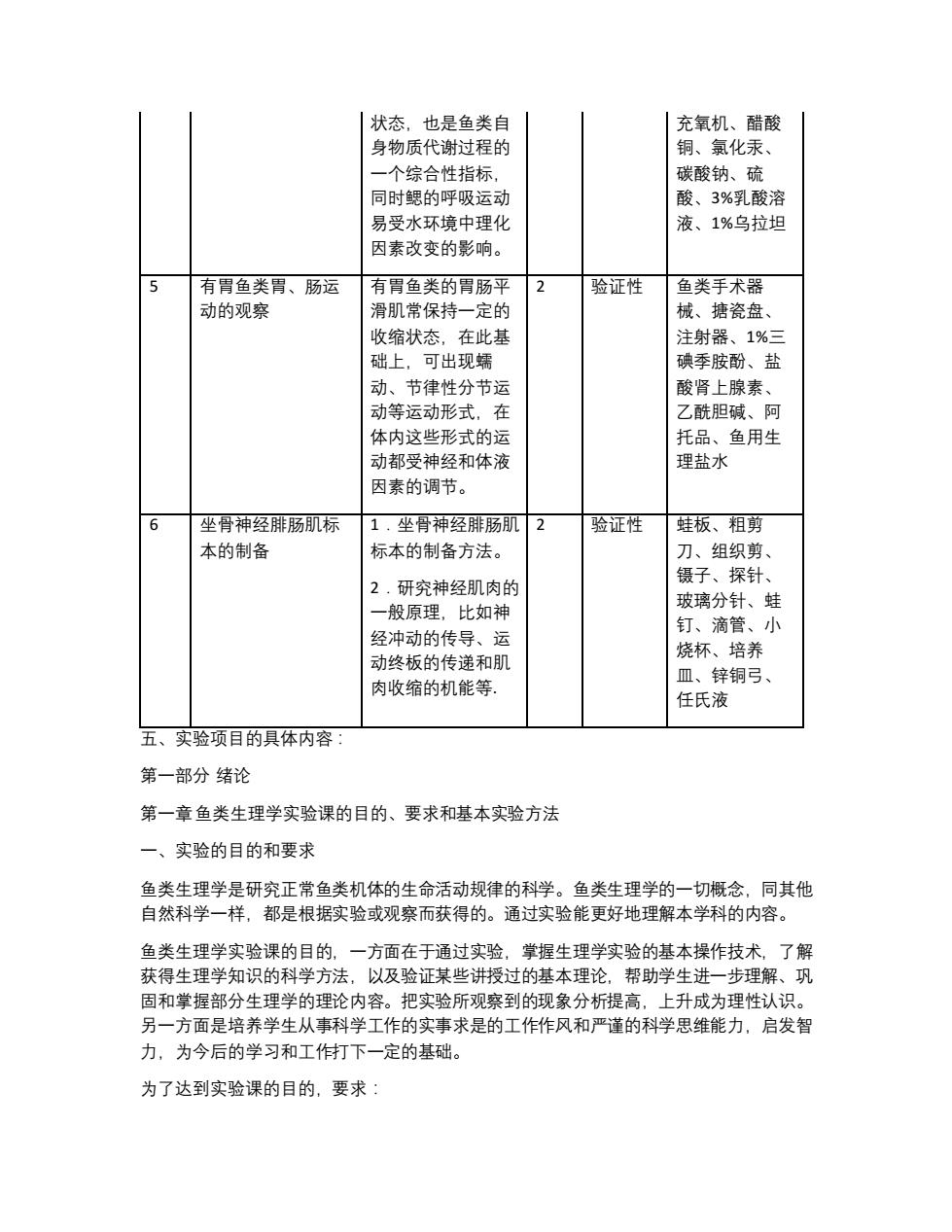
状态,也是鱼类自 充氧机、醋酸 身物质代谢过程的 钥、氯化汞、 一个综合性指标 碳酸钠、硫 同时鳃的呼吸运动 酸、3%乳酸溶 易受水环境中理化 液、1%乌拉坦 因素改变的影响 5 有胃鱼类胃、肠运 有胃鱼类的胃肠平 2 验证性 鱼类手术器 动的观察 滑肌常保持一定的 械、塘瓷盘、 收缩状态,在此基 注射器、1%三 础上,可出现蠕 碘季胺酚、盐 动、节律性分节园 酸肾上腺素 动等运动形式在 7酷阳碱、阿 体内这些形式的运 托品、鱼用生 动都受神经和体液 理盐水 因素的调节。 6 坐骨神经腓肠肌标 1.坐骨神经腓肠肌2 验证性 蛙板、粗剪 本的制备 标本的制备方法。 刀、组织剪 镊子、探针 2.研究神经肌肉的 一般原理,比如神 玻璃分针、蛙 经冲动的传导、运 钉、滴管 动终板的传递和肌 烧杯、培养 肉收缩的机能等 皿、锌铜弓 任氏液 五、实验项目的具体内容 第一部分绪论 第一章鱼类生理学实验课的目的、要求和基本实验方法 一、实验的目的和要求 鱼类生理学是研究正常鱼类机体的生命活动规律的科学。鱼类生理学的一切概念,同其他 自然科学一样,都是根据实验或观察而获得的。通过实验能更好地理解本学科的内容。 鱼类生理学实验课的目的,一方面在于通过实验,掌握生理学实验的基本操作技术,了解 获得生理学知识的科学方法,以及验证某些讲授过的基本理论,帮助学生进一步理解、巩 固和掌握部分生理学的理论内容。把实验所观察到的现象分析提高,上升成为理性认识。 另一方面是培养学生从事科学工作的实事求是的工作作风和严谨的科学思维能力,启发智 力,为今后的学习和工作打下一定的基础。 为了达到实验课的目的,要求:
状态,也是鱼类自 身物质代谢过程的 一个综合性指标, 同时鳃的呼吸运动 易受水环境中理化 因素改变的影响。 充氧机、醋酸 铜、氯化汞、 碳酸钠、硫 酸、3%乳酸溶 液、1%乌拉坦 5 有胃鱼类胃、肠运 动的观察 有胃鱼类的胃肠平 滑肌常保持一定的 收缩状态,在此基 础上,可出现蠕 动、节律性分节运 动等运动形式,在 体内这些形式的运 动都受神经和体液 因素的调节。 2 验证性 鱼类手术器 械、搪瓷盘、 注射器、1%三 碘季胺酚、盐 酸肾上腺素、 乙酰胆碱、阿 托品、鱼用生 理盐水 6 坐骨神经腓肠肌标 本的制备 1.坐骨神经腓肠肌 标本的制备方法。 2.研究神经肌肉的 一般原理,比如神 经冲动的传导、运 动终板的传递和肌 肉收缩的机能等. 2 验证性 蛙板、粗剪 刀、组织剪、 镊子、探针、 玻璃分针、蛙 钉、滴管、小 烧杯、培养 皿、锌铜弓、 任氏液 五、实验项目的具体内容: 第一部分 绪论 第一章鱼类生理学实验课的目的、要求和基本实验方法 一、实验的目的和要求 鱼类生理学是研究正常鱼类机体的生命活动规律的科学。鱼类生理学的一切概念,同其他 自然科学一样,都是根据实验或观察而获得的。通过实验能更好地理解本学科的内容。 鱼类生理学实验课的目的,一方面在于通过实验,掌握生理学实验的基本操作技术,了解 获得生理学知识的科学方法,以及验证某些讲授过的基本理论,帮助学生进一步理解、巩 固和掌握部分生理学的理论内容。把实验所观察到的现象分析提高,上升成为理性认识。 另一方面是培养学生从事科学工作的实事求是的工作作风和严谨的科学思维能力,启发智 力,为今后的学习和工作打下一定的基础。 为了达到实验课的目的,要求:

(一)实验前 1.仔细阅读实验指导,了解实验的目的、要求、步骤和注意事项。 2,结合实验内容,复习有关理论。 3.根据有关理论预测各个步骤可能产生的结果。 (二)实验时 1·实验器的安放要整齐、清洁、有条不紊。要遵守实验纪律,同学之间团结互助,分工 合作。 2,按照实验步骤及操作规程,以严肃认真的态度,仔细地进行各项操作、观察,如实地 记录实验现象和结果(避免凭记忆写实验报告),随时对出现的现象进行分析、思考。 3,爱护公物、注意保护实验动物和标本,节省实验器材和药品。 (三)实验后 1,将实验用具整理好,并把所用器械洗净擦干。如有损失短少,应及时向任课教师报 告,做好实验室的清洁卫生工作。 2,整理实验记录,填写实验报告,按时交任课教员评阅。 二、实验结果的处理与实验报告 (一)实验过程中得到的结果需要进行分析和整理。凡属测量性质的结果,如长短、高 低、快慢、轻重、多少等」 均应定量地写明其单位、数值。凡用曲线记录的实验,实验结 果应尽量用记录的曲线来表示,并加以必要的标注说明,如刺激记号、时间记号等。为了 便于比较分析,有的实验结果可用表格或绘图表示。 (二)对实验报告的要求 1.不论示教实验或自做的实验,每人均要写出实验报告,按时交指导老师评阅: 2,实验报告要求文字简练、通顺,书写清楚、整洁,正确使用标点符号。报告内容的项 目和要求如下 (1)实验序号、题目、日期、室温。 (2)实验目的和原理。 (3)实验方法和实验步骤。 (4)实验结果,实验结果的记述要求真实、准确、简明、扼要。 (5)讨论和结论。实验结果的讨论是根据已知的理论知识对结果进行解释和分析
(一)实验前 1.仔细阅读实验指导,了解实验的目的、要求、步骤和注意事项。 2.结合实验内容,复习有关理论。 3.根据有关理论预测各个步骤可能产生的结果。 (二)实验时 1.实验器的安放要整齐、清洁、有条不紊。要遵守实验纪律,同学之间团结互助,分工 合作。 2.按照实验步骤及操作规程,以严肃认真的态度,仔细地进行各项操作、观察,如实地 记录实验现象和结果(避免凭记忆写实验报告),随时对出现的现象进行分析、思考。 3.爱护公物、注意保护实验动物和标本,节省实验器材和药品。 (三)实验后 1.将实验用具整理好,并把所用器械洗净擦干。如有损失短少,应及时向任课教师报 告,做好实验室的清洁卫生工作。 2.整理实验记录,填写实验报告,按时交任课教员评阅。 二、实验结果的处理与实验报告 (一)实验过程中得到的结果需要进行分析和整理。凡属测量性质的结果,如长短、高 低、快慢、轻重、多少等,均应定量地写明其单位、数值。凡用曲线记录的实验,实验结 果应尽量用记录的曲线来表示,并加以必要的标注说明,如刺激记号、时间记号等。为了 便于比较分析,有的实验结果可用表格或绘图表示。 (二)对实验报告的要求 1.不论示教实验或自做的实验,每人均要写出实验报告,按时交指导老师评阅。 2.实验报告要求文字简练、通顺,书写清楚、整洁,正确使用标点符号。报告内容的项 目和要求如下: (1)实验序号、题目、日期、室温。 (2)实验目的和原理。 (3)实验方法和实验步骤。 (4)实验结果,实验结果的记述要求真实、准确、简明、扼要。 (5)讨论和结论。实验结果的讨论是根据已知的理论知识对结果进行解释和分析

并判断结果是否正确。在出现非预期结果时,应分析其可能引发的原因。实验的讨论和作 出结论是富有创造性的工作,应该严肃认真对待,不要盲目抄袭书本和他人的实验报告。 三、鱼类生理学实验方法概述 鱼类生理学实验主要以活的鱼类和其他水生动物为实验材料,如四大家鱼、龟、鳖、 黄鳝、胡子鲶、乌鳢等。无论选用哪种动物,在进行实验观察或记录以前,都要选择适宜 的实验方法和一定的技术操作。为了获得较为准确的实验结果,特介绍两类常用的生理学 实验方法。 (一)急性实验方法 这种方法实验过程不能持久,实验后动物一般被处死,是一种短时间内完成的实验观察方 法。急性实验方法可按研究目的不同分为离体组织法、器官实验法和活体解剖法等。 1.离体组织或器官实验方法 把要研究的组织或器官从活的、或刚死的动物身上取下来,放在一个人的接近于正常生理 活动的环境中,使其在短时间内仍保持一定的生理机能,从而观察和研究它的生理过程。 2.活体解剖实验方法 是将动物麻醉或损毁大脑后,施行各种外科手术,暴露出所需要研究的器官或组织。 给予不同的刺激,以研究它的机能和调节机制,研究器官间的相互关系。 急性实验法一般又叫分析法。 (二)慢性实验方法 慢性实验方法是在某一特定条件下,以完整健康的活体动物为研究对象,并在它与周围 环境保持比较自然的条件下,连续地反复观察和记录清醒动物某项生理机能对内、外环境 条件变化的反应。在慢性实验之前,有的还要在动物身上做无菌外科手术,将要研究的器 官切除某部分组织,埋藏某种药物或电极等,待其创口基本愈合后进行实验研究。 慢性实验法又叫综合法。 四、实验室守则 (一)尊敬老师,团结同学,搞好组内同学间的协作。 (二)遵守学习纪律,准时到达实验室。实验时因故外出或早退应向教师请假。 (三)严肃认真地进行实验,实验中不得进行任何与实验无关的工作 (四)低声轻步,保持实验室安静。 (五)爱护仪器设备,节约药品和实验动物。仪器损坏或失灵时,应及时报告指导教 师,进行更换或修理
并判断结果是否正确。在出现非预期结果时,应分析其可能引发的原因。实验的讨论和作 出结论是富有创造性的工作,应该严肃认真对待,不要盲目抄袭书本和他人的实验报告。 三、鱼类生理学实验方法概述 鱼类生理学实验主要以活的鱼类和其他水生动物为实验材料,如四大家鱼、龟、鳖、 黄鳝、胡子鲶、乌鳢等。无论选用哪种动物,在进行实验观察或记录以前,都要选择适宜 的实验方法和一定的技术操作。为了获得较为准确的实验结果,特介绍两类常用的生理学 实验方法。 (一)急性实验方法 这种方法实验过程不能持久,实验后动物一般被处死,是一种短时间内完成的实验观察方 法。急性实验方法可按研究目的不同分为离体组织法、器官实验法和活体解剖法等。 1.离体组织或器官实验方法 把要研究的组织或器官从活的、或刚死的动物身上取下来,放在一个人的接近于正常生理 活动的环境中,使其在短时间内仍保持一定的生理机能,从而观察和研究它的生理过程。 2.活体解剖实验方法 是将动物麻醉或损毁大脑后,施行各种外科手术,暴露出所需要研究的器官或组织。 给予不同的刺激,以研究它的机能和调节机制,研究器官间的相互关系。 急性实验法一般又叫分析法。 (二)慢性实验方法 慢性实验方法是在某一特定条件下,以完整健康的活体动物为研究对象,并在它与周围 环境保持比较自然的条件下,连续地反复观察和记录清醒动物某项生理机能对内、外环境 条件变化的反应。在慢性实验之前,有的还要在动物身上做无菌外科手术,将要研究的器 官切除某部分组织,埋藏某种药物或电极等,待其创口基本愈合后进行实验研究。 慢性实验法又叫综合法。 四、实验室守则 (一)尊敬老师,团结同学,搞好组内同学间的协作。 (二)遵守学习纪律,准时到达实验室。实验时因故外出或早退应向教师请假。 (三)严肃认真地进行实验,实验中不得进行任何与实验无关的工作。 (四)低声轻步,保持实验室安静。 (五)爱护仪器设备,节约药品和实验动物。仪器损坏或失灵时,应及时报告指导教 师,进行更换或修理

(六)保持实验室的整洁和干燥,实验完毕后,各组应将本组使用的器械清洗干净,擦 干水分,清点整齐,经老师验收后方可离开实验室;卫生值日小组负责实验台、地面、水 池等处的清洗,动物尸体的倾倒等工作。 实验一鱼类血管导管手术 一、实验目的 掌握进行鱼类血管导管手术的基本步骤和方法,并了解它在鱼类生理研究工作中的作用和 意义。 二、实验材料 (一)实验动物草鱼。 (二)实验器材流水式手术台、手术台、剪、镊、针、缝线、止血棉花、内径0.6和 0.25毫米塑料管、金属套管和长注射针、流水式小长格水族箱。 (三)药品麻醉剂(MS222,尿烷或喹那啶)、肝素、鱼用生理盐水。 三、实验步骤与观察项目 (一)配制鱼用生理盐水 采用Cortland淡水鱼用生理盐水,其配置方法是:用NaCI7.25克,Ka0.38克,caCl20.162 克,Mgs04.7H200.23克,NaHC031.0克,NaH2P04.2H200,41克,葡萄糖1.0克配制成1 升(1000毫升)生理溶液。氩化钙和葡萄糖应在使用前再加入;蒸溜水在配制生理盐水 之前最好能进行充气。 进行血管导管手术用的生理盐水,要在使用前加入肝素,份量是:每升加入肝素10个国 际单位 (二)配制麻醉溶液与手术前麻醉鱼 常用的麻醉剂及其配制浓度是: 1.MS-222浓度为1:10,0001:45,000,进行血管导管手术时,用1:20,000的浓 度浸泡鱼体使之麻醉;用1:45,000的浓度通过胶管不断灌注鳃部。 2.尿烷浓度是540毫克/升。 3.喹那啶浓度是0.010.03毫升溶解于等量的丙酮中,然后加入1升水中。 配制麻醉溶液的水要取自手术鱼类原来驯养的水体。如能用低温的水配制麻醉溶液,将 增强麻醉效果。 麻醉溶液配好后将鱼放入,12分钟后停止游动,身体失去平衡,鳃盖活动中止,对外 界刺激无任何反应,就可将它置于手术台上。由于血管导管手术需时较长,通常是半小时
(六)保持实验室的整洁和干燥,实验完毕后,各组应将本组使用的器械清洗干净,擦 干水分,清点整齐,经老师验收后方可离开实验室;卫生值日小组负责实验台、地面、水 池等处的清洗,动物尸体的倾倒等工作。 实验一 鱼类血管导管手术 一、实验目的 掌握进行鱼类血管导管手术的基本步骤和方法,并了解它在鱼类生理研究工作中的作用和 意义。 二、实验材料 (一)实验动物 草鱼。 (二)实验器材 流水式手术台、手术台、剪、镊、针、缝线、止血棉花、内径 0.6 和 0.25毫米塑料管、金属套管和长注射针、流水式小长格水族箱。 (三)药品 麻醉剂(MS-222,尿烷或喹那啶)、肝素、鱼用生理盐水。 三、实验步骤与观察项目 (一)配制鱼用生理盐水 采用 Cortland 淡水鱼用生理盐水,其配置方法是:用 NaCI7.25 克,KCI0.38 克,CaCI20.162 克,MgSO4.7H2O0.23克,NaHCO31.0 克,NaH2PO4.2H2O0.41 克,葡萄糖 1.0 克配制成 1 升(1000 毫升)生理溶液。氯化钙和葡萄糖应在使用前再加入;蒸馏水在配制生理盐水 之前最好能进行充气。 进行血管导管手术用的生理盐水,要在使用前加入肝素,份量是:每升加入肝素 10 个国 际单位。 (二)配制麻醉溶液与手术前麻醉鱼 常用的麻醉剂及其配制浓度是: 1.MS-222 浓度为 1:10,000~1:45,000,进行血管导管手术时,用 1:20,000 的浓 度浸泡鱼体使之麻醉;用 1:45,000 的浓度通过胶管不断灌注鳃部。 2.尿烷 浓度是 5—40 毫克/升。 3.喹那啶 浓度是 0.01~0.03 毫升溶解于等量的丙酮中,然后加入 1 升水中。 配制麻醉溶液的水要取自手术鱼类原来驯养的水体。如能用低温的水配制麻醉溶液,将 增强麻醉效果。 麻醉溶液配好后将鱼放入,1~2 分钟后停止游动,身体失去平衡,鳃盖活动中止,对外 界刺激无任何反应,就可将它置于手术台上。由于血管导管手术需时较长,通常是半小时

以上,因此,应将浓度较低的麻醉溶液通过胶管不断地灌注鱼鳃部,既供给必要的氧气又 保证鱼在整个手术过程始终处于麻醉状态。 (三)背大动脉导管手术 1,用粗注射针将麻醉鱼上颌两鼻腔之间刺穿,插入一长约34厘米的粗塑料管,以备手 术后将血管导管引出体外。然后,将鱼腹部向上置于用塑料网制成的吊床上,左右鳃盖下 插入小胶管,使循环流动的低浓度麻醉溶液不断灌注鳃部,并使鱼体表保持潮湿。用一吊 钩把鱼下颌往上拉起,使口腔尽可能张大。用手术弯针穿线后,在口腔顶部正中线的上皮 下,一点进一点出系上两个活结,前后相距约1厘米,以备将导管固定在口腔顶部上皮 用。 2.用2毫升的注射器装满含肝素的鱼用生理盐水,接上注射针头(注射针头的口径应与 做导管用的塑料小管内径相一致);针头末端再套上长约50厘米的塑料小管。轻轻推动注 射器筒塞,使整条塑料小管都充满含肝素的鱼用生理盐水。如有气泡,应来回移动射器筒 塞或挤出少许生理盐水而将它排除。 3用特制的金属套管和插入套管内的注满抗凝剂的塑料导管在咽腔上壁第 一对鳃弓和第 二对鳃弓之间的正中线轻轻以300角斜刺入上皮组织以及在其下方的背大动脉插入动作要 小心,稳而准(为了保证血管导管手术成功,手术前应通过解剖了解实验鱼背大动脉在咽 腔上壁的具体部位)。如果套管正好刺入背大动脉(注意刺入动作不可用力过大,以免穿 过背大动脉),血液将立即沿塑料导管向外涌出。此时,一手应将金属套管轻轻稳住,不 可移动, 手将塑料导管沿着金属套管小心地插入背大动脉内,如果塑料导管正好插入 背大动脉内,则背大动脉的血液就会沿着塑料导管向外流。此时亦可轻轻来回移动注射器 筒塞,以观察血流在塑料导管内是否通畅。如果血流通畅,说明塑料导管已经准确插入背 大动脉内,如果血流中断,则表示塑料导管并未插入背大动脉内或者只在背大动脉出血的 部位,必须把塑料导管取出,重新再寻找合适的部位刺入。 4·将塑料导管准确插入背大动脉后,一手用镊子轻轻夹住塑料小管,将它的位置稳住, 切不可移动,另一手慢慢将金属套管小心移出。移出一段距离后,使其位置固定。在系紧 塑料小管前必须移动注射器筒塞,以检查小管内的血流是否畅通无阻以及有无气泡。结系 塑料导管时不可太紧,以免影响血液流通。塑料导管固定在口腔顶部上皮后,将塑料导管 穿过鱼上颌两鼻腔之间的穿孔,把塑料导管引出体外。并用相线将塑料导管结扎。这时 可用注射器把少量生理盐水通过塑料导管注入鱼体内以补充手术过程的失血,并使整个塑 料导管充满生理盐水而无气泡,然后取走注射器和注射针头,用线将塑料导管未端扎紧封 闭。 (四)鱼在手术后护理 做完背大动脉导管手术后,鱼应立即移入有新鲜流水与充气的水族箱中,迅速让其苏醒。 如因麻醉较深,苏醒缓慢时,可用手帮助其口腔和鳃盖运动(相当于人工呼吸),促使它 恢复呼吸运动。苏醒后的鱼应移入特别的用黑色塑料板间隔成长格的流水式水族箱内,每
以上,因此,应将浓度较低的麻醉溶液通过胶管不断地灌注鱼鳃部,既供给必要的氧气又 保证鱼在整个手术过程始终处于麻醉状态。 (三)背大动脉导管手术 1.用粗注射针将麻醉鱼上颌两鼻腔之间刺穿,插入一长约 3~4 厘米的粗塑料管,以备手 术后将血管导管引出体外。然后,将鱼腹部向上置于用塑料网制成的吊床上,左右鳃盖下 插入小胶管,使循环流动的低浓度麻醉溶液不断灌注鳃部,并使鱼体表保持潮湿。用一吊 钩把鱼下颌往上拉起,使口腔尽可能张大。用手术弯针穿线后,在口腔顶部正中线的上皮 下,一点进一点出系上两个活结,前后相距约 1 厘米,以备将导管固定在口腔顶部上皮 用。 2.用 2 毫升的注射器装满含肝素的鱼用生理盐水,接上注射针头(注射针头的口径应与 做导管用的塑料小管内径相一致);针头末端再套上长约 50 厘米的塑料小管。轻轻推动注 射器筒塞,使整条塑料小管都充满含肝素的鱼用生理盐水。如有气泡,应来回移动射器筒 塞或挤出少许生理盐水而将它排除。 3.用特制的金属套管和插入套管内的注满抗凝剂的塑料导管在咽腔上壁第一对鳃弓和第 二对鳃弓之间的正中线轻轻以 300 角斜刺入上皮组织以及在其下方的背大动脉插入动作要 小心,稳而准(为了保证血管导管手术成功,手术前应通过解剖了解实验鱼背大动脉在咽 腔上壁的具体部位)。如果套管正好刺入背大动脉(注意刺入动作不可用力过大,以免穿 过背大动脉),血液将立即沿塑料导管向外涌出。此时,一手应将金属套管轻轻稳住,不 可移动,另一手将塑料导管沿着金属套管小心地插入背大动脉内,如果塑料导管正好插入 背大动脉内,则背大动脉的血液就会沿着塑料导管向外流。此时亦可轻轻来回移动注射器 筒塞,以观察血流在塑料导管内是否通畅。如果血流通畅,说明塑料导管已经准确插入背 大动脉内,如果血流中断,则表示塑料导管并未插入背大动脉内或者只在背大动脉出血的 部位,必须把塑料导管取出,重新再寻找合适的部位刺入。 4.将塑料导管准确插入背大动脉后,一手用镊子轻轻夹住塑料小管,将它的位置稳住, 切不可移动,另一手慢慢将金属套管小心移出。移出一段距离后,使其位置固定。在系紧 塑料小管前必须移动注射器筒塞,以检查小管内的血流是否畅通无阻以及有无气泡。结系 塑料导管时不可太紧,以免影响血液流通。塑料导管固定在口腔顶部上皮后,将塑料导管 穿过鱼上颌两鼻腔之间的穿孔,把塑料导管引出体外。并用粗线将塑料导管结扎。这时, 可用注射器把少量生理盐水通过塑料导管注入鱼体内以补充手术过程的失血,并使整个塑 料导管充满生理盐水而无气泡,然后取走注射器和注射针头,用线将塑料导管末端扎紧封 闭。 (四)鱼在手术后护理 做完背大动脉导管手术后,鱼应立即移入有新鲜流水与充气的水族箱中,迅速让其苏醒。 如因麻醉较深,苏醒缓慢时,可用手帮助其口腔和鳃盖运动(相当于人工呼吸),促使它 恢复呼吸运动。苏醒后的鱼应移入特别的用黑色塑料板间隔成长格的流水式水族箱内,每

长格只放一尾鱼,使其安静地休息而不进行游动,以免影响导管脱落。手术后的鱼应有24 小时的复原时间才能开始实验。 五、思考题 (一)利用背大动脉血管导管采血有什么好处?这种方法取得的血样与尾静脉采得的血样 主要不同之处是什么? (仁)在生理学的实验方法中,本实验属哪一类? 实验二红细胞比容测定 一、实验原理 红细胞比容即红细胞占全血容积的百分比。其测定原理是:将抗凝全血放在有容积等分刻 度的玻璃管中,然后离心,使红细胞下沉,并彼此压紧而又不改变每一个红细胞的正常形 态,由此求得红细胞在全血中所占容积百分比。 二、实验目的 学习测定红细胞比容的方法 三、实验材料 (一)实验动物草鱼或鲤鱼 (二)实验器材离心机、台式天平(配试管筒)、10毫升离心管2只、温氏分血管、长封 闭针头、毛细滴管、普通滴管2只、10毫升注射器2只、9号注射针头2个、10毫升试 管5只(有两只内装草酸盐抗凝剂0.8毫升或柠檬酸溶液,烘干)。 (三)药品3.8%柠檬酸钠、草酸钠、凡土林、生理盐水。 四、实验步骤与观察项目 (一)尾静脉采血于尾鳍后缘与侧线之下一个鳞片的位置将注射器向前斜向刺入,待针 尖碰到鱼骨后用小拇指将注射器活塞向后拉,使注射器内形成负压,然后将针尖在附近轻 轻移动,当有血液进入注射器内时停止移动,抽取血液约2毫升。 (二)将抽取的血液立即缓缓地沿管壁放入盛有干燥草酸盐抗凝剂的试管内(每管内装草 酸盐或柠檬酸钠抗凝剂0.8毫升,可加血8毫升),用涂过凡士林的拇指堵住管口,轻轻 地将试管倒转两、三次,使血液与抗凝剂混合,而红细胞不致破裂溶血。 (三)用毛细滴管或注射器配长封闭针头吸取抗凝全血,然后将滴管或针头插入分血管的 底部,慢慢将滴管或注射器内的血液放入分血管内,其内不可有气泡混杂;逐浙抽出毛细 滴管或针头,精确地装到刻度10厘米处(余者可用滤纸吸去)。然后离心,3000pm,30 分钟
长格只放一尾鱼,使其安静地休息而不进行游动,以免影响导管脱落。手术后的鱼应有 24 小时的复原时间才能开始实验。 五、思考题 (一)利用背大动脉血管导管采血有什么好处?这种方法取得的血样与尾静脉采得的血样 主要不同之处是什么? (二)在生理学的实验方法中,本实验属哪一类? 实验二 红细胞比容测定 一、实验原理 红细胞比容即红细胞占全血容积的百分比。其测定原理是:将抗凝全血放在有容积等分刻 度的玻璃管中,然后离心,使红细胞下沉,并彼此压紧而又不改变每一个红细胞的正常形 态,由此求得红细胞在全血中所占容积百分比。 二、实验目的 学习测定红细胞比容的方法 三、实验材料 (一)实验动物 草鱼或鲤鱼 (二)实验器材 离心机、台式天平(配试管筒)、10 毫升离心管 2 只、温氏分血管、长封 闭针头、毛细滴管、普通滴管 2 只、10 毫升注射器 2 只、9 号注射针头 2 个、10 毫升试 管 5 只(有两只内装草酸盐抗凝剂 0.8 毫升或柠檬酸溶液,烘干)。 (三)药品 3.8%柠檬酸钠、草酸钠、凡士林、生理盐水。 四、实验步骤与观察项目 (一)尾静脉采血 于尾鳍后缘与侧线之下一个鳞片的位置将注射器向前斜向刺入,待针 尖碰到鱼骨后用小拇指将注射器活塞向后拉,使注射器内形成负压,然后将针尖在附近轻 轻移动,当有血液进入注射器内时停止移动,抽取血液约 2 毫升。 (二)将抽取的血液立即缓缓地沿管壁放入盛有干燥草酸盐抗凝剂的试管内(每管内装草 酸盐或柠檬酸钠抗凝剂 0.8 毫升,可加血 8 毫升),用涂过凡士林的拇指堵住管口,轻轻 地将试管倒转两、三次,使血液与抗凝剂混合,而红细胞不致破裂溶血。 (三)用毛细滴管或注射器配长封闭针头吸取抗凝全血,然后将滴管或针头插入分血管的 底部,慢慢将滴管或注射器内的血液放入分血管内,其内不可有气泡混杂;逐渐抽出毛细 滴管或针头,精确地装到刻度 10 厘米处(余者可用滤纸吸去)。然后离心,3000rpm,30 分钟

(四)取10毫升离心管两只,分别标以1、2号,将剩余抗凝血移往1号管中,暂置试管 架上。 (五)取出分血管仔细观察,下段深红色血柱,为红细胞沉积所形成;上段为无色或淡黄 色液体,这是血浆;两段之间,有一灰白色薄层,为血细胞和血小板。读取下段红细胞沉 积柱,乘以10即为红细胞比容数。例如,读数为4.2厘米,4.2×10=42表示100毫升全血 中红细胞容积占42毫升,即为红细胞比容数值,用0.42W表示。 (六)记录所读数值,然后再离心一次(3000pm,5分钟),如果与前次记录相同.表明红 细胞被压紧,此即红细胞比容值。如在离心后,红细胞表面为一斜面,则应垂直静置分血 管35分钟,待红细胞表面平坦后,再读取结果数值,或取倾斜部分的平均值。 五、注意事项 (一)所有玻璃器皿要求干燥清洁,用完后应及时清洗干净。 (二)使用玻璃器皿时,应小心轻放,放稳放妥,以免损坏。 (三)各滴管、吸管、试管勿混用,均应标明号数。 六、思考题 如果离心后分血管上段为谈红色,对实验结果会有什么影响? 实验三血红蛋白的测定 一、实验原理 血液加入盐酸酸化后 ,血红蛋白即变成褐色的盐酸高铁血红蛋白,然后可用稀释比色法与 专用的标准色柱进行比色.即可计算出血红蛋白的含量。 二、实验目的 学习应用比色法来测定动物血红蛋白量的方法。 三、实验材料 (一)实验动物鲤鱼或草鱼 (二)实验器材Sahli氏血红蛋白计、6号针头、脱脂棉、酒精棉。 (三)药物95%乙醇、乙醚、蒸馏水、1%HC1。 四、实验步骤 (一)了解血红蛋白计的构造沙里氏血红蛋白计主要由比色计、比色管和吸血管等部件 组成。比色计的两侧装有标准色玻璃管,其中装有标准浓度的高铁血红蛋白溶液。比色管 的两侧通道刻有两行刻度,一行为血红蛋白量的绝对值(222),以克%(每100ml血液 中所含血红蛋白的克数)来表示,另一行为血红蛋白量的相对值(10160).以%(即相当
(四)取 10 毫升离心管两只,分别标以 1、2 号,将剩余抗凝血移往 1 号管中,暂置试管 架上。 (五)取出分血管仔细观察,下段深红色血柱,为红细胞沉积所形成;上段为无色或淡黄 色液体,这是血浆;两段之间,有一灰白色薄层,为血细胞和血小板。读取下段红细胞沉 积柱,乘以 10 即为红细胞比容数。例如,读数为 4.2 厘米,4.2×10=42 表示 100 毫升全血 中红细胞容积占 42 毫升,即为红细胞比容数值,用 0.42 v/v 表示。 (六)记录所读数值,然后再离心一次(3000rpm,5 分钟),如果与前次记录相同,表明红 细胞被压紧,此即红细胞比容值。如在离心后,红细胞表面为一斜面,则应垂直静置分血 管 3~5 分钟,待红细胞表面平坦后,再读取结果数值,或取倾斜部分的平均值。 五、注意事项 (一)所有玻璃器皿要求干燥清洁,用完后应及时清洗干净。 (二)使用玻璃器皿时,应小心轻放,放稳放妥,以免损坏。 (三)各滴管、吸管、试管勿混用,均应标明号数。 六、思考题 如果离心后分血管上段为淡红色,对实验结果会有什么影响? 实验三 血红蛋白的测定 一、实验原理 血液加入盐酸酸化后,血红蛋白即变成褐色的盐酸高铁血红蛋白,然后可用稀释比色法与 专用的标准色柱进行比色,即可计算出血红蛋白的含量。 二、实验目的 学习应用比色法来测定动物血红蛋白量的方法。 三、实验材料 (一)实验动物 鲤鱼或草鱼 (二)实验器材 Sahli 氏血红蛋白计、6 号针头、脱脂棉、酒精棉。 (三)药物 95%乙醇、乙醚、蒸馏水、1%HCI。 四、实验步骤 (一)了解血红蛋白计的构造 沙里氏血红蛋白计主要由比色计、比色管和吸血管等部件 组成。比色计的两侧装有标准色玻璃管,其中装有标准浓度的高铁血红蛋白溶液。比色管 的两侧通道刻有两行刻度,一行为血红蛋白量的绝对值(2~22),以克%(每 100ml 血液 中所含血红蛋白的克数)来表示,另一行为血红蛋白量的相对值(10~160),以%(即相当

于正常平均值的百分数)来表示。吸血管为一厚壁的毛细玻璃管,其上面有10、20mm3 的刻度。此外还附有搅拌用的玻棒和吸蒸馏水的滴管。 (二)制备盐酸高铁血红蛋白先在比色管内加入1%HC至2克(或10)的刻度处,再将 吸血管在蒸馏水、95%乙醇和乙醚中依次吸吹洗净,将针头扎破免耳静脉后,用吸血管采 血20微升,擦去管尖周围的血液,迅速吹入比色管中的底部,再吸入吹出H数次以洗 出管壁血液,立即混匀,切勿产生气泡,静置10~15分钟使管内HC与血红蛋白充分作 用,完全形成高铁血红蛋白。 (三)比色于比色管内慢慢滴加蒸馏水,边加边混匀,直至比色管的颜色与比色柱(标 准管)的颜色相同时为止,读取比色管内液面的刻度即为血红蛋白的克数%或百分数。 五、注意事项 (一)分血管内的血液要用比色管内的盐酸吹洗干净。 (二)盐酸酸化的时间要充分,不然会影响实验结果。 (三)实验结束后,要将吸血管清洗干净。 六、思考题 (一)哪些操作因素会影响血红蛋白量的测定?怎样防止? (二)在同一个血样中血红蛋白与PCV值和红细胞计数值之间有何关系? 实验四容积导体导电规律的观察及鳖心电的引导 一、实验原理 凡是具有一定体积的整块导申体均称为“容积导体"。这个导体的导申方式在电学上叫 做“容积导电”。心脏活动所产生的电变化之所以能从机体表面记录出来。是因为心脏周 围组织和体液含有大量电解质,具有一定的导电性能。因此可以说,人体和动物体也是一 个容积导体。这个导体可将心电传导至体表面。所以把引导电极置于体表的不同部位,可 通过心电图机记录到心脏活动所产生的周期性电变化。 二、实验目的 学习动物在体心电的引导方法和验证心电的容积导体原理。 三、实验材料 (一)实验动物鳖、黄鳝或蟾蜍。 (二)实验器材蛙类手术器械、MS302系统、连有导线的鳄鱼夹、培养皿、烧杯、滴 管、蛙板、鳝板。 (三)药品任氏液、石蜡油
于正常平均值的百分数)来表示。吸血管为一厚壁的毛细玻璃管,其上面有 10、20mm3 的刻度。此外还附有搅拌用的玻棒和吸蒸馏水的滴管。 (二)制备盐酸高铁血红蛋白 先在比色管内加入 1% HCI 至 2 克(或 10)的刻度处,再将 吸血管在蒸馏水、95%乙醇和乙醚中依次吸吹洗净,将针头扎破兔耳静脉后,用吸血管采 血 20 微升,擦去管尖周围的血液,迅速吹入比色管中的底部,再吸入吹出 HCI 数次以洗 出管壁血液,立即混匀,切勿产生气泡,静置 10~15 分钟,使管内 HCI 与血红蛋白充分作 用,完全形成高铁血红蛋白。 (三)比色 于比色管内慢慢滴加蒸馏水,边加边混匀,直至比色管的颜色与比色柱(标 准管)的颜色相同时为止,读取比色管内液面的刻度即为血红蛋白的克数%或百分数。 五、注意事项 (一)分血管内的血液要用比色管内的盐酸吹洗干净。 (二)盐酸酸化的时间要充分,不然会影响实验结果。 (三)实验结束后,要将吸血管清洗干净。 六、思考题 (一)哪些操作因素会影响血红蛋白量的测定?怎样防止? (二)在同一个血样中血红蛋白与 PCV 值和红细胞计数值之间有何关系? 实验四 容积导体导电规律的观察及鳖心电的引导 一、实验原理 凡是具有一定体积的整块导电体,均称为“容积导体”。这个导体的导电方式在电学上叫 做“容积导电”。心脏活动所产生的电变化之所以能从机体表面记录出来,是因为心脏周 围组织和体液含有大量电解质,具有一定的导电性能。因此可以说,人体和动物体也是一 个容积导体。这个导体可将心电传导至体表面。所以把引导电极置于体表的不同部位,可 通过心电图机记录到心脏活动所产生的周期性电变化。 二、实验目的 学习动物在体心电的引导方法和验证心电的容积导体原理。 三、实验材料 (一)实验动物 鳖、黄鳝或蟾蜍。 (二)实验器材 蛙类手术器械、MS-302 系统、连有导线的鳄鱼夹、培养皿、烧杯、滴 管、蛙板、鳝板。 (三)药品 任氏液、石蜡油