
第四章 酸碱滴定法 4.1概述 4.2水溶液中的酸碱平衡 4.3酸碱指示剂 4.4酸碱滴定法的基本原理 4.5滴定终点误差 4.6应用与示例
第四章 酸碱滴定法 4.1概述 4.2水溶液中的酸碱平衡 4.3酸碱指示剂 4.4酸碱滴定法的基本原理 4.5滴定终点误差 4.6应用与示例

4.1概述 酸碱滴定法(acid-base titration):以酸 碱反应为基础的滴定分析法。 应用的对象:酸、碱以及能与酸、碱反 应的物质
4.1 概述 酸碱滴定法(acid-base titration):以酸 碱反应为基础的滴定分析法。 应用的对象:酸、碱以及能与酸、碱反 应的物质
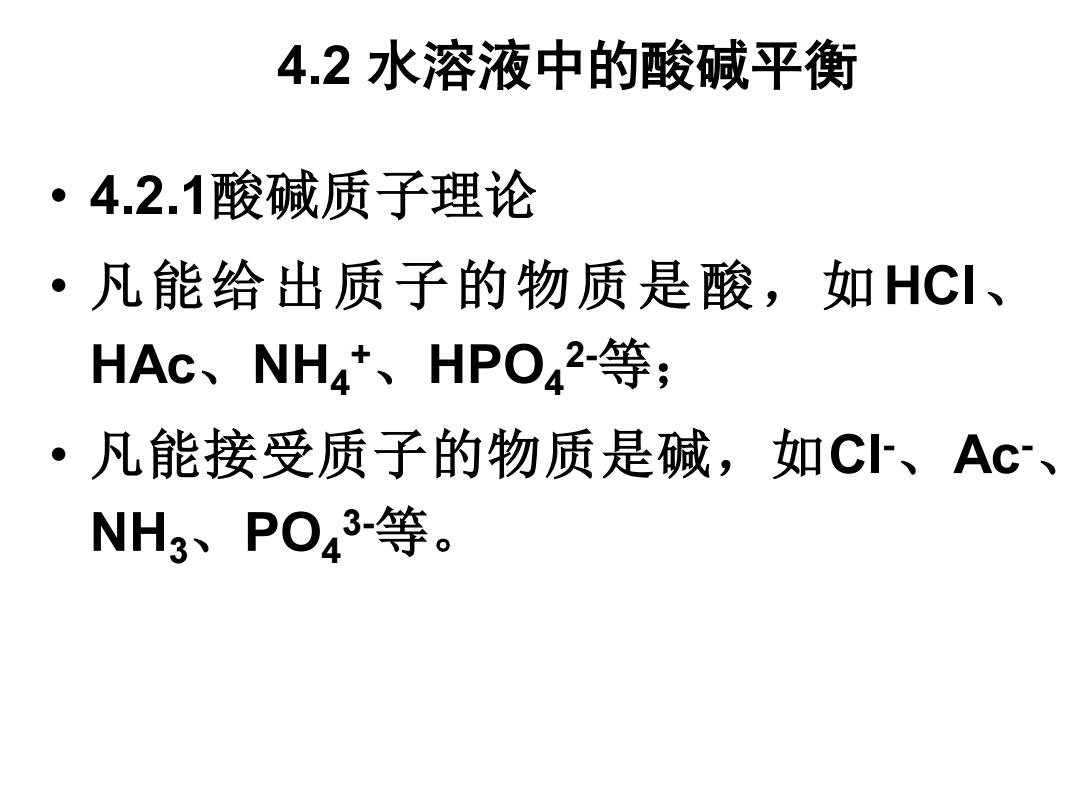
4.2水溶液中的酸碱平衡 ·4.2.1酸碱质子理论 ·凡能给出质子的物质是酸,如HCI、 HAc、NH4、HPO,2等; ·凡能接受质子的物质是碱,如C、Ac、 NH3、PO43-等
4.2 水溶液中的酸碱平衡 • 4.2.1酸碱质子理论 • 凡能给出质子的物质是酸,如HCl、 HAc、NH4 + 、HPO4 2-等; • 凡能接受质子的物质是碱,如Cl-、Ac-、 NH3、PO4 3-等

·酸失去质子后变成相应的共轭碱;而碱 接受质子后变成相应的共轭酸。 HA→A+H 酸碱质子 HA-A称为共轭酸威对
• 酸失去质子后变成相应的共轭碱;而碱 接受质子后变成相应的共轭酸。 酸 碱 质子 HA-A-称为共轭酸碱对 − + HA→ A + H
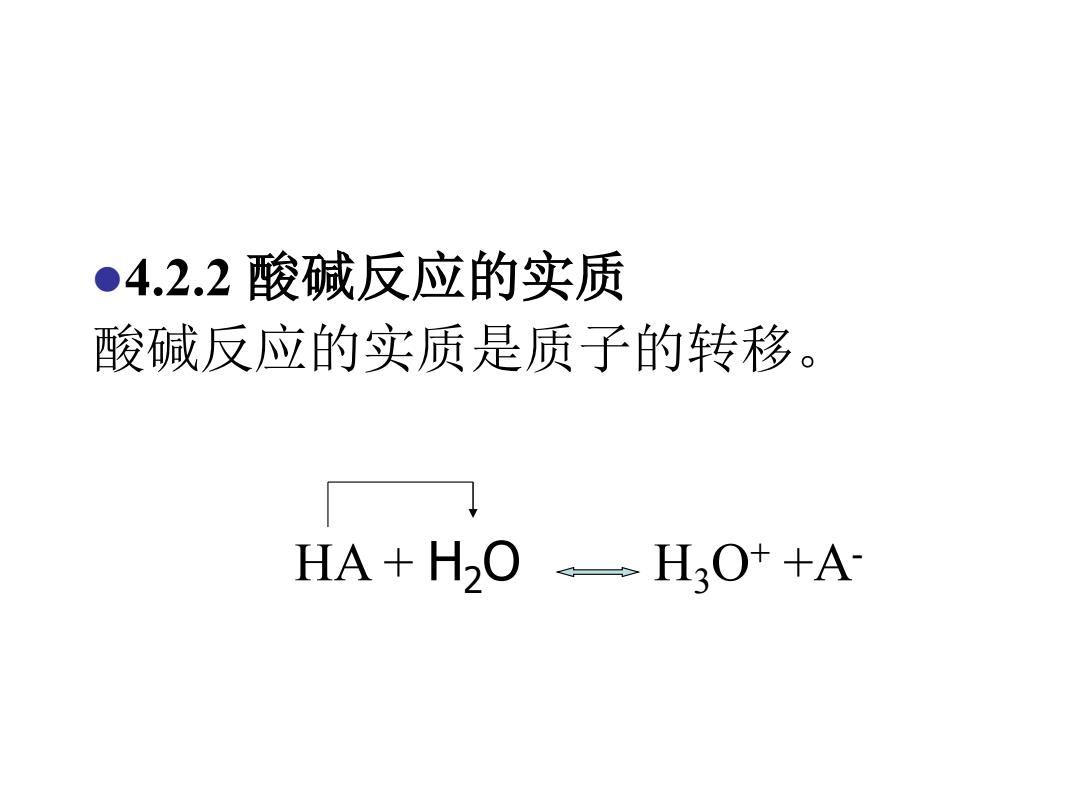
●4.2.2酸碱反应的实质 酸碱反应的实质是质子的转移。 HA+HO。H3O++A
⚫4.2.2 酸碱反应的实质 酸碱反应的实质是质子的转移。 HA + H2O H3O+ +A-

←-102pm> 1107 172pm 图1:H30的结构形态图
图 1: H3O+ 的结构形态图

以下各类型的质子转移,均可看作是酸碱反应 酸的离解:如HAc+H,0一H3O+Ac 酸1碱2 酸2碱1 碱的离解:如NH3+H,O一OH+NH4 碱1酸2碱2酸, 酸碱中和:如HC+NH3一NH4+CI 酸1碱2酸2碱1 盐的水解:如NaAc+H,Os一NaOH+HAc 碱1酸2碱2酸
以下各类型的质子转移,均可看作是酸碱反应 酸的离解:如 HAc+H2O H3O++Ac- 酸1 碱2 酸2 碱1 碱的离解:如NH3+H2O OH-+NH4 + 碱1 酸2 碱2 酸1 酸碱中和:如 HCl+NH3 NH4 ++Cl- 酸1 碱2 酸2 碱1 盐的水解:如 NaAc+H2O NaOH+HAc 碱1 酸2 碱2 酸1
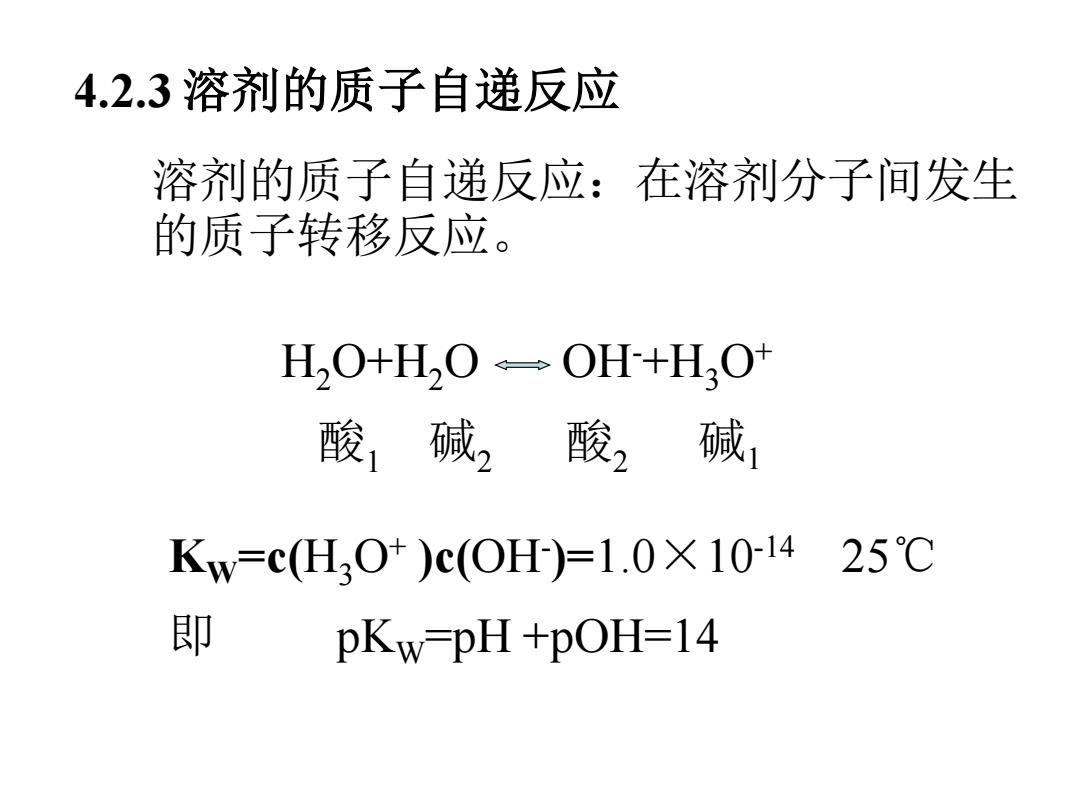
4.2.3溶剂的质子自递反应 溶剂的质子自递反应:在溶剂分子间发生 的质子转移反应。 HO+H,O÷→OH+HO 酸1碱2酸2碱, Kw=c(H30+)c(OH)=1.0×101425℃ 即 pKw-pH+pOH=14
4.2.3 溶剂的质子自递反应 溶剂的质子自递反应:在溶剂分子间发生 的质子转移反应。 H2O+H2O OH-+H3O+ 酸1 碱2 酸2 碱1 KW =c(H3O+ )c(OH- )=1.0×10-14 25℃ 即 pKW=pH +pOH=14

4.2.4酸碱的强度 K(K,)值越大,酸(碱)越强。 HAC+H2OH3O++Ac K=1.75X10-5 NH4+H20=H3O*+NH3K。=5.5×10-10 HC1+H20◆→H30++C1Ka=1.55×106 三种酸的强度顺序是:HCI>HAc>NH4
4.2.4酸碱的强度 Ka ( Kb )值越大,酸(碱)越强。 HAc+H2O H3O++Ac- Ka=1.75×10-5 NH4 + +H2O H3O+ +NH3 Ka=5.5×10-10 HCl + H2O H3O+ +Cl- Ka=1.55×106 三种酸的强度顺序是:HCl >HAc> NH4 +

共轭酸碱对的K和K,的关系 ·以一元弱酸在水中的离解为 ·HA+H2O一H3O*+A- c(H,0)·c(A) K= c(HA HA的共轭碱A在水溶液中的离解为 A+H,O→HA+OH K6 c(HA)·c(OH) c(A)
• 共轭酸碱对的Ka和Kb的关系 • 以一元弱酸在水中的离解为 • HA+H2O H3O++A— HA的共轭碱A-在水溶液中的离解为 − − A + H2 O → HA+OH ( ) ( ) (O ) − − = c A c HA c H Kb ( ) ( O ) ( ) 3 c HA c H c A Ka + − =