
第二章:物质的状态 固 作 体 章要求 业
固 体 第二章:物质的状态 气 体 液 体 作 业 本 章 要 求
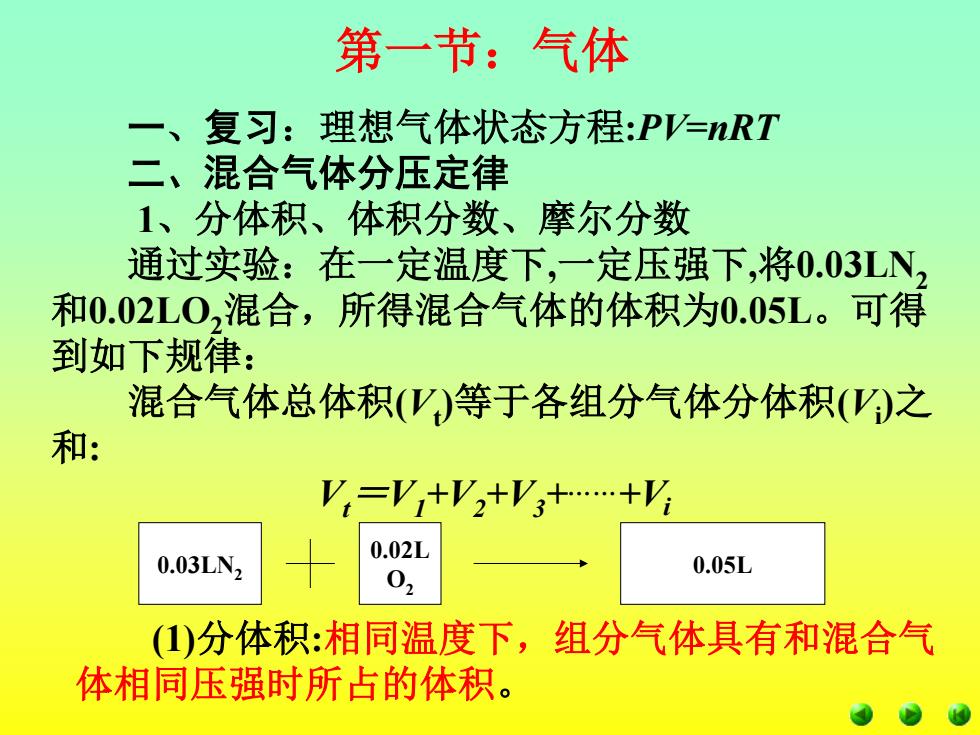
第一节:气体 复习:理想气体状态方程:P=nRT 混合气体分压定律 1、分体积、体积分数、摩尔分数 通过实验:在一定温度下,一定压强下,将0.03LN, 和0.02L0,混合,所得混合气体的体积为0.05L。可得 到如下规律: 混合气体总体积(')等于各组分气体分体积()之 和: V=V+V2+V3+…+V☒ 0.03LN2 0.02L 02 0.05L (1)分体积:相同温度下,组分气体具有和混合气 体相同压强时所占的体积
0.05L 一、复习:理想气体状态方程:PV=nRT 二、混合气体分压定律 1、分体积、体积分数、摩尔分数 通过实验:在一定温度下,一定压强下,将0.03LN2 和0.02LO2混合,所得混合气体的体积为0.05L。可得 到如下规律: 混合气体总体积(Vt )等于各组分气体分体积(Vi )之 和: Vt =V1 +V2 +V3 +……+Vi 第一节:气体 0.03LN2 0.02L O2 (1)分体积:相同温度下,组分气体具有和混合气 体相同压强时所占的体积

理想气体定律 (2)体积分数:体积分数就是该组分气体的分体积 与总体积之比。x=VHV x氮=0.03/0.05=0.6x氧=0.02/0.05=0.4 (③)摩尔分数:某组分气体的“物质的量”与混合 气体的总物质的量之比。N:=/n总 n总=n氧+n氮=PV氧/RT+PV氮/RT=P(V氧+V氮/RT n氧=PV氧/RT N=V氧/(V氧+V氮) =0.02/0.05 =0.04 与x在数值上一样 我们由理想气体状态方程PV=nRT可知当R、T和 P一定时V与n成正比
(2)体积分数:体积分数就是该组分气体的分体积 与总体积之比。xi =Vi /Vt x氮=0.03/0.05=0.6 x氧=0.02/0.05=0.4 (3)摩尔分数:某组分气体的“物质的量”与混合 气体的总物质的量之比。Ni =ni /n总 n总=n氧+n氮=PV氧/RT+PV氮/RT=P(V氧+V氮)/RT n氧=PV氧/RT Ni =V氧/(V氧+V氮) =0.02/0.05 =0.04 与xi在数值上一样 我们由理想气体状态方程PV=nRT可知当R、T和 P一定时V与n成正比。 理想气体定律
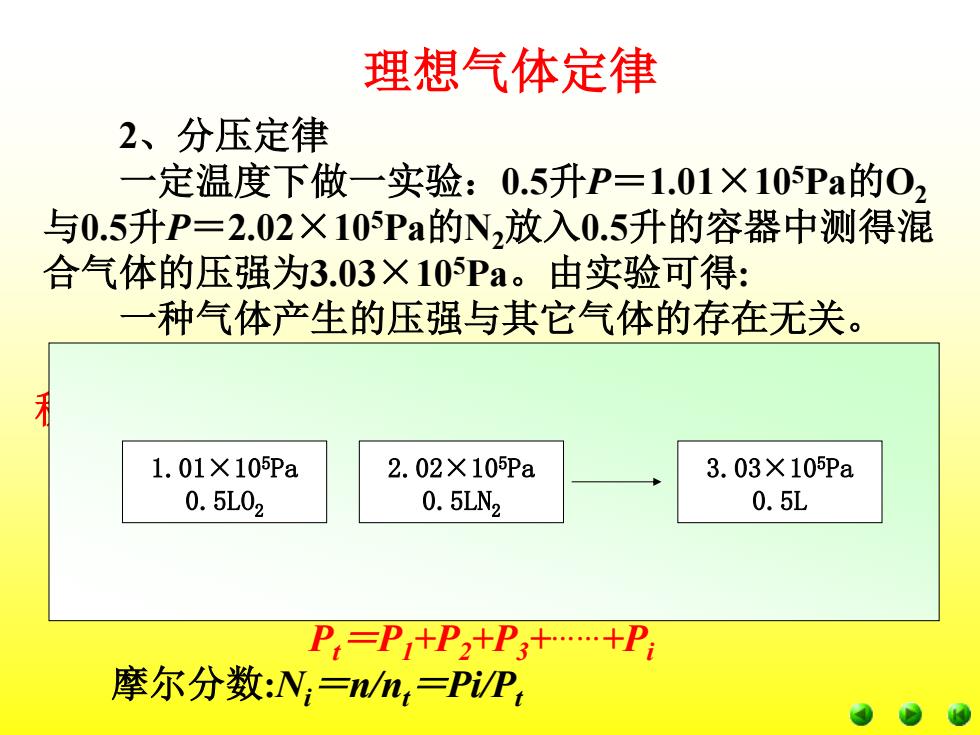
理想气体定律 2、分压定律 一定温度下做一实验:0.5升P=1.01×105Pa的0) 与0.5升P=2.02×105Pa的N2放入0.5升的容器中测得混 合气体的压强为3.03×105Pa。由实验可得: 一种气体产生的压强与其它气体的存在无关。 1.01×10pa 2.02×10Pa 3.03×10pa 0.5L02 0.5LN2 0.5L P=P+P2+P3+…+P 摩尔分数:N,=/n,=PP
分压:在恒温时某组分气体占据与混合气体相同体 积时,对容器所产生的压强。 P总=n总RT/V =(n氧气+n氮气)RT/V =P氧+P氮 混合气体的总压强Pt为各组分气体的分压之和: Pt =P1+P2+P3+……+Pi 摩尔分数:Ni =n/nt =Pi/Pt 2、分压定律 一定温度下做一实验:0.5升P=1.01×105Pa的O2 与0.5升P=2.02×105Pa的N2放入0.5升的容器中测得混 合气体的压强为3.03×105Pa。由实验可得: 一种气体产生的压强与其它气体的存在无关。 理想气体定律 1.01×105Pa 0.5LO2 2.02×105Pa 0.5LN2 3.03×105Pa 0.5L

理想气体定律 例题1:A气体在6×104Pa下,300K时体积为 0.1升;B气体在8×104Pa下,300K时体积为0.2升。 将这两种气体在0.5升容器中混合,如果温度不变, 求混合气体的总压强。 解:两位同学做法不同,看谁正确: 方法①P=6×104Pa+8×104Pa =1.4×105Pa 方法②油P,V,=P,V, P×0.5=6×104×0.1.P4=1.2×104Pa PB×0.5=8×104×0.1.∴.PB=3.2×104Pa P=P+PB=1.2×104Pa+3.2X104Pa=4.4×104Pa 要弄清楚分体积、分压强的概念
例题1:A气体在6×104Pa下,300K时体积为 0.1升;B气体在8×104Pa下,300K时体积为0.2升。 将这两种气体在0.5升容器中混合,如果温度不变, 求混合气体的总压强。 解:两位同学做法不同,看谁正确: 方法①Pt =6×104Pa+8×104Pa =1.4×105Pa 方法②由P1V1 =P2V2 PA×0.5=6×104×0.1 ∴PA =1.2×104Pa PB×0.5=8×104×0.1 ∴PB =3.2×104Pa Pt =PA+PB=1.2×104Pa+3.2×104Pa=4.4×104Pa 要弄清楚分体积、分压强的概念。 理想气体定律

理想气体定律 例题2:在298K时,将压强为3.33×104Pa的 N0.2L和压强为4.67×104Pa的0,0.3升移入0.3升的 真空容器,问混合气体中各组分气体的分压强、分 体积和总压强各为多少? 解:由PV=P2V2 P氮=3.33×104Pa×0.2L/0.3L =2.22×104Pa P氧=4.67×104Pa×0.3L/0.3L =4.67X104Pa P=P氧+P氮=6.89X104a V氮-0.3L×2.22×104Pa/6.89×104pa=0.097L V氧=0.3L×4.67×104Pa/6.89×104Pa=0.203L
理想气体定律 例题2:在298K时,将压强为3.33×104Pa的 N2 0.2L和压强为4.67×104Pa的O2 0.3升移入0.3升的 真空容器,问混合气体中各组分气体的分压强、分 体积和总压强各为多少? 解:由P1V1 =P2V2 P氮=3.33×104Pa×0.2L/0.3L =2.22×104Pa P氧=4.67×104Pa×0.3L/0.3L =4.67×104Pa Pt =P氧+P氮=6.89×104Pa V氮=0.3L×2.22×104Pa/6.89×104Pa=0.097L V氧=0.3L×4.67×104Pa/6.89×104Pa=0.203L

理想气体定律 例题3:290K1.01×10Pa时,在水面上收集了 0.15LN2。经干燥后重0.172g,求N,的分子量和千燥后 的体积干燥后温度、压强不变)? 解:0.15LN,中有纯N和水蒸气,因此查手册得 290K时饱和水蒸气压=1.93×103Pa,所以: P氮-P总-P水=1.01×105Pa-1.93×103Pa≈1×105Pa PV=nRT-(m/M)RT M氯=nRT/PV =0.172×8.314×290/1×105×0.15×10-3) =28.0(g/mol) ②由P,V=P2'2 1×105×0.15=1.01×105×V2 所以:V,=0.148L
理想气体定律 例题3:290K1.01×105Pa时,在水面上收集了 0.15LN2。经干燥后重0.172g,求N2的分子量和干燥后 的体积(干燥后温度、压强不变)? 解:0.15LN2中有纯N2和水蒸气,因此查手册得 290K时饱和水蒸气压=1.93×103Pa,所以: P氮=P总-P水=1.01×105Pa-1.93×103Pa≈1×105Pa PV=nRT=(m/M)RT M氮=mRT/PV =0.172×8.314×290/(1×105×0.15×10-3 ) =28.0(g/mol ) ②由P1V1 =P2V2 1×105×0.15=1.01×105×V2 所以:V2 =0.148L
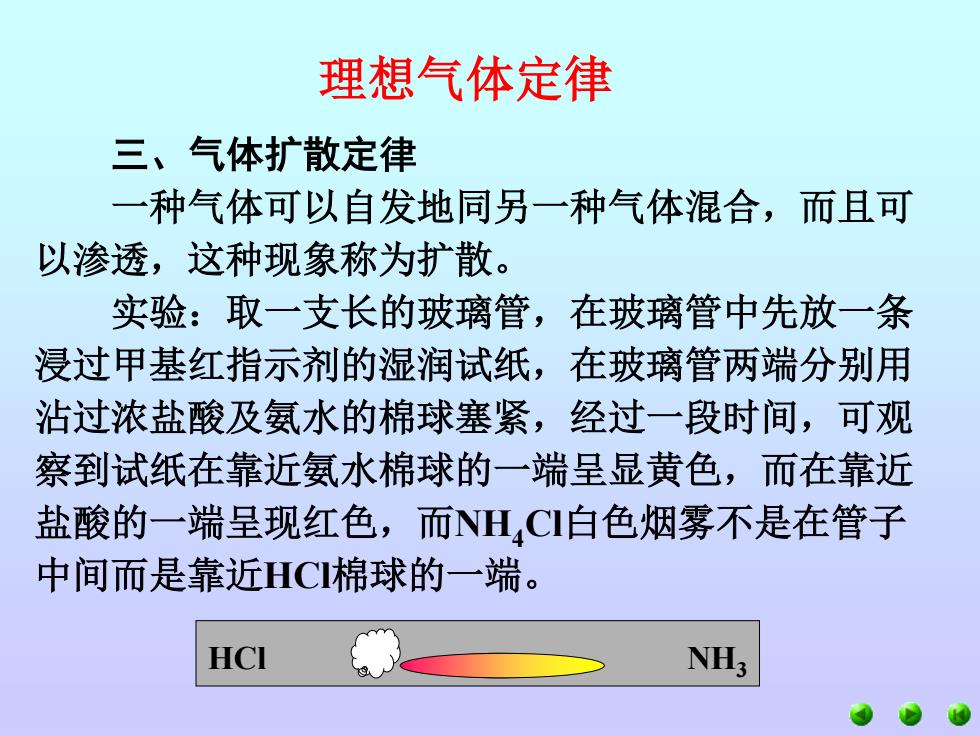
理想气体定律 三、气体扩散定律 一种气体可以自发地同另一种气体混合,而且可 以渗透,这种现象称为扩散。 实验:取一支长的玻璃管,在玻璃管中先放一条 浸过甲基红指示剂的湿润试纸,在玻璃管两端分别用 沾过浓盐酸及氨水的棉球塞紧,经过一段时间,可观 察到试纸在靠近氨水棉球的一端呈显黄色,而在靠近 盐酸的一端呈现红色,而NH,CI白色烟雾不是在管子 中间而是靠近HCI棉球的一端。 HCI NH3
理想气体定律 三、气体扩散定律 一种气体可以自发地同另一种气体混合,而且可 以渗透,这种现象称为扩散。 实验:取一支长的玻璃管,在玻璃管中先放一条 浸过甲基红指示剂的湿润试纸,在玻璃管两端分别用 沾过浓盐酸及氨水的棉球塞紧,经过一段时间,可观 察到试纸在靠近氨水棉球的一端呈显黄色,而在靠近 盐酸的一端呈现红色,而NH4Cl白色烟雾不是在管子 中间而是靠近HCl棉球的一端。 HCl NH3

理想气体定律 由实验我们看到NH,与HC在玻璃管内扩散速度不 同,白色NHCI环出现在HCI的一端。 经实验总结得到下列规律: 在一定温度下,各种不同气体的扩散速率与气体 密度的平方根成反比。称为气体扩散定律。 (因相同温度及相同压强下气体密度与其分子量成 正比) M d☑
理想气体定律 由实验我们看到NH3与HCl在玻璃管内扩散速度不 同,白色NH4Cl环出现在HCl的一端。 经实验总结得到下列规律: 在一定温度下,各种不同气体的扩散速率与气体 密度的平方根成反比。称为气体扩散定律。 (因相同温度及相同压强下气体密度与其分子量成 正比) 1 2 1 2 2 1 M M d d U U

理想气体定律 例题4:某未知气体在扩散仪中以0.01Ls1的速 度扩散,在此扩散仪器内CH,气体以0.03Ls的速 度扩散,计算此未知气体的近似相对分子质量。 解 :CH,的相对分子质量M,=16.04 由: U U, M 0.01 16.4 0.03 M M1=144.36 答:未知气体的近似相对分子质量为144.36
理想气体定律 例题4:某未知气体在扩散仪中以0.01L·s-1的速 度扩散,在此扩散仪器内CH4气体以0.03L·s-1的速 度扩散,计算此未知气体的近似相对分子质量。 解:CH4的相对分子质量M2 =16.04 由: 1 16.4 0.03 0.01 M 1 2 2 1 M M U U M1 =144.36 答:未知气体的近似相对分子质量为144.36