
第七章:化学反应速度 化学反应速度 浓度的影响 反应机理 温度的影 催化剂的影响 本章要求
第七章:化学反应速度 化 学 反 应 速 度 浓 度 的 影 响 作 业 本 章 要 求 反 应 机 理 催 化 剂 的 影 响 温 度 的 影 响

化学反应速度 一、化学反应速度表示法 化学反应速度是用单位时间内反应物浓度的减少 或生成物浓度的增加来表示的:单位用moL1sl、 mol-L-1.min-1、mol-L-1.h-l。 如:某给定温度下,在密闭容器中氮气与氢气反应 生成氨,各物质变化浓度如下: N2+3H2 占 2NH; 起始(molL) 1.03.0 0 3秒后浓度(mol/L)0.7 2.1 0.6 计算该反应速度。(反应速度为正值) 解: (0.7-1.0) =0.1(molL.s) 3
化学反应速度 一、化学反应速度表示法 化学反应速度是用单位时间内反应物浓度的减少 或生成物浓度的增加来表示的:单位用mol·L-1·s-1 、 mol·L-1·min-1 、mol·L-1·h-1 。 如:某给定温度下,在密闭容器中氮气与氢气反应 生成氨,各物质变化浓度如下: N2 + 3H2 2NH3 起始 (mol/L) 1.0 3.0 0 3秒后浓度(mol/L) 0.7 2.1 0.6 计算该反应速度。(反应速度为正值) 解: 0.1(mol L s ) 3 (0.7 1.0) -1 -1 2 vN

化学反应速度 (2.1-3.0) VH2 =0.3(molL'.s) 06-0=02's) 3 且存在着:,=方:=2V, 3 随反应的不断进行,由于反应物的浓度不断减少, 生成物的浓度不断增加,因此,大部分化学反应都不是 等速进行的,因此上述所计算的反应速度是该段时间内 的平均反应速度
化学反应速度 且存在着: 0.3(mol L s ) 3 (2.1 3.0) -1 -1 2 vH 0.2(mol L s ) 3 (0.6 0) -1 -1 3 vN H 2 2 3 2 1 3 1 N H N H v v v 随反应的不断进行,由于反应物的浓度不断减少, 生成物的浓度不断增加,因此,大部分化学反应都不是 等速进行的,因此上述所计算的反应速度是该段时间内 的平均反应速度

化学反应速度 只有在某一瞬间的反应速度才代表化学反应在某 一时刻的真正速度。我们通常说瞬时速度。 即上述反应的瞬时速度可表示为 -dN2] -dH2] d[NH;] VN, dt dt dt 三个速度不同且有:N]=1,-a,]_1.dNH,] dt 3 dt 2 dt 对于反应 aA+bB台dD+eE 1。-d[A]_1。-dB]_1d[D]1dE] ● a dt b dt d dt e dt
化学反应速度 只有在某一瞬间的反应速度才代表化学反应在某 一时刻的真正速度。我们通常说瞬时速度。 即上述反应的瞬时速度可表示为 三个速度不同且有: dt d vN [N ] 2 2 dt d vH [H ] 2 2 dt d vNH [NH ] 3 3 dt d dt d dt d [NH ] 2 [H ] 1 3 [N2 ] 1 2 3 对于反应 aA + bB dD+eE dt d dt e d dt d d dt b d a 1 [A] 1 [B] 1 [D] 1 [E]
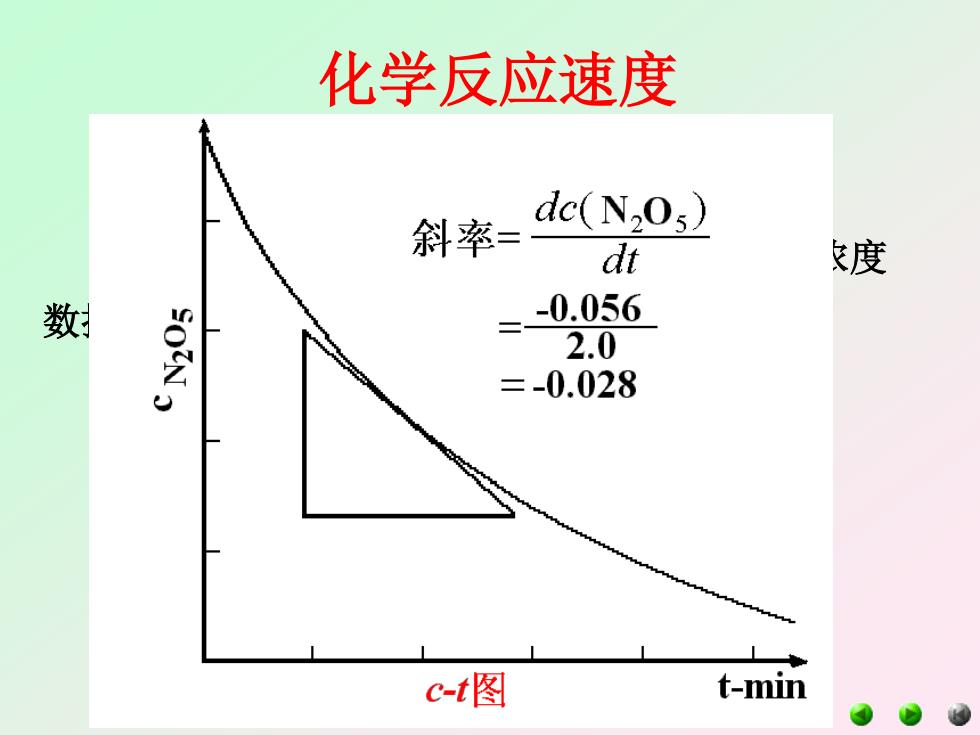
化学反应速度 斜率= dc(N2O3) dt 度 数 -0.056 SOIN 2.0 =-0.028 c-t图 t-min
化学反应速度 二、化学反应速度的实验测定 某种物质在化学反应过程中不同时间下的浓度 数据做c-t曲线 如: 2N2O54NO2 +O2 由实验数据画图然后做任意一点的切线。 这样即可求得任意浓度时的瞬时反应速度。 再根据c-v做图,即可得到速率方程
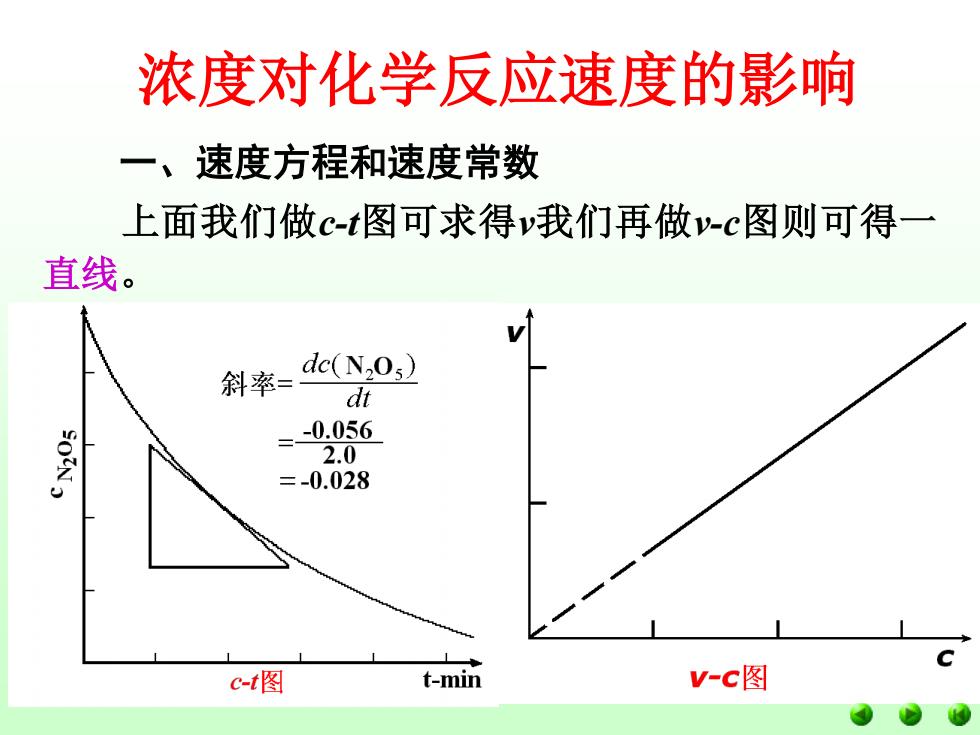
浓度对化学反应速度的影响 一、速度方程和速度常数 上面我们做c-t图可求得我们再做-c图则可得一 直线。 斜率= de(N2O3) dt =-0.056 2.0 =-0.028 c-t图 t-min V-c图
浓度对化学反应速度的影响 一、速度方程和速度常数 上面我们做c-t图可求得v我们再做v-c图则可得一 直线。 即v∝[N2O5 ]或v=k[N2O5 ] 此式称为N2O5的反应速率方程,k为比例系数。 即[N2O5 ]=1mol/L时,v=k。 所以k的物理意义为单位浓度时的反应速度。 k大则v大,k小则v小,k与浓度无关温度升高则k增 大

浓度对化学反应速度的影响 例:340K时[N20]=0.160mo/L,=0.056mo-L1min-1 计算该反应的速度常数及N,0,浓度为0.100mol/L时 的=? 解:①由=kN2Os ∴.k=v/[N20s=0.056/0.160=0.35(min-) ②w=kN20s=0.35×0.100=0.035(moL-1min-) 答:y=0.035moL1min1
浓度对化学反应速度的影响 例:340K时[N2O5 ]=0.160mol/L,v=0.056mol·L-1·min-1 计算该反应的速度常数及N2O5浓度为0.100mol/L时 的v=? 解:①由v=k[N2O5 ] ∴k=v/[N2O5 ]=0.056/0.160=0.35(min-1 ) ②v=k[N2O5 ]=0.35×0.100=0.035(mol·L-1·min-1 ) 答:v=0.035mol·L-1·min-1

浓度对化学反应速度的影响 不同的化学反应有不同的速度方程和速度常数。 只有通过实验才能得到,现在还没有一种理论来推导反 应速度和速度常数。 对于反应 aA+bB===dD+eE 其速度方程一般情况下可表示为:v=kAmB” m、n分别表示A和B的浓度的指数,分别称为反应物A 和B的反应级数。什n该反应的总反应级数
浓度对化学反应速度的影响 不同的化学反应有不同的速度方程和速度常数。 只有通过实验才能得到,现在还没有一种理论来推导反 应速度和速度常数。 对于反应 aA + bB === dD+eE 其速度方程一般情况下可表示为:v=k[A]m·[B]n m、n分别表示A和B的浓度的指数,分别称为反应物A 和B的反应级数。m+n该反应的总反应级数

浓度对化学反应速度的影响 如:2H202=2H20+02 =[H2O21 =1为一级反应 S20g2-+2=2S042-+L2=k[S20g2] =1,n=1,S,0g2、上分别为一级反应 什n=2即整个反应为二级反应。 4HBr+O2===2H2O+2Br2 v=k[HBr][O2] F1,n=1,tn=2
浓度对化学反应速度的影响 如:2H2O2 ===2H2O + O2 v=k[H2O2 ] m=1为一级反应 S2O8 2-+2I - ===2SO4 2-+I2 v=k[S2O8 2- ][I- ] m=1,n=1,S2O8 2-、I -分别为一级反应 m+n=2即整个反应为二级反应。 4HBr+O2 ===2H2O+2Br2 v=k[HBr][O2 ] m=1,n=1,m+n=2

浓度对化学反应速度的影响 2N0+2H2==N2+2H20=kNO]2H2 NO为二级反应,H为一级反应,总反应为三级反应。 CH,CHO--=CH+CO =CHCHO]32 即为32级反应 反应级数不一定是整数,可以是分数,也可以为零。 级数为零的反应叫零级反应。即浓度变化,速度不变。 确定速度方程,必须以实验事实为依据
浓度对化学反应速度的影响 2NO+2H2 ===N2 +2H2O v=k[NO]2 [H2 ] NO为二级反应,H2为一级反应,总反应为三级反应。 CH3CHO===CH4 +CO v=k[CH3CHO]3/2 即为3/2级反应 反应级数不一定是整数,可以是分数,也可以为零。 级数为零的反应叫零级反应。即浓度变化,速度不变。 确定速度方程,必须以实验事实为依据