第四章:化学键与分子结构 高子键 共价键 金属镜 分子间力 本章要 作
第四章:化学键与分 子 结 构 离 子 键 金 属 键 作 业 本 章 要 求 共 价 键 分 子 间 力

4.1离子键理论 一、基本要点 阴阳离子之间用库仑力相互作用形成的化学键叫 做离子键。 离子键的强度应当用拆开(均裂)1摩尔气态 “离子键分子”(例如Na+C)得到气态中性原子(Na和 C)所需要的能量。 如:这样计算得到的NaCl的键能为450kJ/mol。 这说明,离子键的能量数量级与共价键相同,是一种 强相互作用力。不过离子键的键能定义并无多大实用 价值,因为气态离子型分子通常遇不到。 离子键一既没有方向性,又没有饱和性
4.1 离子键理论 一、基本要点 阴阳离子之间用库仑力相互作用形成的化学键叫 做离子键。 离子键的强度应当用拆开(均裂)1摩尔气态 “离子键分子”(例如Na+Cl– )得到气态中性原子(Na和 Cl)所需要的能量。 如:这样计算得到的NaCl的键能为450kJ/mol。 这说明,离子键的能量数量级与共价键相同,是一种 强相互作用力。不过离子键的键能定义并无多大实用 价值,因为气态离子型分子通常遇不到。 离子键—既没有方向性,又没有饱和性

离子键 典型的离子晶体是指由带电的原子一阴离子和 阳离子通过离子键相互作用形成的晶体。 如:KCI晶体中存在K+离子和C离子,K+离子 与C离子之间的相互作用力是离子键。在KC这样的 典型离子晶体中没有分子,只有离子,没有其他化学 键,只有离子键。 但是,完全由单原子离子构成的离子晶体在总量 上并不多,大量离子晶体并非只有离子或只有离子键。 例如,尽管KNO,只有离子一K+离子和NO,离子,它 们之间的化学键是离子键,然而在NO,离子内的化学 作用力却是共价键。 广义地说,所有存在大量阴阳离子的晶体都是离 子晶体
离 子 键 典型的离子晶体是指由带电的原子——阴离子和 阳离子通过离子键相互作用形成的晶体。 如:KCl晶体中存在K+离子和Cl–离子,K+离子 与Cl–离子之间的相互作用力是离子键。在KCl这样的 典型离子晶体中没有分子,只有离子,没有其他化学 键,只有离子键。 但是,完全由单原子离子构成的离子晶体在总量 上并不多,大量离子晶体并非只有离子或只有离子键。 例如,尽管KNO3只有离子—K+离子和NO3 –离子,它 们之间的化学键是离子键,然而在NO3 –离子内的化学 作用力却是共价键。 广义地说,所有存在大量阴阳离子的晶体都是离 子晶体

离子键 二、离子的特征 简单离子可以看成带电的球体,它的特征主要有 离子电荷、离子的电子构型和离子半径3个方面。对 于复杂离子,还要讨论其空间构型等问题。 1、离子电荷 离子电荷是简单离子的核电荷(正电荷)与它的核 外电子的负电荷的代数和。 如:Na+和Ag的离子电荷都是+1,在它们周围 呈现的正电场的强弱不相等,否则难以理解NaC与 AgC在性质上为何有如此巨大的差别。由此可见, 所谓离子电荷,在本质上只是离子的形式电荷。 Na+和Ag+的形式电荷都等于+1,有效电荷(Z*) 却并不相等。不难理解,Ag+离子的有效电荷大大高于 Na+离子。这是由于它们的电子层构型不同
二、离子的特征 简单离子可以看成带电的球体,它的特征主要有 离子电荷、离子的电子构型和离子半径3个方面。对 于复杂离子,还要讨论其空间构型等问题。 1、离子电荷 离子电荷是简单离子的核电荷(正电荷)与它的核 外电子的负电荷的代数和。 如:Na+和Ag+的离子电荷都是+1,在它们周围 呈现的正电场的强弱不相等,否则难以理解NaCl与 AgCl在性质上为何有如此巨大的差别。由此可见, 所谓离子电荷,在本质上只是离子的形式电荷。 Na+和Ag+的形式电荷都等于+1,有效电荷(Z*) 却并不相等。不难理解,Ag+离子的有效电荷大大高于 Na+离子。这是由于它们的电子层构型不同。 离 子键

离子键 2、离子构型 通常把处于基态的离子电子层构型简称为离子构 型。负离子的构型大多数呈稀有气体构型,即最外层 电子数等于8。正离子则较复杂,可分如下5种情况: (1)2e构型:第二周期的正离子的电子层构型为2e 构型,如Li计、Be2+等。 (2)8e构型:从第三周期开始的A、LA族元素正 离子的最外层电子层为8e,简称8e构型,如Na+等; A+也是8e构型;IIB一VIIB族元素的最高价也具有 8e构型不过电荷高于+4的带电原子(如Mn7+)并不 以正离子的方式存在于晶体之中]
离 子键 2、离子构型 通常把处于基态的离子电子层构型简称为离子构 型。负离子的构型大多数呈稀有气体构型,即最外层 电子数等于8。正离子则较复杂,可分如下5种情况: (1)2e构型:第二周期的正离子的电子层构型为2e 构型,如Li+ 、Be2+等。 (2)8e构型:从第三周期开始的IA、IIA族元素正 离子的最外层电子层为8e,简称8e构型,如Na+等; Al3+也是8e构型;IIIB—VIIB族元素的最高价也具有 8e构型[不过电荷高于+4的带电原子(如Mn7+)并不 以正离子的方式存在于晶体之中]

离子键 (3)I8e构型:IB、B族元素表现族价时,如Cut、 Zn2+等,具有18e构型;p区过渡后元素表现族价时, 如Ga3+、Pb4+等也具有18e构型。 (4)9-17e构型:d区元素表现非族价时最外层有9- 17个电子,如Mn2+、Fe2+、Fe3+等。 (⑤)18+2)e构型:p区的金属元素低于族价的正价, 如TI+、Sn2+、Pb2+等,它们的最外层为2e,次外层为 18e,称为18+2e构型。 在离子电荷和离子半径相同的条件下,离子构型 不同,正离子的有效正电荷的强弱不同,顺序为: 8e<9-17e<18e或18+2e 这是由于,电子在核外空间的概率分布比较松散, 对核内正电荷的屏蔽作用较小,所以电子越多,离子 的有效正电荷越大
(3)18e构型:IB、IIB族元素表现族价时,如Cu+ 、 Zn2+等,具有18e构型;p区过渡后元素表现族价时, 如Ga3+ 、Pb4+等也具有18e构型。 (4)9-17e构型:d区元素表现非族价时最外层有9- 17个电子,如Mn2+ 、Fe2+ 、Fe3+等。 (5)(18+2)e构型:p区的金属元素低于族价的正价, 如Tl+ 、Sn2+ 、Pb2+等,它们的最外层为2e,次外层为 18e,称为18+2e构型。 在离子电荷和离子半径相同的条件下,离子构型 不同,正离子的有效正电荷的强弱不同,顺序为: 8e<9-17e<18e或18+2e 这是由于,d电子在核外空间的概率分布比较松散, 对核内正电荷的屏蔽作用较小,所以d电子越多,离子 的有效正电荷越大。 离 子键

离子键 3、离子半径 离子半径是根据实验测定离子晶体中正负离子 平衡核间距估算得出的。离子晶体的核间距可用 X一射线衍射的实验方法十分精确地测定出来,但 单有核间距不行,必须先给定其中一种离子的半径, 才能算出另一种离子的半径。 1927年,泡林认为哥尔智密特标度的基础数据 之一一氧离子的半径为132pm,小于氟离子半径 (133pm),不合理,另外提出一套推算离子半径 的理论方法,最终将氧离子的半径定为140pm,氟 离子半径定为136pm,以此为基础,得出另一套离 子半径数据,即泡林(离子)半径
3、离子半径 离子半径是根据实验测定离子晶体中正负离子 平衡核间距估算得出的。离子晶体的核间距可用 X—射线衍射的实验方法十分精确地测定出来,但 单有核间距不行,必须先给定其中一种离子的半径, 才能算出另一种离子的半径。 1927年,泡林认为哥尔智密特标度的基础数据 之一—氧离子的半径为132pm,小于氟离子半径 (133pm),不合理,另外提出一套推算离子半径 的理论方法,最终将氧离子的半径定为140pm,氟 离子半径定为136pm,以此为基础,得出另一套离 子半径数据,即泡林(离子)半径。 离 子键

离子键 泡林半径的思想大致有如下三个要点: (1)具有相同电子层构型的离子半径随核电荷增 大成比例地缩小。例如,泡林认为,Na+离子和F 离子的电子层构型都是1s22s22p,核电荷数分别为 +11和+9,前者比后者大30%,因而前者的半径也 应该相应比后者缩小30%。经测定NaF晶体中阴阳 离子的平衡核间距为231pm,按这种假设: rNa=(1-30%)rF-)=0.7r(F-) r(Na+)+r(F-)-231pm 1.7rf-)=231pm 即:rf=136 rNa+)=95pm
离 子键 泡林半径的思想大致有如下三个要点: (1)具有相同电子层构型的离子半径随核电荷增 大成比例地缩小。例如,泡林认为,Na+离子和F– 离子的电子层构型都是1s22s22p6,核电荷数分别为 +11和+9,前者比后者大30%,因而前者的半径也 应该相应比后者缩小30%。经测定NaF晶体中阴阳 离子的平衡核间距为231pm,按这种假设: r(Na+ )=(1-30%)r(F-)=0.7r(F-) r(Na+)+r(F-)=231pm 1.7r(F-)=231pm 即:r(F-)=136 r(Na+)=95pm

离子键 (2)测得KC1晶体中阴阳离子核间距为314pm,但 与K+和C同构型的Ar的主量子数为3,大于与Na、F 同构型的Ne的主量子数,K+与C半径比应跟Na+与F 的半径比有所不同,要作适当修正(约26.5%),泡林 修正的结果为133和181pm。以此为基准,泡林根据实 验测得的晶胞参数推出大量8构型离子的半径。 (3)泡林又对非8构型离子的半径作适当修正,得 出非8e构型离子的半径。这是因为非8e构型的离子比 起8e构型的离子有较大的有效核电荷,将使核间距相 应缩小些
离 子键 (2)测得KCl晶体中阴阳离子核间距为314pm,但 与K+和Cl–同构型的Ar的主量子数为3,大于与Na、F 同构型的Ne的主量子数,K+与Cl–半径比应跟Na+与F– 的半径比有所不同,要作适当修正(约26.5%),泡林 修正的结果为133和181pm。以此为基准,泡林根据实 验测得的晶胞参数推出大量8e构型离子的半径。 (3)泡林又对非8e构型离子的半径作适当修正,得 出非8e构型离子的半径。这是因为非8e构型的离子比 起8e构型的离子有较大的有效核电荷,将使核间距相 应缩小些
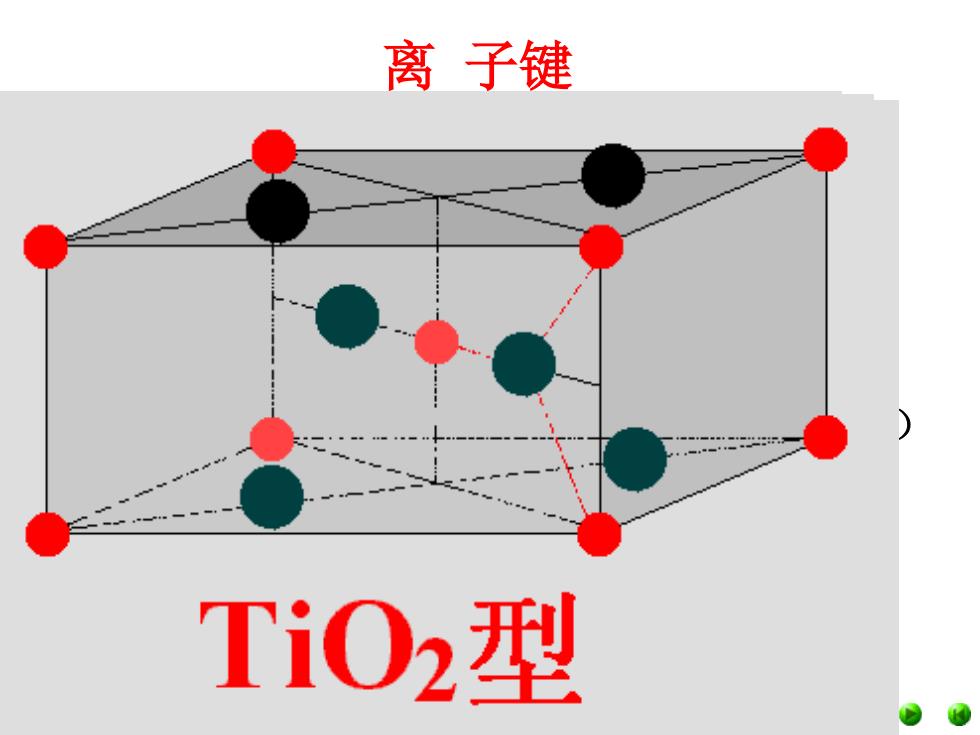
离子键 Ti02型
离 子键 三、离子晶体结构模型 1、概述 CsCl(氯化铯)配位数8:8、NaCl(岩盐)配 位数6:6、ZnS(闪锌矿)配位数4:4、CaF2(萤石) 配位数8:4和TiO2(金红石)配位数6:3,是最具有 代表性的离子晶体结构类型,许多离子晶体或与 它们结构相同,或是它们的变形