碳硅硼 碳 硅 作 碳族元素通性 错分族 碳硅硼化物 无机化合物的水解性 本章要求
碳 硅 硼 碳族元素通性 碳 锗分族 无机化合物的水解性 作业 本章要求 硅 碳硅硼化物

碳族元素 碳、硅属于同一族,有 表中处于对角线位置,也有 放在一起讨论。 碳(Carbon) 是有机世! 链的能力最强,因此碳的化 硅(Silicon) 贝采利乌其 (石头)中译为“矽”,因 硅是无机世界的主角,二氧 分。 贝采利乌斯,JJ
碳、硅属于同一族,有相似性。而硼和硅在周期 表中处于对角线位置,也有相似性,所以本章将它们 放在一起讨论。 碳(Carbon) 是有机世界的主角,由于碳自相成 链的能力最强,因此碳的化合物是最多的。 硅(Silicon) 贝采利乌斯1823年发现,拉丁文 (石头)中译为“矽”,因与锡同音,改为“硅”。 硅是无机世界的主角,二氧化硅是构成地壳的主要成 分。 碳族元素的通性
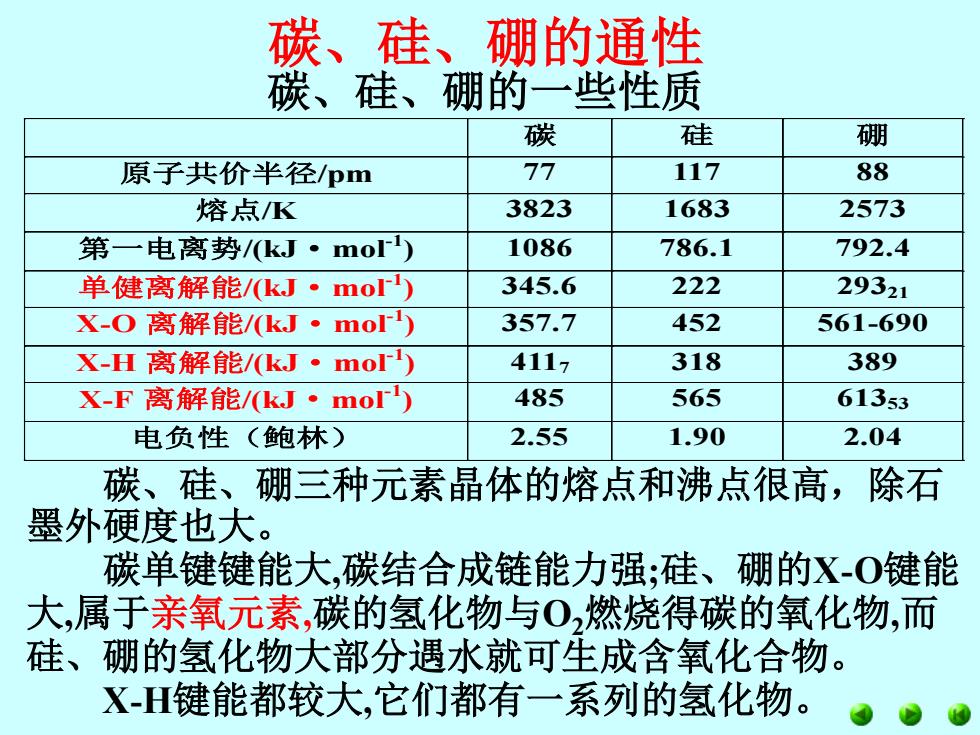
碳、硅、硼的通性 碳、硅、硼的一些性质 碳 硅 硼 原子共价半径pm 77 117 88 熔点K 3823 1683 2573 第一电离势/(kJ·mor) 1086 786.1 792.4 单健离解能/kJ·mo) 345.6 222 29321 X-O离解能/(kJ·mo) 357.7 452 561-690 x-H离解能/kJ·mo) 4117 318 389 x-F离解能/kJ·mo 485 565 61353 电负性(鲍林) 2.55 1.90 2.04 碳、硅、硼三种元素晶体的熔点和沸点很高,除石 墨外硬度也大。 碳单键键能大,碳结合成链能力强;硅、硼的X-O键能 大,属于亲氧元素,碳的氢化物与0,燃烧得碳的氧化物,而 硅、硼的氢化物大部分遇水就可生成含氧化合物。 XH键能都较大,它们都有一系列的氢化物
碳、硅、硼的通性 碳 硅 硼 原子共价半径/pm 77 117 88 熔点/K 3823 1683 2573 第一电离势/(kJ·mol-1 ) 1086 786.1 792.4 单健离解能/(kJ·mol-1 ) 345.6 222 29321 X-O 离解能/(kJ·mol-1 ) 357.7 452 561-690 X-H 离解能/(kJ·mol-1 ) 4117 318 389 X-F 离解能/(kJ·mol-1 ) 485 565 61353 电负性(鲍林) 2.55 1.90 2.04 碳、硅、硼三种元素晶体的熔点和沸点很高,除石 墨外硬度也大。 碳单键键能大,碳结合成链能力强;硅、硼的X-O键能 大,属于亲氧元素,碳的氢化物与O2燃烧得碳的氧化物,而 硅、硼的氢化物大部分遇水就可生成含氧化合物。 X-H键能都较大,它们都有一系列的氢化物。 碳、硅、硼的一些性质

碳、硅、硼的通性 碳、硅、硼的氧化态 电子构型 常见氧化态 c [He]2s22p2 -2,-4,0,+2,+4 Si [Ne]3s23p2 -4,0,+2.+4 B [He]2s22p Q,+3
碳、硅、硼的通性 电子构型 常见氧化态 C [He]2s22p2 -2,-4,0,+2,+4 Si [Ne]3s23p2 -4,0,+2,+4 B [He]2s22p1 0,+3 碳、硅、硼的氧化态

碳、硅、硼的通性 碳、硅的成键特征: 碳与硅的价电子构型为ns2np2,价电子数目与价 电子轨道数相等,它们被称为等电子原子。 硼的价电子构型为2s22p',价电子数少于价电子 轨道数,所以它是缺电子原子。 碳和硅可以用sp、Sp2和sp杂化轨道形成2到4个 σ键。碳的原子半径小,还能形成p元-pπ键,所以碳 能形成多重键(双键或叁键),硅的半径大,不易形成 pπ-pπ键,所以Si的sp和sp态不稳定,很难形成多 重键双键或叁键)
碳、硅、硼的通性 碳、硅的成键特征: 碳与硅的价电子构型为ns2np2 ,价电子数目与价 电子轨道数相等,它们被称为等电子原子。 硼的价电子构型为2s22p1 ,价电子数少于价电子 轨道数,所以它是缺电子原子。 碳和硅可以用sp、sp2和sp3杂化轨道形成2到4个 s键。碳的原子半径小,还能形成pp-pp键,所以碳 能形成多重键(双键或叁键),硅的半径大,不易形成 pp-pp键,所以Si的sp和sp2态不稳定,很难形成多 重键(双键或叁键)

碳 碳的杂化与成键特征 同素异性体 等电子体原理 氧化 物 碳酸和碳酸盐 碳的硫化物和卤化物
碳的杂化与成键特征 碳的硫化物和卤化物 同素异性体 等电子体原理 氧 化 物 碳酸和碳酸盐 碳

碳的杂化与特性 碳的杂化类型 Sp3 四面体 金刚石 CH sp2 平面三角形 石墨 C032 C6H6 Sp直线形 C02 CS2 C2H2 二、碳的特性 碳在同族元素中,由于它的原子半径最小,电负 性最大,电离能也最高,又没有d轨道,所以它与本 族其它元素之间的差异较大(p区第二周期的元素都 有此特点)。这差异主要表现在: (1)它的最高配位数为4, (2)碳的成链能力最强; (3)不但碳原子间易形成多重键,而且能与其它元 素如氮、氧、硫和磷形成多重键。 后二点是碳化合物特别多的原因
碳的杂化与特性 一、碳的杂化类型 sp3 四面体 金刚石 CH4 sp2 平面三角形 石墨 CO3 2- C6H6 sp 直线形 CO2 CS2 C2H2 二、碳的特性 碳在同族元素中,由于它的原子半径最小,电负 性最大,电离能也最高,又没有d轨道,所以它与本 族其它元素之间的差异较大(p区第二周期的元素都 有此特点)。这差异主要表现在: (1)它的最高配位数为4, (2)碳的成链能力最强; (3)不但碳原子间易形成多重键,而且能与其它元 素如氮、氧、硫和磷形成多重键。 后二点是碳化合物特别多的原因

碳的杂化与特性 传统的价键理论将受到挑战 美国Geogia大学量子化学计算中心主任 Schaefert的最新计算结果表明,有可能存在呈八 面体的CLi6分子,该分子的碳原子周围总共有10 个电子,用以与6个锂原子形成6个化学键
碳的杂化与特性 传统的价键理论将受到挑战 美国Geogia大学量子化学计算中心主任 Schaefer的最新计算结果表明,有可能存在呈八 面体的CLi6分子,该分子的碳原子周围总共有10 个电子,用以与6个锂原子形成6个化学键

碳的同素异性体 碳有金刚石 木炭)本质上虹 金 金刚石的燃烧 个碳原了 形成一种 使得金刚 在工业上 合成刚 20世纪50年 20世纪80年 20世纪90年
合成金刚石的新方法。 20世纪50年代高温高压石墨转化为金刚石。 一、金刚石 金刚石的外观是无色透明的固体,为原子晶体,每 个碳原了都以sp3杂化轨道和其它四个原子形成共价键, 形成一种网状的巨形分于,再由于C一C键的键能相当高, 使得金刚石的硬度非常大,分子中没有自由电子,不导电; 在工业上可用于刀具来切割金属及制造高档装饰品。 碳的同素异性体 碳有金刚石和石墨C60等同素异性体。无定形炭(如 木炭)本质上都是纯度不等的石墨微晶。 20世纪80年代微波炉中烃分解为金刚石。 20世纪90年代CCl4+Na得到金刚石微晶
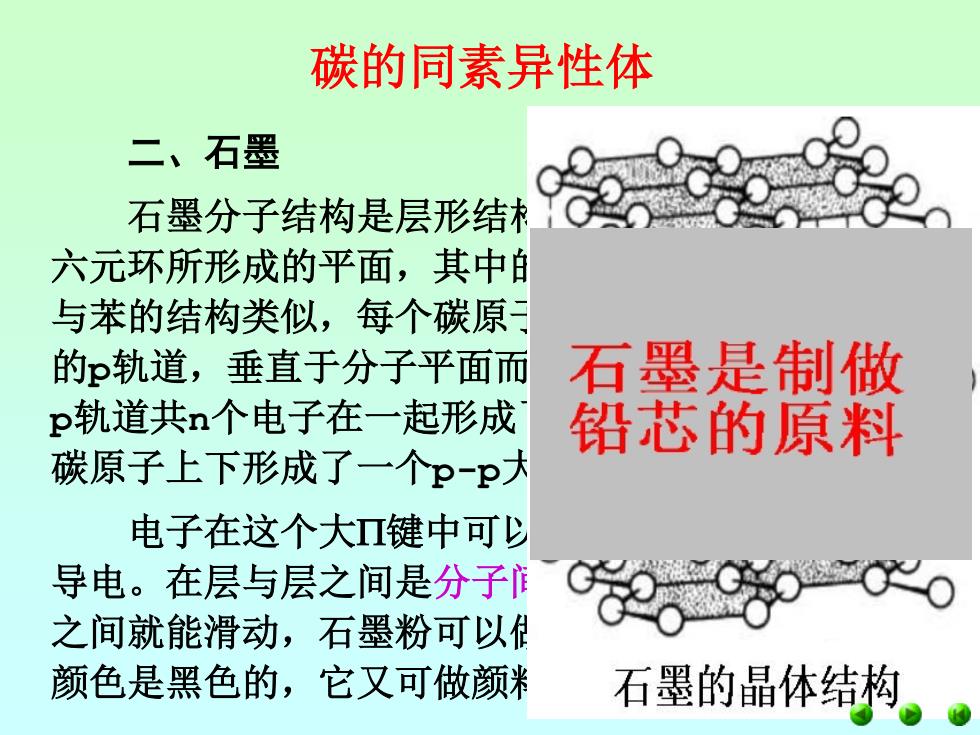
碳的同素异性体 二、石墨 石墨分子结构是层形结 六元环所形成的平面,其中 与苯的结构类似,每个碳原 的p轨道,垂直于分子平面而 石墨是制做 p轨道共n个电子在一起形成 铅芯的原料 碳原子上下形成了一个P-P大 电子在这个大Ⅱ键中可少 导电。在层与层之间是分子 之间就能滑动,石墨粉可以付 颜色是黑色的,它又可做颜米 石墨的晶体结构
碳的同素异性体 二、石墨 石墨分子结构是层形结构,每层是由无限个碳 六元环所形成的平面,其中的碳原子取sp2杂化, 与苯的结构类似,每个碳原子尚余一个未参与杂化 的p轨道,垂直于分子平面而相互平行。平行的n个 p轨道共n个电子在一起形成了弥散在整个层的n个 碳原子上下形成了一个p-p大键。 电子在这个大键中可以自由移动,即石墨能 导电。在层与层之间是分子间作用力,因此层与层 之间就能滑动,石墨粉可以做润滑剂,再加上它的 颜色是黑色的,它又可做颜料和铅笔芯