第五章:氢稀有气体 氢 稀有气体 本章要求 作 业
第五章:氢 稀有气体 氢 稀 有 气 体 作 业 本 章 要 求

5.1氢 自学:(要求) 1、氢的三种同位素是什么? 2、对氢气吸附最显著的金属是什么? 3、什么是正氢和仲氢? 4、氢可失或得一个电子也可与其它非金属共 用电子对等而形成氢化物,试总结“氢化物
自学:(要求) 1、氢的三种同位素是什么? 2、对氢气吸附最显著的金属是什么? 3、什么是正氢和仲氢? 4、氢可失或得一个电子也可与其它非金属共 用电子对等而形成氢化物,试总结“氢化物”。 5.1 氢

稀有气体 一、稀有气体发现简史(自学) 二、稀有气体的性质和用途(自学) 要求: 1、稀有气体分离的重要依据是什么? 2、“人造空气”是什么? 3、做霓红灯要用哪种稀有气体、常用哪种稀有气 体做保护气体? 4、什么灯是“人造小太阳”。 三、稀有气体的存在和分离(自学)
稀有气体 一、稀有气体发现简史(自学) 二、稀有气体的性质和用途(自学) 要求: 1、稀有气体分离的重要依据是什么? 2、 “人造空气”是什么? 3、做霓红灯要用哪种稀有气体、常用哪种稀有气 体做保护气体? 4、什么灯是“人造小太阳” 。 三、稀有气体的存在和分离(自学)

稀有气体 四、稀有气体化合物 零族元素的确认在发现周期系之后,曾长期叫惰性 气体(inert gases),直到1962年英国化学家巴特列在 室温下第一次合成出真正的化合物XePtF6: Xe(g)+PtF(g)==XePtF(s,桔红色晶体) 第一个rare gas compound被合成,inert gases的神话 从此被打破。改称稀有气体(noble gasesi或rare gases)。 早在1960年巴特列通过实验发现了强氧化性的 PF(g)可以将02分子氧化成O2PF6。他考虑到Xe与02 分子的电离能相近(1xe=1170KJ/mol,11o1164KJ/mol), 还有O2+与Xe+的半径也大致相似。因此,如果有 XεPtF6,其晶格能亦与O2PtF,的相似,估计PP6(g)可 以将氙氧化
稀有气体 四、稀有气体化合物 零族元素的确认在发现周期系之后,曾长期叫惰性 气体(inert gases),直到1962年英国化学家巴特列在 室温下第一次合成出真正的化合物XePtF6: Xe(g)+PtF6 (g)===XePtF6 (s,桔红色晶体) 第一个rare gas compound被合成,inert gases的神话 从此被打破。改称稀有气体(noble gases或rare gases)。 早在1960年巴特列通过实验发现了强氧化性的 PtF6 (g)可以将O2分子氧化成O2 +PtF6 -。他考虑到Xe与O2 分子的电离能相近(I1Xe=1170KJ/mol,I1O2=1164 KJ/mol), 还有O2 +与Xe+的半径也大致相似。因此,如果有 XePtF6,其晶格能亦与O2PtF6的相似,估计PtF6 (g)可 以将氙氧化
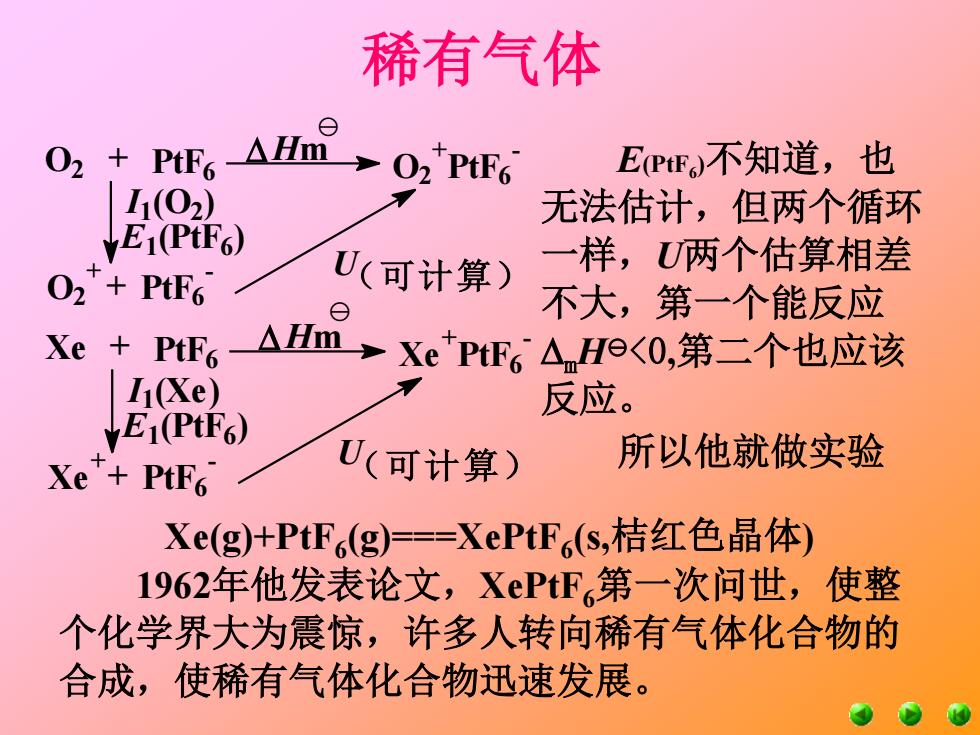
稀有气体 021 + PtE6AH→O2tPtE6 EPF不知道,也 I1(02) 无法估计,但两个循环 E1(PtF6) U(可计算) 一样,两个估算相差 O2+PtF 不大,第一个能反应 Xe PtF6 △Hm XePtF6△He<O,第二个也应该 I(Xe) 反应。 E1(PtF) 所以他就做实验 Xe+PtF U(可计算) Xe(g+PtF6(g)==XePtF(s,桔红色晶体) 1962年他发表论文,XεPtF第一次问世,使整 个化学界大为震惊,许多人转向稀有气体化合物的 合成,使稀有气体化合物迅速发展
稀有气体 Xe(g)+PtF6 (g)===XePtF6 (s,桔红色晶体) 1962年他发表论文,XePtF6第一次问世,使整 个化学界大为震惊,许多人转向稀有气体化合物的 合成,使稀有气体化合物迅速发展。 E(PtF6 )不知道,也 无法估计,但两个循环 一样,U两个估算相差 不大,第一个能反应 mH<0,第二个也应该 反应。 所以他就做实验 (可计算) O2 PtF6 O2 + PtF6 - O2 + PtF6 - U I1(O2) E1 (PtF6 ) + + Hm (可计算) Xe PtF6 Xe + PtF6 - Xe + PtF6 - U I1(Xe) E1 (PtF6 ) + + Hm

稀有气体 1、氟化物 在一定条件下氟与X有下列反应 F2tXe(过量)→XeF2 F2+Xe(少量)→XeF4 F,+Xe(少量)→XeFG XeF,是强氧化剂,不太稳定。 2XeF2+2H,0-==2Xe+4HF+02 XeF2+2KCl--=Xe+2KF+CI, 4XeF4+8H20===2Xe03+2Xe+02+16HF XeF+3H2O-==XeO3+6HF
1、氟化物 在一定条件下氟与Xe有下列反应 F2+Xe(过量)→XeF2 F2+Xe(少量)→XeF4 F2+Xe(少量)→XeF6 XeF2是强氧化剂,不太稳定。 2XeF2+2H2O===2Xe+4HF+O2 XeF2+2KCl===Xe+2KF+Cl2 4XeF4+8H2O===2XeO3+2Xe+O2+16HF XeF6+3H2O===XeO3+6HF 稀有气体

稀有气体 2、氧付 氢稀有气体 XeO3: 物,具有 强氧化性。 Xe04: 卡化合物。 氙的化 况被还原 为单质。 3、稀有气体化合物的结构(自学P232)
2、氧化物 XeO3:是一种易潮解和易爆炸的化合物,具有 强氧化性。 XeO4:很不稳定,具有爆炸性的气态化合物。 氙的化合物,都是强氧化剂,一般情况被还原 为单质。 3、稀有气体化合物的结构(自学P232) 稀有气体 氢 稀有气体 氢 稀 有 气 体 作 业 本 章 要 求

新化合物 稀有气体化合物已经合成几百种了。其中的化 学键类型十分丰富,Xe-F、Xe-O、Xe-N、Kr-F、 Kr-O、K-N等。赫尔辛基大学报道了首例氩化合 物《HArF的合成》 (C&EN 2000 Aug 28 Nature 406,874(2000)。HArF在27K以下可稳定存在。为 合成氖和氦的化合物带来希望
新化合物 稀有气体化合物已经合成几百种了。其中的化 学键类型十分丰富,Xe-F、Xe-O、Xe-N、Kr-F、 Kr-O、Kr-N等。赫尔辛基大学报道了首例氩化合 物《HArF的合成》(C&EN 2000 Aug 28 Nature 406,874(2000))。HArF在27K以下可稳定存在。为 合成氖和氦的化合物带来希望

基本要求 1.氢的物理性质与化学性质。 2.了解稀有气体的发现简史。 3.掌握稀有气体单质,化合物的性质及 其结构特点。 4.了解稀有气体的用途。 5.稀有气体化合物及其结构
基本要求 1.氢的物理性质与化学性质。 2.了解稀有气体的发现简史。 3.掌握稀有气体单质,化合物的性质及 其结构特点。 4.了解稀有气体的用途。 5.稀有气体化合物及其结构