氮族元素 氮族通性 氮及其化合物 磷及其化合物 砷锅 盐类的热分解 本章要求
氮族元素 氮 族 通 性 氮 及 其 化 合 物 磷 及 其 化 合 物 砷 锑 铋 盐 类 的 热 分 解 作 业 本 章 要 求

氮族通性 化基本上 髯铋的一 勺对象。 )、磷 )和铋 舍勒(用 舍勤,CW. 验的仪器
在非金属化学中,氮族元性质的变化基本上 是规律的,是由典型非金属氮到典型金属铋的一 个完整过渡,因此往往被选为系统研究的对象。 周期系第VA族元素,包括了氮(Nitrogen)、磷 (Phosphorus)、砷(Arsenic)、锑(Stibium)和铋 (Bismuth)。 一、元素的发现 氮由英-卢塞福、普利斯特里、瑞典-舍勒(用 NaOH除空气中的CO2,P除O2)所发现。 氮族通性

氮族通性 第一个发现磷的是德国的波兰特,他听到一“尿 里可制得黄金”这样一句传说。他就抱着发财的目地, 用尿做了大量实验,1669年他在一次实验中用砂、木 炭、石灰等和尿混合,加热蒸馏,虽没得到黄金却意 外地得到一种美丽的物质,它色白质软,在黑暗的地 方能发光,取名“冷光”,起初他极守密,不过此消 息立刻传遍了德国。 砷是由中国的炼丹家葛洪发现的(317年),德 国的A.Magnus在(1250年)也得到了砷。 锑是古代发现的。 铋是由法国的C.J.Geoffroy.从铅中分离得到的
氮族通性 第一个发现磷的是德国的波兰特,他听到-“尿 里可制得黄金”这样一句传说。他就抱着发财的目地, 用尿做了大量实验,1669年他在一次实验中用砂、木 炭、石灰等和尿混合,加热蒸馏,虽没得到黄金却意 外地得到一种美丽的物质,它色白质软,在黑暗的地 方能发光,取名“冷光”,起初他极守密,不过此消 息立刻传遍了德国。 砷是由中国的炼丹家葛洪发现的(317年),德 国的A.Magnus在(1250年)也得到了砷。 锑是古代发现的。 铋是由法国的C.J.Geoffroy从铅中分离得到的
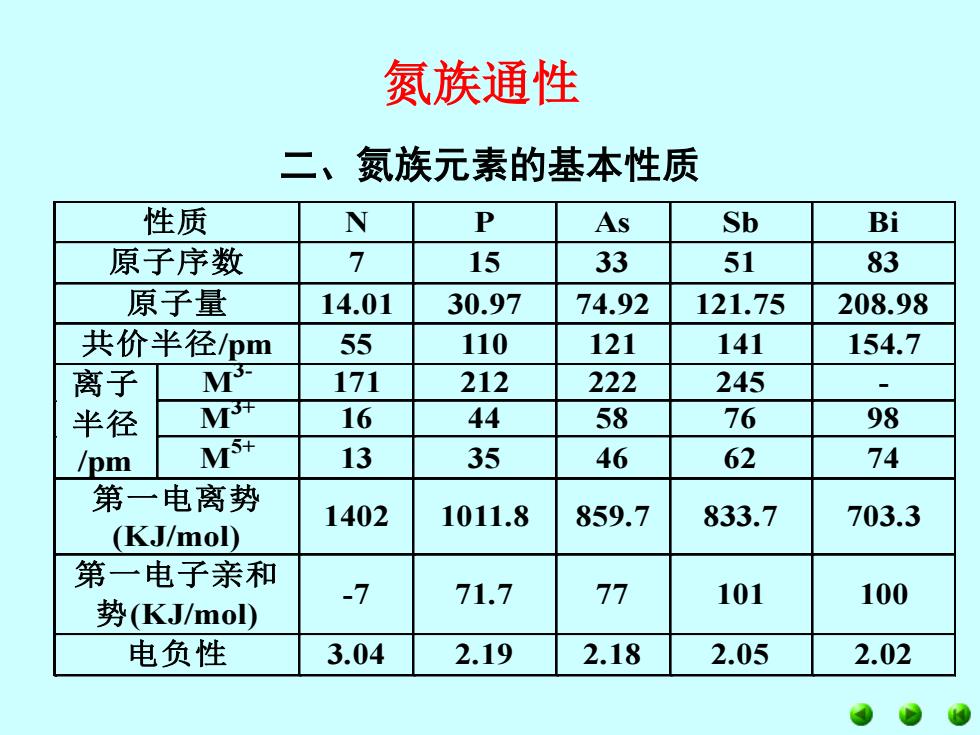
氮族通性 二、氮族元素的基本性质 性质 N P As Sb Bi 原子序数 7 15 33 51 83 原子量 14.01 30.97 74.92 121.75 208.98 共价半径pm 55 110 121 141 154.7 离子 T 171 212 222 245 - 半径 T 16 44 58 76 98 /pm MS 13 35 46 62 74 第一电离势 1402 1011.8 859.7 833.7 703.3 (KJ/mol) 第一电子亲和 -7 71.7 77 101 100 势(KJ/mol) 电负性 3.04 2.19 2.18 2.05 2.02
氮族通性 性 质 N P As Sb B i 原子序数 7 15 33 51 83 原子量 14.01 30.97 74.92 121.75 208.98 共价半径/pm 55 110 121 141 154.7 M 3- 171 212 222 245 - M 3+ 16 44 58 76 98 离 子 半 径 /pm M 5+ 13 35 46 62 74 第一电离势 (KJ/mol) 1402 1011.8 859.7 833.7 703.3 第一电子亲和 势(KJ/mol) -7 71.7 77 101 100 电负性 3.04 2.19 2.18 2.05 2.02 二、氮族元素的基本性质

氮族通性 三、氮族元素的氧化态 电子构型 氧化态 N [He]2s22p3 -3-2,-1,0,+1,+2,+3,+4,+5 P [Ne]3s23p3 -3,0,+3,+5 As [Ar]4s24p3 -3,0,+3,+5 Sb [Kr]5s25p3 -3,0,+3.+5 Bi [Xe]6s26p3 0,+3,+5
氮族通性 电子构型 氧化态 N [He]2s 22p 3 -3-2,-1,0,+1,+2,+3,+4,+5 P [Ne]3s 23p 3 -3,0,+3,+5 As [Ar]4s 24p 3 -3,0,+3,+5 Sb [Kr]5s 25p 3 -3,0,+3,+5 Bi [Xe]6s 26p 3 0,+3,+5 三、氮族元素的氧化态

氮族通性 四、氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较,它们 若要获得三个电子而形成-Ⅲ价的离子是较困难的, 只有电负性较大的N、P能形成极少数-Ⅲ价的离子型 化合物,LiN、Mg3N2、Na3P、Ca3P,等,由于N3-、 P3离子半径大容易变型,遇水强烈水解生成NH和 PH3如: Mg3N2+6H2O===3Mg(OH)2+3NH3T Na3P+3H2O===3NaOH+3PH3T 本族元素形成正价的趋势较强,如NF3、PBrs AsFs、SbCIs、BiCL3、SbCl等,形成共价化合物是 本族元素的特征
氮族通性 四、氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较,它们 若要获得三个电子而形成-Ⅲ价的离子是较困难的, 只有电负性较大的N、P能形成极少数-Ⅲ价的离子型 化合物,Li3N、Mg3N2、Na3P、Ca3P2等,由于N3-、 P3-离子半径大容易变型,遇水强烈水解生成NH3和 PH3如: Mg3N2+6H2O===3Mg(OH)2+3NH3 Na3P+3H2O===3NaOH+3PH3 本族元素形成正价的趋势较强,如NF3、PBr5、 AsF5、SbCl5、BiCl3、SbCl3等,形成共价化合物是 本族元素的特征

氮族通性 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态 的稳定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到 铋+V氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而 +V氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳 定,几乎不显还原性
氮族通性 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态 的稳定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到 铋+V氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而 +V氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳 定,几乎不显还原性

氨及其化合物 氮 氨 氨的衍生物 氮的氧化物 亚硝酸及其盐 硝酸及其盐 光化学烟雾
氮及其化合物 氮 光 化 学 烟 雾 氨 氨 的 衍 生 物 氮 的 氧 化 物 亚硝酸及其盐 硝 酸 及 其 盐
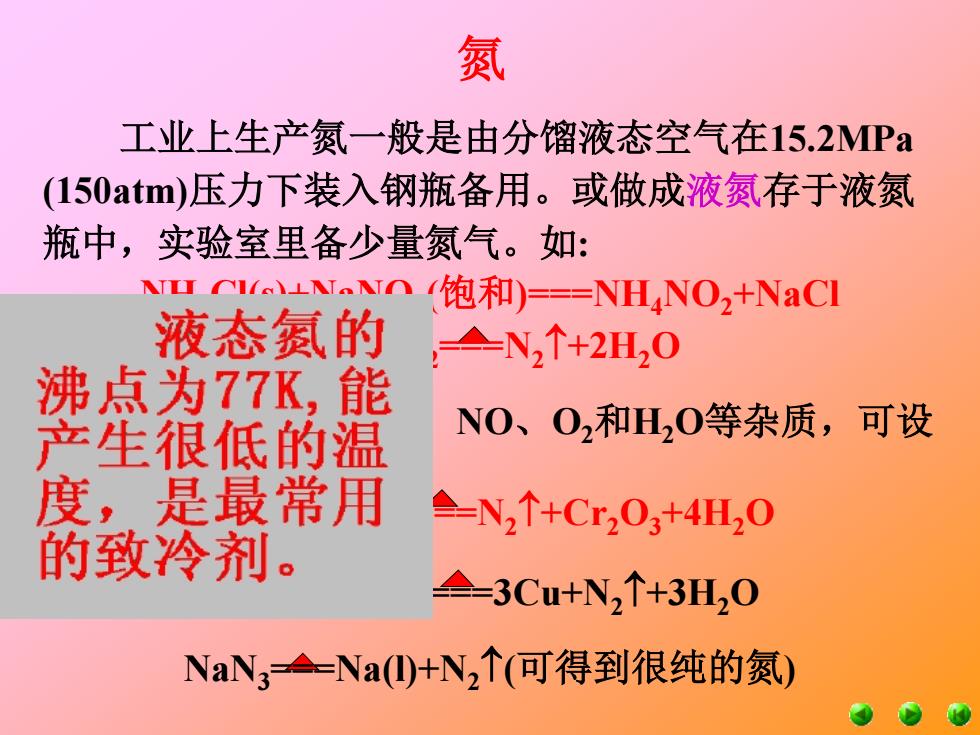
氮 工业上生产氮一般是由分馏液态空气在15.2MPa (150atm)压力下装入钢瓶备用。或做成液氮存于液氮 瓶中,实验室里备少量氮气。如: NuNn饱和)==NHNO2+NaCl 液态氨的 ,N2↑+2H20 沸点为77K,能 产生很低的温 NO、O2和H,0等杂质,可设 度,是最常用 △-N2↑+Cr203+4H20 的致冷剂。 =3Cu+N2↑+3H20 NaN3=Na①⑩+N2↑(可得到很纯的氮)
氮 工业上生产氮一般是由分馏液态空气在15.2MPa (150atm)压力下装入钢瓶备用。或做成液氮存于液氮 瓶中,实验室里备少量氮气。如: NaN3===Na(l)+N2(可得到很纯的氮) 产物中有少量NH3、NO、O2和H2O等杂质,可设 法除去。 (NH4 )2Cr2O7===N2+Cr2O3+4H2O 2NH3+3CuO===3Cu+N2+3H2O NH4Cl(s)+NaNO2 (饱和)===NH4NO2+NaCl NH4NO2===N2+2H2O

氮 氮原子间能形成多重键,因而能生成本族其它元 素所没有的化合物如叠氮化物N3),偶氮化合物(一N =N一)等。由于N2的键能很大(946kJmo),加热到 3273K时,只有0.1%离解。 N2在常温下就和锂直接反应生成Li,N,在高温时 不但能和镁、钙、铝、硼、硅等化合生成氮化物,而 且能与氧、氢直接化合。 因的原子半径小、又没有d轨道可供成键,所以 N在化合物中的配位数最多不超过4
氮 氮原子间能形成多重键,因而能生成本族其它元 素所没有的化合物如叠氮化物(N3 - ),偶氮化合物(—N =N—)等。由于N2的键能很大(946kJ·mol-1 ),加热到 3273K时,只有0.1%离解。 N2在常温下就和锂直接反应生成Li3N,在高温时 不但能和镁、钙、铝、硼、硅等化合生成氮化物,而 且能与氧、氢直接化合。 因N的原子半径小、又没有d轨道可供成键,所以 N在化合物中的配位数最多不超过4