
镧系元素和锕系元素 彌系元素 铜系元素 本章要求 变
概 述 镧 系 元 素 作 业 本 章 要 求 锕 系 元 素 镧系元素和锕系元素
元素周期表 IA 0 H 2 He 氢 IIA IIIA IVA VA VIA VIIA 2 3 Li 4 Be 5 B 6 8 0 9 H 10 Ne 锂 铍 碳 氮 氧 氟 氖 11 Na 12 Mg 15P 16S 18 Ar 3 17C1 钠 镁 IIIB IVB VB VIB VIIB VIII IB IIB 铝 硅 磷 硫 氯 氩 19K 20Ca 21 Sc 22 Til 23V 24Cr 25 Mn 26 Fe 28 Ni 29 Cu 307n 31 Ga 32 Ge 33 As 34 Se 35 Br 36K1 4 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 37 Rb 38 Sr 39Y 407r 41 Nb 42M0 43 Tcl 44R1L 45 Rh 46 Pd 47 Ag 48Cd 49 In 50 Sn 52 Te 53T 54 Xe 5 铷 锶 钇 锆 铌 钼 锝 钉 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 55 Cs 56 Ba 57-71 72 Hf 73 Ta 74W 75 760s 77 Ir 78 Pt 79 Au 80 Hg 81T1 82P5 83 84P0 85 At 86 Rn 67 铯 钡 LaLu 铪 钽 钨 铼 锇 铱 铂 金 汞 铊 铅 铋 钋 87Fr 88Ra 8903 04RF105Db 106Sg 107Bh 108Hs 109Mt 110 111 112 钫 镭 Ac-Lr 轳 僖 鈹 黑 钹 Uun Uuu Uub 114 116 18 镧系 57L 58 Ce 59 Pr 60Nd 61Pm 62 Sm 63E1 64Gd 65 Tb 66D 67Ho 68 Er 69Tm 70Yb 71 Lu 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镜 镥 钢系 89Ac 90Th 91 Pa 92 93 94 Pu 95A 96Cm 97 Bk98 Cf 99Es 100Fm 10Md 102No 103 Lr 锕 钍 铀 镎 钚 镅 锔 锫 锎 锿 镄 们 锘 铹
元素周期表 镧系 锕系 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 114 116 118 1 2 3 4 5 6 7 钫 镭 钅卢 钅杜 钅喜 钅波 钅黑 钅麦 铌 钽 银 金 镉 汞 铟 铊 锡 铅 锑 铋 碲 钋 砹 氡 铷 碘 氙 铯 锶 钡 钇 锆 铪 钼 钨 锝 铼 钌 铑 钯 锇 铱 铂 氢 锂 氦 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 氪 Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn IB IA IIA IIIA IVA VA VIA VIIA IIIB IVB VB VIB VIIB VIII IIB Rf Db Sg Bh Hs Mt Ac-Lr Uun Uuu Uub H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Cs Fr Sr Ba Ra Y La-Lu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 104 105 106 107 108 109 110 111 112 57 89 -103 -71
元素周期表 0 2 He IIA IIIA IVA VA VIA VIIA 3 Li 4B6 5 B 6 80 锂 铍 硼 碳 氧 氟 11 Na 12 13A 14 Si 15p 16S 17C1 18A 3 钠 镁 IIIB IVB VB VIB VIIB VIII IB IIB 铝 硅 磷 硫 氯 19K 20Ca 21 Sc 22T123V 24Cr 25 Mn 26 Fe 27Co28 29 CI 30Zn 131 Ga 32 Ge 33As 34 Se 35 Br 36K 4 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 37 Rb38Sr 39Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48Cd 49 In 50 Sn 5S5 52 Te 53T 54 Xe 5 铷 锶 钇 锆 铌 钼 锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 55 Cs 56 Ba 57-7172Hf73Ta 74W 75Re 760s 77Ir 78 Pt 79 Au 80 Hg 81T1 82 Pb 83Bi 84 Po 86 Rn 6 铯 钡 LaLu 铪 钽 钨 铼 锇 铱 铂 金 汞 铊 铅 铋 钋 砹 87 Fr88Ra 890304Rfi105Db 106Sg 107Bh108s 109 110 111 112 钫 镭 -Lr 钠 鈹 债 Uun Uuu Uub 114 16 18 59 Pr 60Nd 镧系 58 Ce 61Pm 62 Sm 63 Eu 64Gd 65 Tb 66 Dy 67Ho 68 Er 69Tm 70Yb 71 Lu 镧 铈 镨 钕 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 89 Ac 90 91 Pa 921I 93Np 94 95Am 96Cm 97 Bk 98 Cf 99 Es 100Fm 10MMd 102No 103L1 锕系 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 锘 铹
元素周期表 镧系 锕系 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 114 116 118 1 2 3 4 5 6 7 钫 镭 钅卢 钅杜 钅喜 钅波 钅黑 钅麦 铌 钽 银 金 镉 汞 铟 铊 锡 铅 锑 铋 碲 钋 砹 氡 铷 碘 氙 铯 锶 钡 钇 锆 铪 钼 钨 锝 铼 钌 铑 钯 锇 铱 铂 氢 锂 氦 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 氪 Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn IB IA IIA IIIA IVA VA VIA VIIA IIIB IVB VB VIB VIIB VIII IIB Rf Db Sg Bh Hs Mt Ac-Lr Uun Uuu Uub H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Cs Fr Sr Ba Ra Y La-Lu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 104 105 106 107 108 109 110 111 112 57 89 -103 -71 镧系 锕系 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103

镧系元素 一、通性 镧在基态时不存在f电子,但镧与它后面的14种元 素性质很相似,所以把它作为镧系元素。 由于镧系收缩的影响,使得Y的原子半径 (0.181nm)、与元素Nd、Sm(0.182、0.18nm)及离子半 径Y3+(0.089nm)与Ho3+、Er3+(0.0894、0.0881nm)接近。 Y的化学性质与镧系元素相似,钇在矿物中与镧 系共生。通常把钇和镧系元素合称为稀土元素(用RE 表示)
一、通性 镧在基态时不存在f电子,但镧与它后面的14种元 素性质很相似,所以把它作为镧系元素。 由于镧系收缩的影响,使得Y的原子半径 (0.181nm)、与元素Nd、Sm(0.182、0.18nm)及离子半 径Y3+(0.089nm)与Ho3+ 、Er3+(0.0894、0.0881nm)接近。 Y的化学性质与镧系元素相似,钇在矿物中与镧 系共生。通常把钇和镧系元素合称为稀土元素(用RE 表示)。 镧系元素

镧系元素 二、电子构型 原子序数 元素 符号 价电子层结构 57 镧 4f 5d1 注:Eu,Yb La 6s2 58 铈 Ce 4f 5d1 6s2 的4f电子能量 59 镨 Pr 4f 6s2 低,不参与成键, 60 钕 Nd 4f 6s2 61 钷 Pm 4f 62 只有2个电子成 62 钐 Sm 4f6 6s2 键,而其余有 63 铕 Eu 4 6s2 64 钆 三个电子成键。 Gd 4f 5d' 6s2 65 Tb 4f9 6s2 因此它们 66 镝 Dy 4f0 6s2 的金属键弱、 67 钬 Ho 4fu 6s2 原子半径显得 68 铒 Er 4f2 6s2 69 铥 Tm 4f3 6s2 较大、熔沸点 70 镱 Yb 4f4 6s2 较低。 71 镥 Lu 44 5d 6s2
二、电子构型 镧系元素 原子序数 元素 符号 价电子层结构 57 镧 La 4f0 5d1 6s2 58 铈 Ce 4f1 5d1 6s2 59 镨 Pr 4f3 6s2 60 钕 Nd 4f4 6s2 61 钷 Pm 4f5 6s2 62 钐 Sm 4f6 6s2 63 铕 Eu 4f7 6s2 64 钆 Gd 4f7 5d1 6s2 65 铽 Tb 4f9 6s2 66 镝 Dy 4f10 6s2 67 钬 Ho 4f11 6s2 68 铒 Er 4f12 6s2 69 铥 Tm 4f13 6s2 70 镱 Yb 4f14 6s2 71 镥 Lu 4f14 5d1 6s2 注:Eu,Yb 的4f电子能量 低,不参与成键, 只有2个电子成 键,而其余有 三个电子成键。 因此它们 的金属键弱、 原子半径显得 较大、熔沸点 较低

镧系元素 三、氧化态 +Ⅲ氧化态是所有Ln元素的特征氧化态。 它们失去三个电子所需的电离势较低,即能形成 稳定的+Ⅱ氧化态。 有些虽然也有+Ⅱ或+V氧化态,但都不稳定。 Ce(4f15d 6s2),Pr(486s2),Tb(4f6s2),Dy(4f106s2) 成+IV氧化态即Ce(4),Pr(4f),Tb(4f),Dy(4f8)。 Sm(4f66s2),Eu(4f76s2),Tm(4f136s2),Yb(4f146s2)能形 成+Ⅱ氧化态即Sm(4f),Eu(4f),Tm(4f13),Yb(4f4)。 从4电子层结构来看,其接近或保持全空、半满 及全满时的状态较稳定(也存在热力学及动力学因素)
三、氧化态 +III氧化态是所有Ln元素的特征氧化态。 它们失去三个电子所需的电离势较低,即能形成 稳定的+III氧化态。 有些虽然也有+II或+IV氧化态,但都不稳定。 Ce(4f15d16s2 ),Pr(4f36s2 ),Tb(4f96s2 ),Dy(4f106s2 )能形 成+IV氧化态即Ce(4f0 ),Pr(4f1 ),Tb(4f7 ),Dy(4f8 ) 。 Sm(4f66s2 ),Eu(4f76s2 ),Tm(4f136s2 ),Yb(4f146s2 )能形 成+II氧化态即Sm(4f6 ),Eu(4f7 ),Tm(4f13),Yb(4f14) 。 从4f电子层结构来看,其接近或保持全空、半满 及全满时的状态较稳定(也存在热力学及动力学因素)。 镧系元素
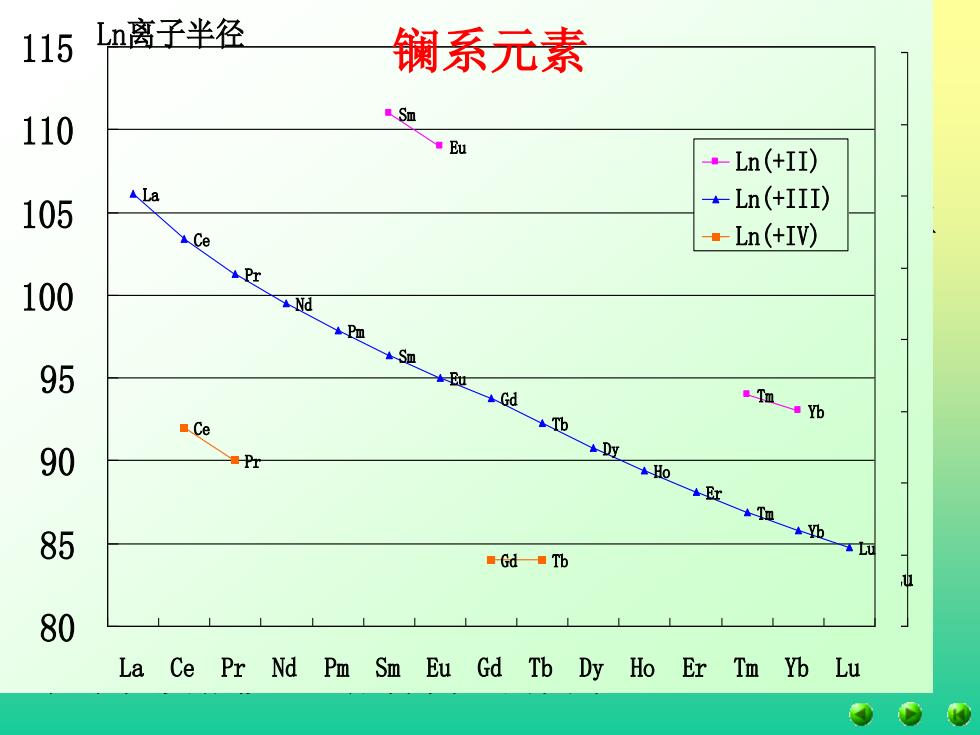
115 Ln离子半径 镧系元素 110 a Sm Eu ·Ln(+II) 105 ALa -Ln(+III) Ce ·Ln(+IV) 100 95 Tm a yb Ce 90 Pr 85 Gd Tb 80 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
四、原子半径和离子半径 从表中的数据可以看出,从La到Lu原子半径和三 价离子半径逐渐减小。这种镧系元素的原子半径和离 子半径随着原子序数的增加而逐渐减小的现象称为镧 系收缩。 由于镧系收缩的影响,使得钇的原子半径接近 Tb和Dy,因而钇与Ln共生,并把钇归为稀土元素。 镧系收缩使IVB族中的锆与铪、VB族中的铌与 钽、VIB族的钼与钨在原子半径和离子半径较接近, 化学性质相似,造成分离上的困难。 Ln原子半径和离子半径 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Sm Eu Tm Yb La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ce Pr Gd Tb 80 100 120 140 160 180 200 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ln Ln(+II) Ln(+III) Ln(+IV) Ln原子半径 La Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ce 170 175 180 185 190 195 200 205 210 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ln Ln离子半径 Sm Eu Tm Yb La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ce Pr Gd Tb 80 85 90 95 100 105 110 115 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ln(+II) Ln(+III) Ln(+IV) 镧系元素

镧系元素 五、活泼性 镧系金属是强还原剂,其还原能力仅次于Mg, 其反应性可与铝比。而且随着原子序数的增加,还 原能力呈逐渐减弱的趋势。 在酸性溶液中Ln2+离子为强还原剂,Ln4+离子 为强氧化剂。(试考虑它们的产物是什么?) 六、应用 用于玻璃、陶瓷、发光材料、电淘光源材料、 激光材料、磁性材料、稀土微肥、催化剂、超导材 料及引火合金
五、活泼性 镧系金属是强还原剂,其还原能力仅次于Mg, 其反应性可与铝比。而且随着原子序数的增加,还 原能力呈逐渐减弱的趋势。 在酸性溶液中Ln2+离子为强还原剂, Ln4+离子 为强氧化剂。(试考虑它们的产物是什么?) 六、应用 用于玻璃、陶瓷、发光材料、电淘光源材料、 激光材料、磁性材料、稀土微肥、催化剂、超导材 料及引火合金。 镧系元素

镧系元素 七、Ln203,Ln(OHD3 Ln203与碱土金属氧化物相似,可以吸收空 气中的CO,形成碳酸盐,易溶于水生成L(OD3。 Ln(OHD)3中除Yb(OHD3和Lu(OHD3外都不溶于 过量的强碱。 Ln(OHD3在水中微溶,碱性随原子序数增加 而减弱,随温度的升高溶解度降低
镧系元素 七、Ln2O3 ,Ln(OH)3 Ln2O3与碱土金属氧化物相似,可以吸收空 气中的CO2形成碳酸盐,易溶于水生成Ln(OH)3。 Ln(OH)3中除Yb(OH)3和Lu(OH)3外都不溶于 过量的强碱。 Ln(OH)3在水中微溶,碱性随原子序数增加 而减弱,随温度的升高溶解度降低

镧系元素 八、+盐类 我们把轻稀土57-63号称为铈组,把重稀土64-71 号称为钇组。 相同点:它们的LnF3、Ln(OH田D3、LnPO4 Ln2(C2O4)3、Ln2(C03)3都难溶于水。 它们的卤化物(CL,Br,D、氰化物都溶于水。 不同点: 铈组 钇组 硫酸盐 不溶于M2SO4溶液 溶于M,SO4溶液 碳酸盐 不溶于C0,2-溶液 溶于C032溶液 草酸盐 不溶于C,0,2溶液 溶于C2042-溶液
镧系元素 八、+III盐类 我们把轻稀土57-63号称为铈组,把重稀土64-71 号称为钇组。 相同点:它们的LnF3、Ln(OH)3、LnPO4、 Ln2 (C2O4 )3、Ln2 (CO3 )3都难溶于水。 它们的卤化物(Cl,Br,I)、氰化物都溶于水。 不同点: 铈组 钇组 硫酸盐 不溶于M2SO4溶液 溶于M2SO4溶液 碳酸盐 不溶于CO3 2-溶液 溶于CO3 2-溶液 草酸盐 不溶于C2O4 2-溶液 溶于C2O4 2-溶液