
碱金属 碱土金属 单质及化合物 离子晶体盐类的溶解性 钠等元素与人体的关系 本章要求
碱金属 碱土金属 通 性 单 质 及 化 合 物 作 业 本 章 要 求 离 子 晶 体 盐 类 的 溶 解 性 钠 等 元 素 与 人 体 的 关 系

概述 碱金属和碱土金属是 A族包括锂、钠、钾、铷、 们的氧化物溶于水呈强碱性 ⅡA族包括铍、镁、钙 素。由于钙、锶、钡的氧A 和“土性”(以前把粘土的 之间,所以称为碱土金属, 在内。钫和镭是放射性元素 地壳内蕴藏较丰富,它们 1807年,戴维电解K0H 同样的方法从NaOH中得到 戴维,H
碱金属和碱土金属是周期表IA族和IIA族元素。 IA族包括锂、钠、钾、铷、铯、钫六种金属元素。它 们的氧化物溶于水呈强碱性,所以称为碱金属。 IIA族包括铍、镁、钙、锶、钡、镭六种金属元 素。由于钙、锶、钡的氧化物在性质上介于“碱性” 和“土性”(以前把粘土的主要成分Al2O3称为“土”) 之间,所以称为碱土金属,现习惯上把铍和镁也包括 在内。钫和镭是放射性元素。钠、钾、钙、镁和钡在 地壳内蕴藏较丰富,它们的单质和化合物用途较广泛。 1807年,戴维电解KOH得到金属K(Potassium),用 同样的方法从NaOH中得到金属Na(Sodium)。 概述

概述 1808年, 按3:1的比例 混合,放在白 汞齐,并制得 了钙。不久他 重晶石(BaSO4) 和苦土MgO) 素单质一锶、 钡(Barium)和 钫Franc B衰变并放出 粒子后得到的 铍(Beryl 多艺的化学家 维勒用他电解 维勒,F
1808年,戴维把潮湿的石灰和氧化汞按3:1的比例 混合,放在白金皿中进行电解得到了钙汞齐,并制得 了钙。不久他又从菱锶矿石(SrCO3 )、重晶石(BaSO4 ) 和苦土(MgO)中到得了三个新的金属元素单质——锶、 钡(Barium)和镁。 钫(Francium)是由法国的佩里从锕衰变并放出 粒子后得到的。 铍(Beryllium)是1845年德国的多才多艺的化学家 维勒用他电解发现铝的方法制得的。 概述

概述 碱金属的基本性质 元素 Li Na K Rb Cs 性质 原子半径pm 152 153.7 227.2 247.5 265.4 离子半径pm 68 97 133 147 167 第一电离势 kJ/ 521 499 421 405 371 第二电离势 mol 7295 4591 3088 2675 2436 电负性 0.98 0.93 0.82 0.82 0.79 标准电极电势(酸) -3.045 -2.711 -2.923 -2.925 -2.923 M(g)水合热 519 406 322 293 264 /kJ.mol-1
概述 元素 性质 Li Na K Rb Cs 原子半径/pm 152 153.7 227.2 247.5 265.4 离子半径/pm 68 97 133 147 167 第一电离势 kJ/ mol 521 499 421 405 371 第二电离势 7295 4591 3088 2675 2436 电负性 0.98 0.93 0.82 0.82 0.79 标准电极电势(酸) -3.045 -2.711 -2.923 -2.925 -2.923 M+ (g)水合热 /kJ·mol-1 519 406 322 293 264 碱金属的基本性质
概述 碱土金属的基本性质 元素 性质 Be Mg Ca Sr Ba 原子半径pm 111.3 160 197.3 215.1 217.3 离子半径pm 35 66 99 112 134 第一电离势 905 742 593 552 564 第二电离势 kJ/ 1768 1460 1152 1070 971 mol 第三电离势 14939 7658 4942 4351 3575 电负性 1.57 1.31 1.00 0.95 0.89 标准电极电势(酸) -1.85 -2.375 -2.76 -2.89 -2.90 标准电极电势(碱) -2.28 -2.69 -3.02 -2.99 -2.97 MP+(g)水合热 2494 1921 1577 1443 1305 /kJ.mol-1
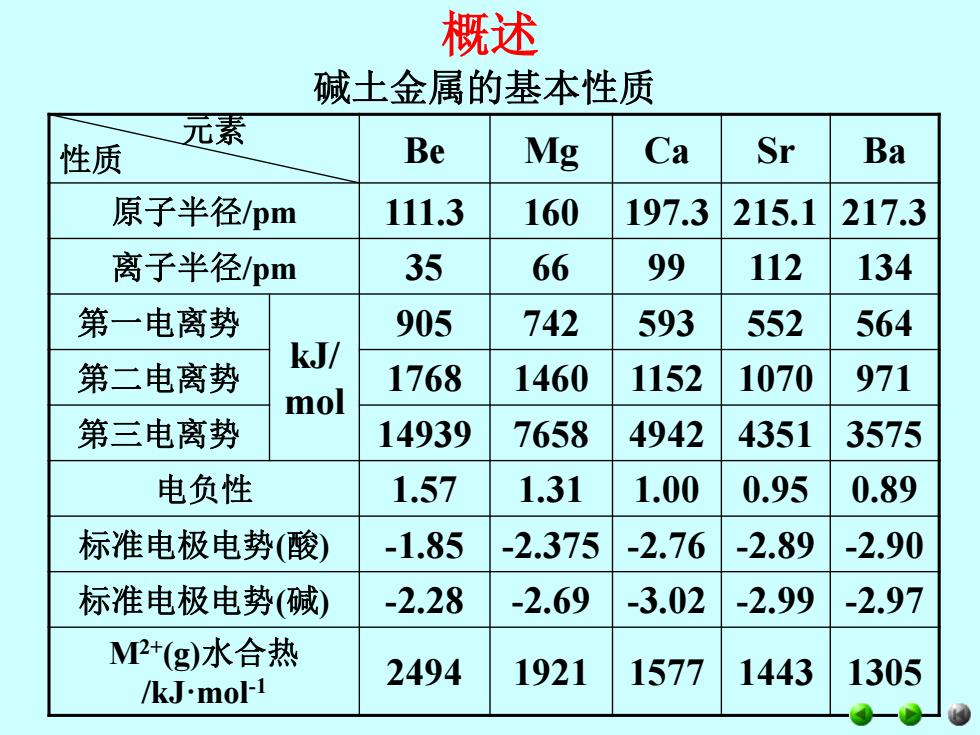
概述 元素 性质 Be Mg Ca Sr Ba 原子半径/pm 111.3 160 197.3 215.1 217.3 离子半径/pm 35 66 99 112 134 第一电离势 kJ/ mol 905 742 593 552 564 第二电离势 1768 1460 1152 1070 971 第三电离势 14939 7658 4942 4351 3575 电负性 1.57 1.31 1.00 0.95 0.89 标准电极电势(酸) -1.85 -2.375 -2.76 -2.89 -2.90 标准电极电势(碱) -2.28 -2.69 -3.02 -2.99 -2.97 M2+(g)水合热 /kJ·mol-1 2494 1921 1577 1443 1305 碱土金属的基本性质

碱金属碱土金属 存 在 氢氧化物 单质制备 氢化物 单质物理性质 盐 类 单质化学性质 几种重要的化合物 氧化物 在人体中的作用
碱金属 碱土金属 单质物理性质 单质化学性质 氧化物 氢氧化物 氢化物 盐 类 单质制备 几种重要的化合物 存 在 在人体中的作用

存在 于自然界中。 的丰度都为 KCI、光卤石 D4)324H20等。 含有钾盐。 锂、铷和铯 石盐 金属
存在 碱金属和碱土金属都以化合状态存在于自然界中。 在碱金属中,钠和钾在地壳中分布很广,两者的丰度都为 2.5%。 主要矿物有芒硝Na2SO4·10H2O、石盐KCl、光卤石 KCl·MgCl2·6H2O以及明矾石K2SO4·Al2 (SO4 )3·24H2O等。 海水中氯化钠的含量为2.7%,植物灰中也含有钾盐。 锂的重要矿物为锂辉石Li2O·Al2O3·4SiO2,锂、铷和铯 在自然界中储量较少且分散,被列为稀有金属。 天然芒硝 石盐

存在 重晶石
存在 碱土金属除镭外在自然界中分布也很广泛, 镁除光卤石外,还有白云石CaCO3·MgCO3和菱镁 矿MgCO3等。 铍的最重要矿物是绿柱石3BeO·Al2O3·6SiO2。 钙、锶、钡在自然界中存在的主要形式为难溶的 碳酸盐和硫酸盐,如萤石CaF2、石灰石CaCO3、 碳酸锶矿SrCO3、碳酸钡矿、石膏CaSO4·2H2O、 天青石SrSO4和重晶石BaSO4等。海水中含有大量 镁的氯化物和硫酸盐,1971年世界镁产量有一半 以上是以海水为原料生产的。 萤石 石膏 绿柱石 石灰石 方解石 重晶石

单质的制备 1.电解 2N: CI(9 阴极 加入氯化钙 的熔点约873K, 钠的分散性,因 易浮在面上。 阳极 900K 2.热还原法 热还原法一 Na① K NaCl①在熔融的CaCl,中 电解熔融氯化钠制钠 2KF+Cav2 MP2T∠NTL
1.电解 2NaCl(CaCl2 )===2Na+Cl2 加入氯化钙一则可降低电解质的熔点(混合盐 的熔点约873K),防止钠的挥发,再则可减小金属 钠的分散性,因熔融混合物的密度比金属钠大,钠 易浮在面上。 单质的制备 电解 1473K 1273-1423K 2.热还原法 热还原法一般采用焦炭或碳化物为还原剂 K2CO3+C=====2K+CO 2KF+CaC2=======CaF2+2K+2C 阴极 阳极

单质的制备 3.金属置换法 钾、铷和铯常用强还原性的金属如:Na、Ca、 Mg、Ba等在高温和低压下还原它们氯化物的方法 制取,例如: KC+Na===NaC+K↑ 2RbCl+Ca===CaCl2+2Rb1 2CsAIO2+Mg===MgALO+2Cs1 4、热分解法 KCN⊥4K+4C+N2 MN3--2M+3Nz(M-Na,K,Rb,Cs)
3.金属置换法 钾、铷和铯常用强还原性的金属如:Na、Ca、 Mg、Ba等在高温和低压下还原它们氯化物的方法 制取,例如: KCl+Na===NaCl+K↑ 2RbCl+Ca===CaCl2+2Rb↑ 2CsAlO2+Mg===MgAl2O4+2Cs↑ 4、热分解法 单质的制备 KCN===4K+4C+N2 MN3===2M+3N2(M=Na,K,Rb,Cs)