
第士一章:氧化还原反应 ·11-1基本概念。 ·11-2氧化还原方程式的配平。 11-3电极电势。 。 11-4 元素电势图及其应用 。 。 11-5电解 11-5化学电源简介 。 本章要求 作业 冈D☒I
第十一章:氧化还原反应 • 11-1 基本概念。 • 11-2 氧化还原方程式的配平。 • 11-3 电极电势。 • 11-4 元素电势图及其应用。 • 11-5 电解 • 11-5 化学电源简介 • 本章要求 • 作业

一、氧化与还原 1. 氧化发应 氧化还原的基本概念 2.还原反应 二、氧化数 1.定义:表观电荷数。假设把化合物中成键的电子 归电负性较大的原子,从而求得原子所带得形式电 荷数。此电荷数即是该原子在该化合物中的氧化数。 有正、负和分数。 2.规则: (1)单质的氧化数为0: (2)化合物中,所有元素的氧化数的代数和为0: IDI☒
11.1 氧化还原的基本概念 一、氧化与还原 1. 氧化反应; 2. 还原反应. 二、氧化数 1. 定义:表观电荷数。假设把化合物中成键的电子 归电负性较大的原子,从而求得原子所带得形式电 荷数。此电荷数即是该原子在该化合物中的氧化数。 有正、负和分数。 2.规则: (1)单质的氧化数为0; (2)化合物中,所有元素的氧化数的代数和为0;

(3)多原子离子中,所有元素的氧化数的代数和等于 离子的电荷数 (4)一些典型元素的氧化数为一定值。如:H:+1( NaH中为-1);F:-1;0:-2(H0中): 3.化合价和氧化数的区别: (1)化合价(某元素一定数目的原子与另一数目的原 子相化合的性质):分子中原子键相互结合的能力, 反映了分子的结构:氧化数:分子中原子的形式电荷 数,不考虑结构,可以是分数。 如:CHC1CHC13: (2)化合价分为离子价和共价。离子价指得失电子的 数目,得电子为负,失电子为正;共价指共用电子对 数,无正负之分) IDI☑
(3)多原子离子中,所有元素的氧化数的代数和等于 离子的电荷数; (4) 一些典型元素的氧化数为一定值。如:H:+1( NaH中为-1);F:-1;O:-2(H2 O中): 3.化合价和氧化数的区别: (1)化合价(某元素一定数目的原子与另一数目的原 子相化合的性质):分子中原子键相互结合的能力, 反映了分子的结构;氧化数:分子中原子的形式电荷 数,不考虑结构,可以是分数。 如:CH3 Cl CHCl3; (2)化合价分为离子价和共价。离子价指得失电子的 数目,得电子为负,失电子为正;共价指共用电子对 数,无正负之分)

11.2 氧化还原方程式配平 一、氧化数法 :P415; 二、离子电子法:P418。 ☑DII
11.2 氧化还原方程式配平 一 、氧化数法:P415; 二、离子电子法:P418

11.3氧化还原反应和电极电势 一、氧化还原反应和电子转移 1、氧化数变化和电子转移 金属锌置换Cu2+的氧化还原反应如下: Zn+Cu2+--=Zn2++Cu Zn和Cu2+在反应中氧化数发生了变化,根据它们 氧化数的变化可以确定氧化剂为Cu2+,还原剂为Zn。 为什么有的元素氧化数升高,有的却降低? 这是因为氧化剂、还原剂之间发生了电子转移。 怎样证明金属锌置换Cu2+的反应有电子转移呢? 可以设计一定的装置,让电子转移变成电子的定 向移动。这种装置称为原电池。通过原电池将氧化还 原反应的化学能转变为电能,产生电流,可以证明氧 化还原反应发生了电子转移
11.3 氧化还原反应和电极电势 一、氧化还原反应和电子转移 1、氧化数变化和电子转移 金属锌置换Cu2+的氧化还原反应如下: Zn+Cu2+===Zn2++Cu Zn和Cu2+在反应中氧化数发生了变化,根据它们 氧化数的变化可以确定氧化剂为Cu2+,还原剂为Zn。 为什么有的元素氧化数升高,有的却降低? 这是因为氧化剂、还原剂之间发生了电子转移。 怎样证明金属锌置换Cu2+的反应有电子转移呢? 可以设计一定的装置,让电子转移变成电子的定 向移动。这种装置称为原电池。通过原电池将氧化还 原反应的化学能转变为电能,产生电流,可以证明氧 化还原反应发生了电子转移
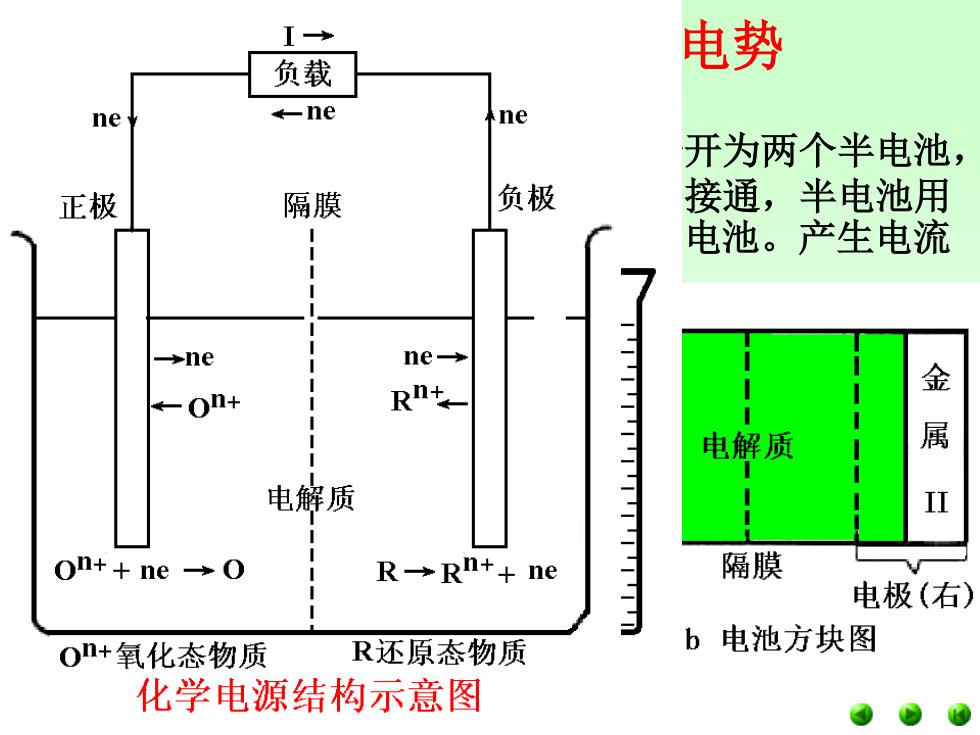
I→ 电势 负载 ne -ne ne 开为两个半电池, 正极 隔膜 负极 接通,半电池用 电池。产生电流 →ne ne- 金 ←On+ 电解质 属 电解质 II On++ne→O R→Rn++ne 隔膜 电极(右) On+氧化态物质 R还原态物质 b 电池方块图 化学电源结构示意图
氧化还原反应和电极电势 2、原电池 将锌和锌盐溶液与铜和铜盐溶液分开为两个半电池, 即锌半电池和铜半电池;外电路用导线接通,半电池用 盐桥沟通,这样就得到了一个Cu-Zn原电池。产生电流 的方向和大小可由检流计测出。 原电池是由氧化还原反应产生电流的装置,它使化 学能转变为电能。 原电池中的反应如下: 锌电极:氧化反应:Zn→Zn2++2e- 铜电极:还原反应:Cu2++2e-→Cu 电池反应:氧化还原反应Zn+Cu2+===Zn2++Cu 原电池的表示方法: (-)Zn│Zn2+(1mol/L)‖Cu2+(1mol/L)│Cu(+) 用│表示有一界面,‖表示盐桥
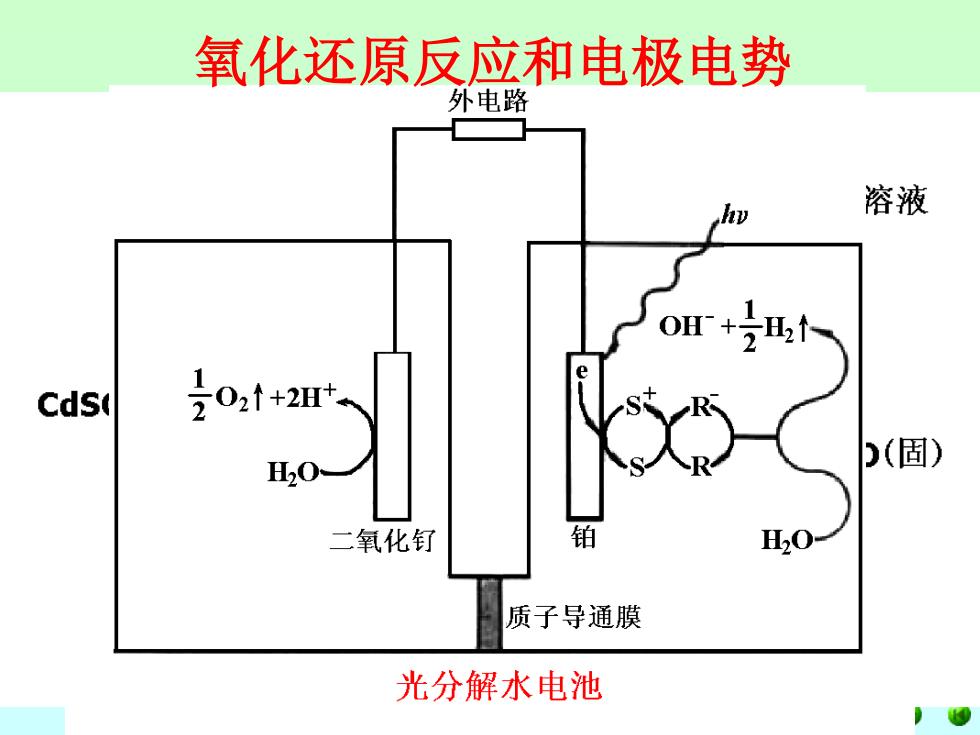
氧化还原反应和电极电势 外电路 溶液 Cds( H20 (固) 二氧化钌 H20 质子导通膜 光分解水电池
任何氧化还原反应,从理论上说都可以设计一定 的原电池证明有电子转移发生,然而实际操作有时会 发生困难,特别是那些比较复杂的反应。 氧化还原反应和电极电势

氧化还原反应和电极电势 二、电极电势差 在Cu一Zn原电池中为什么Zn是负极而不是正极呢? 大家已知金属晶体里有金属阳离子和公共化电子。 当把金属放入含有该金属离子的盐溶液时,有两种反 应倾向存在:一方面,金属表面的离子进人溶液和水 分子结合成为水合离子: Zn→Zn2+(aq)+2e 另一方面,溶液中的水合离子有从金属表面获得 电子,沉积到金属上的倾向: Zn2+(aq)+2e→Zn 金属的溶解和沉积能形成动态平衡
二、电极电势差 在Cu-Zn原电池中为什么Zn是负极而不是正极呢? 大家已知金属晶体里有金属阳离子和公共化电子。 当把金属放入含有该金属离子的盐溶液时,有两种反 应倾向存在:一方面,金属表面的离子进人溶液和水 分子结合成为水合离子: Zn→Zn2+(aq)+2e- 另一方面,溶液中的水合离子有从金属表面获得 电子,沉积到金属上的倾向: Zn2+(aq)+2e-→Zn 金属的溶解和沉积能形成动态平衡。 氧化还原反应和电极电势

氧化还原反应和电极电势 如果金属表面附近的溶液中,维持着一定数量的 正离子;在金属表面上,则保留着相应数量的自由电 子(对于不同的电极,可能出现不同的情况)。这样, 在金属和溶液之间就产生了电势差。 影响电极电势差的因素有电极的本性、温度、介 质、离子浓度等。 当外界条件一定时,电极电势差的高低就取决于 电极的本性。对于金属电极,则取决于金属离子化倾 向的大小。 金属越活泼,溶解成离子的倾向越大,离子沉积 的倾向越小。达成平衡时,电极的电势越低;反之, 电极的电势越高
如果金属表面附近的溶液中,维持着一定数量的 正离子;在金属表面上,则保留着相应数量的自由电 子(对于不同的电极,可能出现不同的情况)。这样, 在金属和溶液之间就产生了电势差。 影响电极电势差的因素有电极的本性、温度、介 质、离子浓度等。 当外界条件一定时,电极电势差的高低就取决于 电极的本性。对于金属电极,则取决于金属离子化倾 向的大小。 金属越活泼,溶解成离子的倾向越大,离子沉积 的倾向越小。达成平衡时,电极的电势越低;反之, 电极的电势越高。 氧化还原反应和电极电势

标准电极电势 电极电势的绝对值迄今仍无法测量。然而为了比较 氧化剂和还原剂的相对强弱,常用电极的相对电势值。 通常所说的某电极的“电极电势”就是相对电极电 势。 为了获得各种电极的电势差的相对大小,必须选用 一个通用的标准电极。 测量电极电势,则选择了标准氢电极的电势作为标 准,规定其标准电极电势为零。当用标准氢电极和欲测 电极组成电池后,测量该原电池的电动势,就得出了各
电极电势的绝对值迄今仍无法测量。然而为了比较 氧化剂和还原剂的相对强弱,常用电极的相对电势值。 通常所说的某电极的“电极电势”就是相对电极电 势。 为了获得各种电极的电势差的相对大小,必须选用 一个通用的标准电极。 测量电极电势,则选择了标准氢电极的电势作为标 准,规定其标准电极电势为零。当用标准氢电极和欲测 电极组成电池后,测量该原电池的电动势,就得出了各 种电极电势的相对数值。 标准电极电势