
第六章氧化还原滴定法 ●6.1概述 ●6.2氧化还原平衡和反应速率 ●6.3氧化还原滴定曲线 ●6.4氧化还原滴定中的指示剂 ●6.5高锰酸钾法 ●6.6K2Cr04法 ●6.7碘量法
6.1概述 6.2氧化还原平衡和反应速率 6.3氧化还原滴定曲线 6.4氧化还原滴定中的指示剂 6.5高锰酸钾法 6.6K2CrO4法 6.7碘量法 第六章 氧化还原滴定法

6.1概述 ■以氧化还原反应为基础的滴定方法 (redox titration)。 ■氧化还原反应的实质与特点: (1)电子转移反应 (2)反应常分步进行 (3)反应速率慢,且多有副反应
6.1 概 述 ◼以氧化还原反应为基础的滴定方法 (redox titration)。 ◼ 氧化还原反应的实质与特点: (1) 电子转移反应 (2) 反应常分步进行 (3) 反应速率慢,且多有副反应

■常用的氧化还原滴定方法: 高锰酸钾法、重铬酸钾法、碘量法、铈量 法、亚硝酸钠法、溴酸钾法等。 ■应用范围: (1)可直接测定本身具有氧化还原性 的物质 (2)可间接测定能与氧化剂还原剂定量 发生化学反应的物质
◼常用的氧化还原滴定方法: 高锰酸钾法、重铬酸钾法、碘量法、铈量 法、亚硝酸钠法、溴酸钾法等。 ◼应用范围: (1) 可直接测定本身具有氧化还原性 的物质 (2)可间接测定能与氧化剂还原剂定量 发生化学反应的物质

6.2氧化还原平衡和反应速率 6.2.1条件电位 氧化剂或还原剂的氧化还原能力大小,可 用电极电位表示(φ)。 φ越大则其氧化能力越强;φ越小则其还原 能力越强
6.2 氧化还原平衡和反应速率 6.2.1条件电位 氧化剂或还原剂的氧化还原能力大小,可 用电极电位表示()。 越大则其氧化能力越强;越小则其还原 能力越强
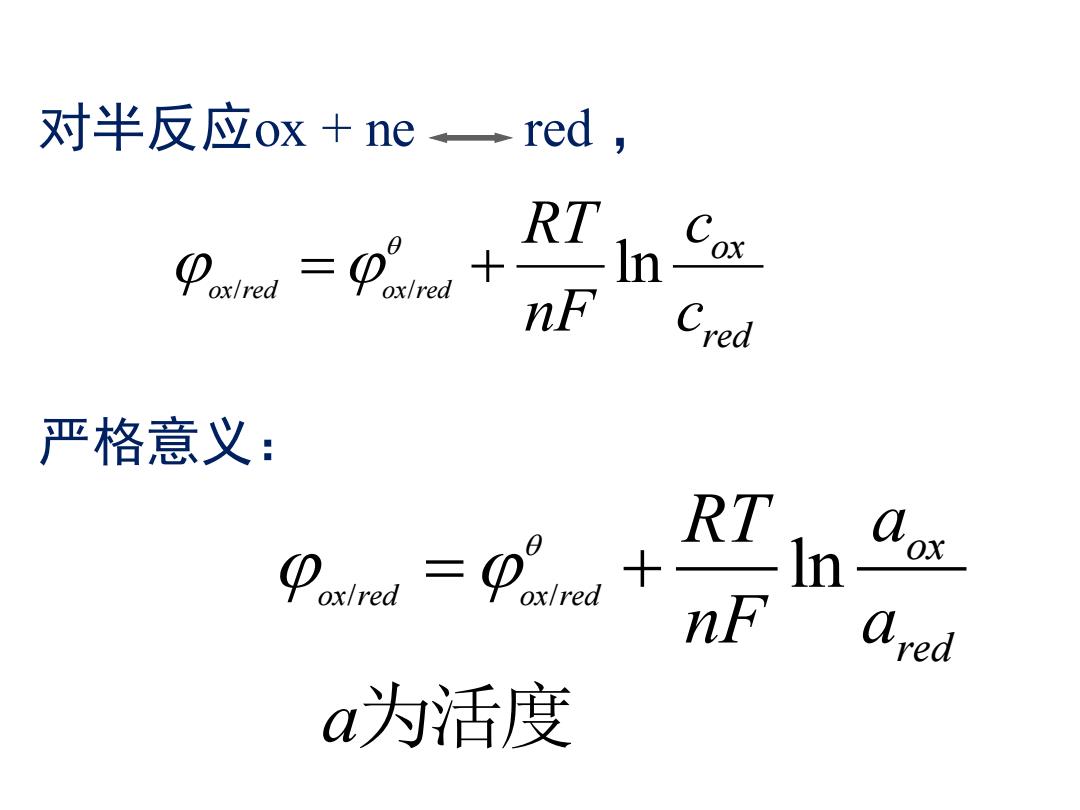
对半反应ox+ne。一red, RT In ox/red nF Cred 严格意义: RT n a为活度
对半反应ox + ne red , 严格意义: / / ox red ox red ln ox red RT c nF c = + a为活度 / / ox red ox red ln ox red RT a nF a = +
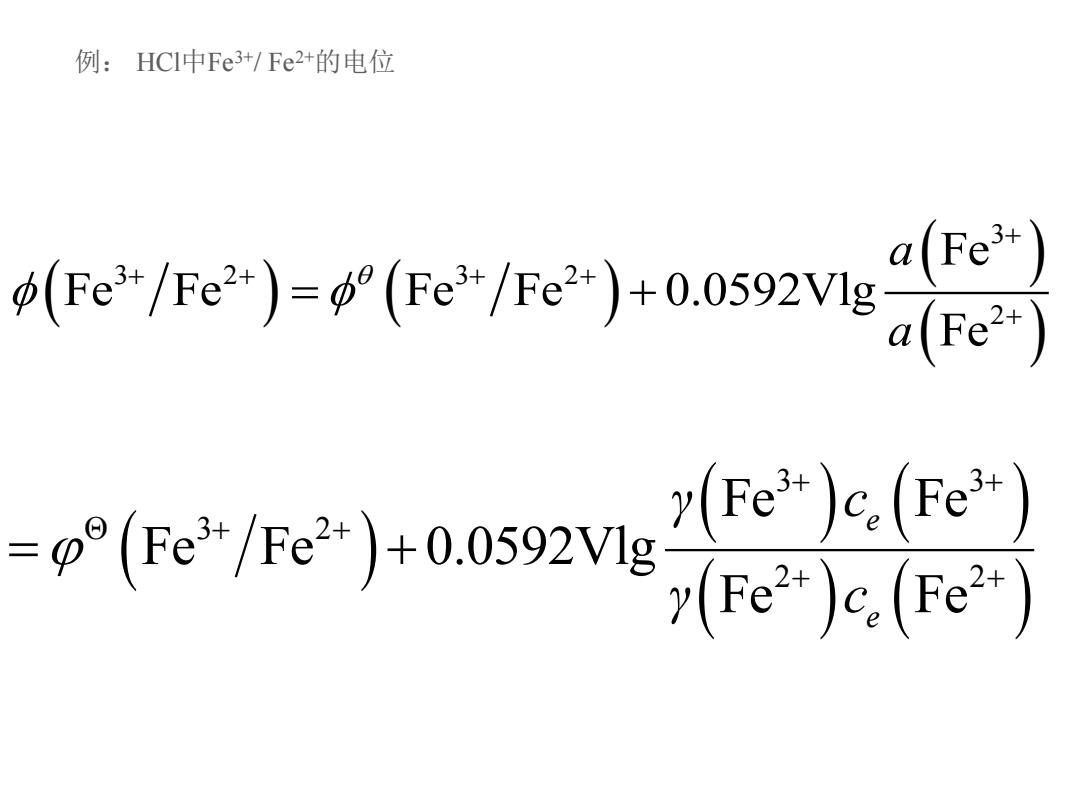
例:HCI中Fe3+/Fe2+的电位 Fe-re2+ooaue a(Fe3+) .eeias91ouoev yFe3+)c.(Fe3t)) y(Fe2+)c.(Fe2+)
( ) ( ) ( ) ( ) 3 3 2 3 2 2 Fe Fe Fe Fe Fe 0.0592Vlg Fe a a + + + + + + = + ( ) ( ) ( ) ( ) ( ) 3 3 Θ 3 2 2 2 Fe Fe Fe Fe 0.0592Vlg Fe Fe e e γ c γ c + + + + + + = + 例: HCl中Fe3+/ Fe2+的电位

铁离子发生副反应: Fe3++H,O→Fe(OH)2++H Fe3++CI→FeCl2+ 因此还存在Fe(0H2+、Fe(OHD2.…
铁离子发生副反应: 3 2 2 3 2 Fe H O Fe(OH) H Fe Cl FeCl + + + + − + + + + ------------------ 因此还存在 Fe(OH)2+ 、Fe(OH)2 +……

用副反应系数校正其平衡浓度 小米 -}
用副反应系数校正其平衡浓度 ( ) ( ) ( ) 3 3 3 Fe Fe Fe e c c a + + + = ( ) ( ) ( ) 2 2 2 Fe Fe Fe e c c α + + + =
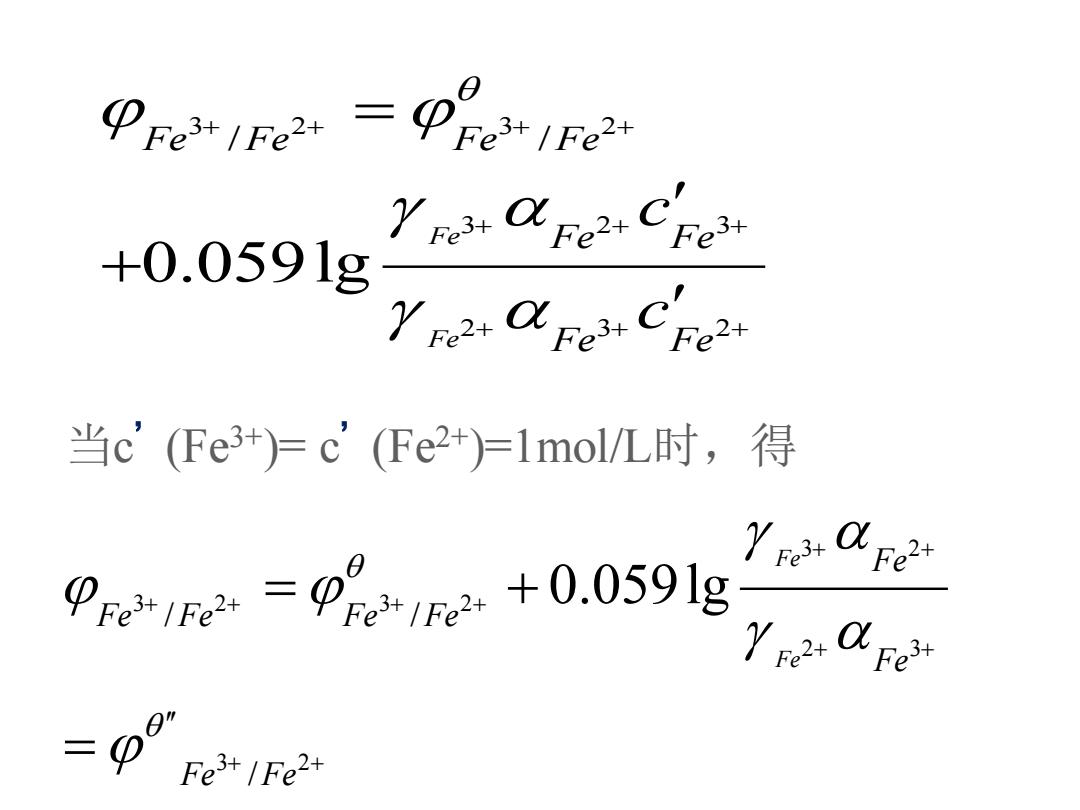
PFeIFe2 Pre IFe +0.0591g 当c'(Fe3+)=c'(Fe2+)=lmol/L时,得 0e+e=pe++0.059lg Fe3/Fe2+
当c ’(Fe3+)= c ’(Fe2+)=1mol/L时,得 3 2 3 2 3 2 3 2 3 2 / / 0.059lg Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe c c + + + + + + + + + + = + 3 2 3 2 3 2 2 3 3 2 / / / 0.059lg Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe + + + + + + + + + + = + =

条件电位:氧化态和还原态的总浓度均 为1mo/L时的实际电位。 gwg02 c(ox) c(red)
条件电位: 氧化态和还原态的总浓度均 为1mol/L时的实际电位。 / / 0.0592 ( ) ' lg ( ) ox red ox red c ox n c red = +