第六章:化学热力学初步 常用术语和概念 第一定律 化学反应的方向 吉布新公式 温度对化学平衡的影响 本章要求
第六章:化学热力学初步 常 用 术 语 和 概 念 第 一 定 律 作 业 本 章 要 求 化 学 反 应 的 方 向 吉 布 斯 公 式 温 度 对 化 学 平 衡 的 影 响

常用术语和概念 化学热力学主要是从宏观的角度研究化学反应 的能量变化,研究化学反应的方向,可能性等问题。 其不仅可以用来分析各种无机化合物的物理化学性 质,而且也能阐明无机化学中与化学反应速度有关 的许多平衡问题
化学热力学主要是从宏观的角度研究化学反应 的能量变化,研究化学反应的方向,可能性等问题。 其不仅可以用来分析各种无机化合物的物理化学性 质,而且也能阐明无机化学中与化学反应速度有关 的许多平衡问题。 常用术语和概念

常用术语和概念 一、体系 1、体系和环境 被研究的物质称为体系。也就是说为了研究的需 要和周围的物质和空间隔离开来的被研究的对象。 而体系以外的与体系有密切关系的周围部分称为 环境。 如AgNO3与NaCl在溶液中的反应;含有这两种 物质的水溶液就是体系;而溶液之外的一切东西(烧 杯、玻璃棒、溶液上方的空气等)都是环境
常用术语和概念 一、体系 1、体系和环境 被研究的物质称为体系。也就是说为了研究的需 要和周围的物质和空间隔离开来的被研究的对象。 而体系以外的与体系有密切关系的周围部分称为 环境。 如AgNO3与NaCl在溶液中的反应;含有这两种 物质的水溶液就是体系;而溶液之外的一切东西(烧 杯、玻璃棒、溶液上方的空气等)都是环境

常用术语和概念 2、体系的分类 ()敞开体系 体系和环境之间既有物质的交换又有能量的交换。 (2)封闭体系 体系和环境之间没有物质的交换只有能量的交换。 3)孤立体系 体系和环境之间既没有物质的交换又没有能量的 交换。 如:一个盛水的敞口的瓶(敞开体系),因为既有热 量的交换,又有瓶中水汽的蒸发和瓶外空气的溶解等; 如在此瓶口盖上瓶塞(封闭体系),因此时只有热量交换; 如将此广口瓶换为带盖的杜瓦瓶(孤立体系),由于瓶内 外既没有物质的交换又没有能量的交换
常用术语和概念 2、体系的分类 (1)敞开体系 体系和环境之间既有物质的交换又有能量的交换。 (2)封闭体系 体系和环境之间没有物质的交换只有能量的交换。 (3)孤立体系 体系和环境之间既没有物质的交换又没有能量的 交换。 如:一个盛水的敞口的瓶(敞开体系),因为既有热 量的交换,又有瓶中水汽的蒸发和瓶外空气的溶解等; 如在此瓶口盖上瓶塞(封闭体系),因此时只有热量交换; 如将此广口瓶换为带盖的杜瓦瓶(孤立体系),由于瓶内 外既没有物质的交换又没有能量的交换

常用术语和概念 3、体系的性质 根据体系中物质的量的关系,体系的性质可分 为两类: ()广度性质(亦称容量性质) 如体积、质量等。 (2)强度性质 此种性质的数值不随体系中物质的总量而变, 它仅由体系中物质本身的特性所决定,也就是没有 加合性。 如温度、密度就是强度性质
常用术语和概念 3、体系的性质 根据体系中物质的量的关系,体系的性质可分 为两类: (1)广度性质(亦称容量性质) 如体积、质量等。 (2)强度性质 此种性质的数值不随体系中物质的总量而变, 它仅由体系中物质本身的特性所决定,也就是没有 加合性。 如温度、密度就是强度性质

常用术语和概念 4、状态和状态函数 体系中所有物理性质和化学性质的总和即为状 态。 也就是说一个体系的物理性质和化学性质都确 定了,则称为一个状态。 如:气体的状态可由压力、体积、温度及各组 分物质的量等物理量来决定。如果其中的一个或多 个物理量发生改变时,体系即由一种状态变为另一 种状态。 对于一个体系来说当其处于不同状态时,其性 质必然有所不同。这些用来描述规定状态的性质用 数学术语来讲称它们为“状态函数
常用术语和概念 4、状态和状态函数 体系中所有物理性质和化学性质的总和即为状 态。 也就是说一个体系的物理性质和化学性质都确 定了,则称为一个状态。 如:气体的状态可由压力、体积、温度及各组 分物质的量等物理量来决定。如果其中的一个或多 个物理量发生改变时,体系即由一种状态变为另一 种状态。 对于一个体系来说当其处于不同状态时,其性 质必然有所不同。这些用来描述规定状态的性质用 数学术语来讲称它们为“状态函数

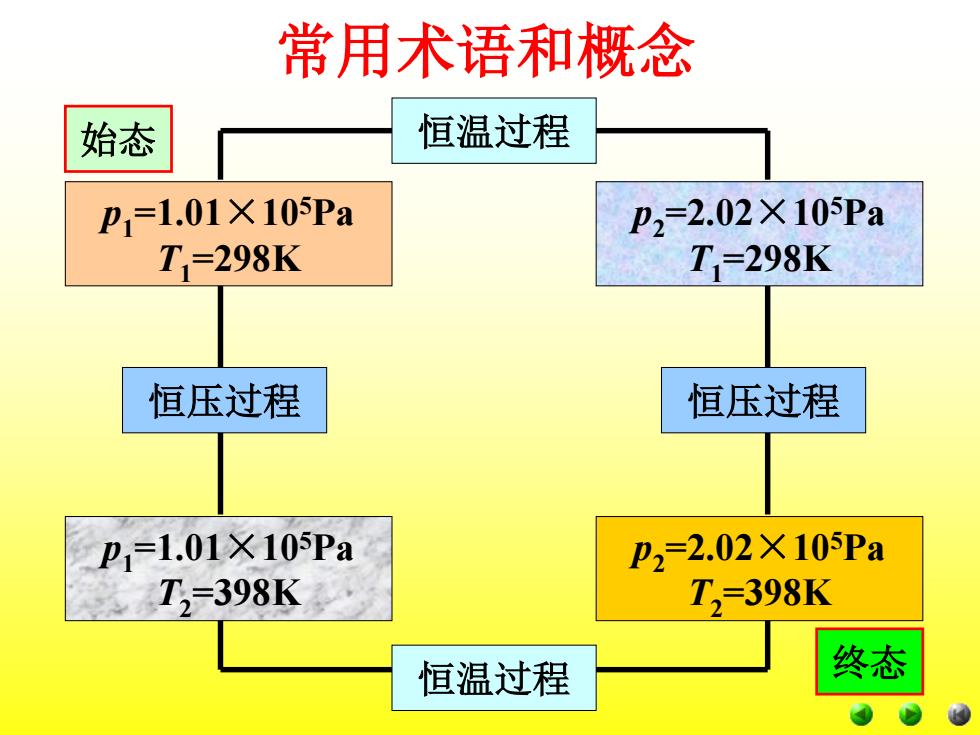
常用术语和概念 5、状态函数的特征 状态函数的变化只决定于体系的始态和终态, 而与变化的途径无关,状态一定值一定,殊途同归 变化等(与始终态有关而与途径无关,周而复始变化 零。 如:一定量的理想气体的状态变化,它由始态 p1=1.01×105Pa,T=298K变为p2=2.02×105Pa, T2398K。此过程可以有下列两种不同途径(“途 径”:状态变化所经历的具体步骤):
5、状态函数的特征 状态函数的变化只决定于体系的始态和终态, 而与变化的途径无关,状态一定值一定,殊途同归 变化等(与始终态有关而与途径无关,周而复始变化 零。 如:一定量的理想气体的状态变化,它由始态 p1 =1.01×105Pa,T1 =298K变为p2 =2.02×105Pa, T2 =398K。此过程可以有下列两种不同途径(“途 径”:状态变化所经历的具体步骤): 常用术语和概念
常用术语和概念 始态 恒温过程 p1=1.01×105Pa p2=2.02×10Pa T=298K T=298K 恒压过程 恒压过程 P1=1.01X10Pa P2=2.02×105Pa T,=398K T,=398K 恒温过程 终态
常用术语和概念 p1 =1.01×105Pa T1 =298K p2 =2.02×105Pa T2 =398K p2 =2.02×105Pa T1 =298K p1 =1.01×105Pa T2 =398K 恒温过程 恒压过程 恒温过程 恒压过程 始态 终态

热力学第一定律和热化学 一、热力学第一定律 热力学第一定律的一个中心问题是“能量守恒” 其数学表达式为:△U=Q+W △U为体系始态到终态内能变化值;△U=U,-U,内 能U是体系内部能量的总和,包括如下几部分: ①体系内所有物质的分子运动的动能,分子中 原子和电子运动的能量,如分子的转动动能、振动 动能等; ②分子间的位能,分子内原子间的位能,如: 质子与质子间的作用,化学键能等; ③原子核内的能量
一、热力学第一定律 热力学第一定律的一个中心问题是“能量守恒” 其数学表达式为:U=Q+W U为体系始态到终态内能变化值;U=U2 -U1内 能U是体系内部能量的总和,包括如下几部分: ①体系内所有物质的分子运动的动能,分子中 原子和电子运动的能量,如分子的转动动能、振动 动能等; ②分子间的位能,分子内原子间的位能,如: 质子与质子间的作用,化学键能等; ③原子核内的能量。 热力学第一定律和热化学

热力学第一定律和热化学 由于内能包括位能等因素,所以内能的绝对值 很难求得。 但对解决实际问题并无妨碍,因为在处理实际 问题时我们考虑的主要是内能的变化值。 而内能的差值可以从过程中,体系与环境能量 传递的功和热的数值来求出。 内能U是状态函数。 △U=Q+W Q为体系所吸收的热,若体系放热Q为负值; W为功,环境对体系做功W为正值,反之为负 值。 Q和不属于体系的状态,而是过程,即不属 于状态函数
热力学第一定律和热化学 由于内能包括位能等因素,所以内能的绝对值 很难求得。 但对解决实际问题并无妨碍,因为在处理实际 问题时我们考虑的主要是内能的变化值。 而内能的差值可以从过程中,体系与环境能量 传递的功和热的数值来求出。 内能U是状态函数。 U=Q+W Q为体系所吸收的热,若体系放热Q为负值; W为功,环境对体系做功W为正值,反之为负 值。 Q和W不属于体系的状态,而是过程,即不属 于状态函数