铜、锌副族 铜族元素 族元素 本章要求
铜、锌副族 铜 族 元 素 锌 族 元 素 作 业 本 章 要 求

铜族元素 铜族通性 单质的存在和制备 铜族元素的化合物
铜族元素 铜族通性 单 质 的 存 在 和 制 备 铜 族 元 素 的 化 合 物

铜族通性 铜族位于周期系的B族,包括铜、银、金三种 元素。 一、活泼性 IB族的价电子结构为(n-1)d0nsl。最外层电子 数虽然与A族相同但性质上却没有多少共同之处。 I$族的最外层电子的Z*(有效核电荷Z-σ)高, 故第一电离势比碱金属的高。 由于d电子也包含在金属键中,故它们的升华 热和熔点也比碱金属的高得多。其较惰性的特点与 这些因素有关。结果是其化合物有较多的共价性和 较高的晶格能
铜族位于周期系的IB族,包括铜、银、金三种 元素。 一、活泼性 IB族的价电子结构为(n-1)d10ns1。最外层电子 数虽然与IA族相同但性质上却没有多少共同之处。 IB族的最外层电子的Z*(有效核电荷Z-)高, 故第一电离势比碱金属的高。 由于d电子也包含在金属键中,故它们的升华 热和熔点也比碱金属的高得多。其较惰性的特点与 这些因素有关。结果是其化合物有较多的共价性和 较高的晶格能。 铜族通性

铜族通性 二、氧化数 铜、银、金三个元素,每一个元素都有+1、+2和 +3三种氧化数。最常见的氧化数:铜为+2、银为+1、 金为+3。 原因是B族的ns电子和次外层(n-1)d电子能量相 差不大,在与其他元素化合时,不仅s电子能参加反 应,(血-1)d电子也能依反应条件的不同,可以部分参 加反应,即表现出不同的氧化态。如: Cu20、CuO、KCuO2(铜酸钾)、AgNO3、AgF2y Ag[Ag02]等。 而碱金属主要氧化态是+1
铜族通性 二、氧化数 铜、银、金三个元素,每一个元素都有+1、+2和 +3三种氧化数。最常见的氧化数:铜为+2、银为+1、 金为+3。 原因是IB族的ns电子和次外层(n-1)d电子能量相 差不大,在与其他元素化合时,不仅ns电子能参加反 应,(n-1)d电子也能依反应条件的不同,可以部分参 加反应,即表现出不同的氧化态。如: Cu2O、CuO、KCuO2 (铜酸钾)、AgNO3、AgF2、 AgI [AgO2 ]等。 而碱金属主要氧化态是+1

铜族通性 三、标准电极电势 Au3++3e==Au p9=1.42V Ag2++e==Ag p9=1.987V Ag+e-=Ag p9=0.7996V Cuf+e==Cu p9=0.52V K++e==K p9=-2.925V 化学活泼性远小于碱金属; 从上到下,金属活泼性递减 与碱金属的变化 规律相反。 四、氢氧化物的碱性和稳定性 氢氧化物的碱性较弱,且极易脱水形成氧化物, 而碱金属氢氧化物是强碱,对热非常稳定
铜族通性 三、标准电极电势 Au3++3e-==Au =1.42V Ag2++e-==Ag+ =1.987V Ag++e-==Ag =0.7996V Cu++e-==Cu =0.52V K++e-==K =-2.925V 化学活泼性远小于碱金属; 从上到下,金属活泼性递减;与碱金属的变化 规律相反。 四、氢氧化物的碱性和稳定性 氢氧化物的碱性较弱,且极易脱水形成氧化物, 而碱金属氢氧化物是强碱,对热非常稳定

铜族通性 五、配合能力 有很强的配合能力,而碱金属却通常不形成配合 物。 六、化合物 铜族元素有许多二元化合物有相当的共价性。如: Ag是共价分子。而碱金属一般是离子型化合物。 七、单质的物理性质 铜族金属密度大、硬度大、熔点高,而碱金属则 密度小,硬度小、熔点低
铜族通性 五、配合能力 有很强的配合能力,而碱金属却通常不形成配合 物。 六、化合物 铜族元素有许多二元化合物有相当的共价性。如: AgI是共价分子。而碱金属一般是离子型化合物。 七、单质的物理性质 铜族金属密度大、硬度大、熔点高,而碱金属则 密度小,硬度小、熔点低

单质的存在和制备 Ceruleite
单质的存在和制备 铜主要以金属、硫化物、砷化物、氯化物和碳酸 盐的形式广泛分布,最常见的矿物有黄铜矿(CuFeS2 )、 孔雀石[CuCO3·Cu(OH)2 ]和碱式砷酸铜铝(Ceruleite) Cu2Al7 (AsO4 ) 4 (OH)13.12H2O等。 银主要以金属、硫化物、砷化物、氯化物的形式 广泛分布,常由铅矿、铜矿的加工过程中来回收。 金以单质形式存在。 它们都可形成许多合金。金 银 金铲银锅
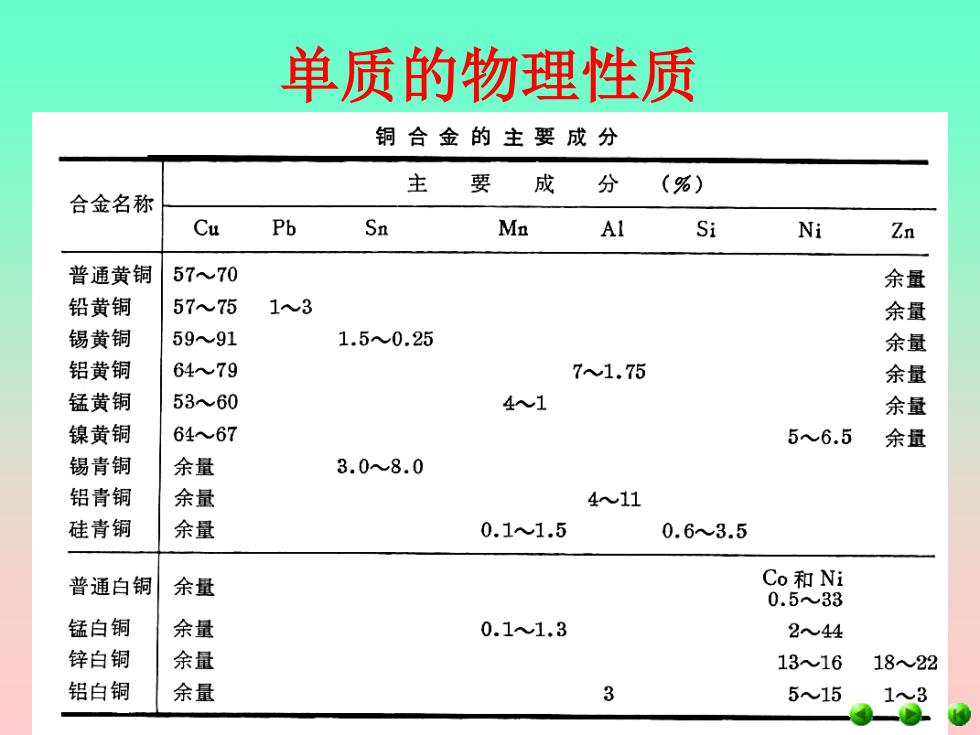
单质的物理性质 铜合金的主要成分 主 要 成 分 (%) 合金名称 Cu Pb Sn Ma Al Si Ni Zn 普通黄铜 5770 余量 铅黄铜 5775 13 余量 锡黄铜 5991 1.50.25 余量 铝黄铜 6479 71.75 余量 锰黄铜 5360 41 余量 镍黄铜 6467 56.5 余量 锡青铜 余量 3.08.0 铝青铜 余量 411 硅青铜 余量 0.11.5 0.63.5 普通白铜 余量 Co和Ni 0.533 锰白铜 余量 0.11.3 244 锌白铜 余量 1316 1822 铝白铜 余量 3 515 13 900
单质的物理性质 铜为紫红色、银为银白色、金为黄色。 在常温下铜银金都是晶体,密度大、熔点高、 沸点高,有良好的延展性和优良的导电性与导热性。 而碱金属则密度小,硬度小、熔点低。 它们用于货币、装饰品和电器工业等。 它们易形成合金,如黄铜(Cu60%Zn40%)、白 铜(Cu50~70%Ni18~20%Zn13~15%)、青铜 (Cu80%Sn15%Zn5%)

单质的化学性质 铜和银易溶于硝酸或热的浓疏酸中,有氧时Cu 能溶于氨水(生成CuNH)42+)中,Cu能直接溶 于KCN溶液(生成ICu(CN)43)。试写方程式 -0.12 Cu+NH3 Y[Cu(NHa)2J*-0.01V-[Cu(NH3)4]2+ Cu+CN -1.12YCu(CN)a]3 银和金能溶于KC中,金还能溶于王水试写方 程式) [Ag(CN)2I -0.31V Ag +2CN [Au(CN)2] -0.6y Au +2CN TAUC4T 1.00V>Au +4CT 铜和银在加热时能与硫化合为Cu2S及Ag2S,而 金不能
单质的化学性质 铜和银易溶于硝酸或热的浓硫酸中,有氧时Cu 能溶于氨水(生成[Cu(NH3 )4 ] 2+)中,Cu能直接溶 于KCN溶液(生成[Cu(CN)4 ] 3- )。(试写方程式)。 银和金能溶于KCN中,金还能溶于王水(试写方 程式) 铜和银在加热时能与硫化合为Cu2S及Ag2S,而 金不能。[Ag(CN) 2] - CN - Ag 2 -0.31V + -0.6V CN - [Au(CN) 2 ] Au + 2 - 1.00V [AuCl 4 ] - Au + Cl - 4 Cu +NH3 [Cu(NH3 ) 4 ] 2+ -0.12V -0.01V [Cu(NH3) 2] + Cu CN - + -1.12V [Cu(CN) 4] 3-

铜族化合物 一、 铜(①和Ag(①的化学性质 亚铜化合物是反磁性的,d轨道全满,没有d-d跃 迁,通常为无色。 1、氧化物和氢氧化物 在-45℃以下Ag0H白色物质稳定存在,高于此 温度分解为Ag2O而CuOH为黄色,仅在pH=3左右能 暂存,通常得到的是Cu0红色物质。 Cu20红色物质,Ag20暗棕色物质,都为共价型、 难溶于水的化合物。 Cu20很稳定,具有半导体的性质,而Ag20加热 则分解。 Cu2O能溶于氨水、HX形成[CuNH)2J+(不稳定)、 [CuCJ无色配合物
铜族化合物 一、铜(I)和Ag(I)的化学性质 亚铜化合物是反磁性的,d轨道全满,没有d-d跃 迁,通常为无色。 1、氧化物和氢氧化物 在-45℃以下AgOH白色物质稳定存在,高于此 温度分解为Ag2O而CuOH为黄色,仅在pH=3左右能 暂存,通常得到的是Cu2O红色物质。 Cu2O红色物质,Ag2O暗棕色物质,都为共价型、 难溶于水的化合物。 Cu2O很稳定,具有半导体的性质,而Ag2O加热 则分解。 Cu2O能溶于氨水、HX形成[Cu(NH3 )2 ] + (不稳定)、 [CuCl2 ] -无色配合物