
卤素 卤素通性 卤素单质 卤化氢和氢卤酸 报卤素 业 卤化物卤素互化物多卤化物 元素电势图 卤素的含氧化合物 本章要求
卤 素 卤素通性 卤素单质 卤化氢和氢卤酸 卤化物卤素互化物多卤化物 卤素的含氧化合物 拟卤素 元素电势图 作业 本章要求

卤素通性 在非金属化学中,首当其冲地要介绍卤族元 素。卤素Halogen)这一词的希腊文原意是成盐元 素。周期系第IA族元素,包括了氟(Fluorine)、 氯(Chlorine)、溴(Bromine)、碘Iodine)和砹 (Astatine)。砹是在二十世纪四十年代才被科学家 所发现。它是人工合成元素。其合成的人工核反 应为: 20983 Bi+4He-2135At+20 用能量为28兆电子伏特粒了轰击铋靶,合 成了21At。砹希腊词原意是不稳定。它的同位素 的半衰期只有8.3小时
在非金属化学中,首当其冲地要介绍卤族元 素。卤素(Halogen)这一词的希腊文原意是成盐元 素。周期系第ⅦA族元素,包括了氟(Fluorine)、 氯(Chlorine)、溴(Bromine)、碘(Iodine)和砹 (Astatine)。砹是在二十世纪四十年代才被科学家 所发现。它是人工合成元素。其合成的人工核反 应为: 209 83Bi+4 2He→211 85At+21 0n 用能量为28兆电子伏特粒了轰击铋靶,合 成了211At。砹希腊词原意是不稳定。它的同位素 的半衰期只有8.3小时。 卤素通性

卤素通性 碘 溴
卤素通性 性 质 氟 氯 溴 碘 物 态(298K,101.3kPa) 气 体 气 体 液 体 固 体 颜 色 淡黄色 黄绿色 红棕色 紫黑色(s)紫 色(g) 熔 点/K 53.38 172 265.8 386.5 沸 点/K 84.86 238.4 331.8 457.4 在水中的溶解度 /(mol·L -1 ,293K) 反 应 0.09 0.21 0.0013 共价半径/pm 64 99 114.2 133.3 X -离子半径/pm 133 181 196 220 第一电离势/(kJ·mol-1 ) 1681 1251 1140 1008 电子亲合势/(kJ·mol-1 ) 327.9 348.8 324.6 295.3 X -的水合能/(kJ·mol-1 ) -507 -368 -335 -293 X2的离解能/(kJ·mol-1 ) 156.9 242.6 193.8 152.6 电负性(Pauling 标 度) 3.98 3.16 2.96 2.66 卤素的一些性质

卤素通性 卤素的氧化态 电子构型 氧化态 F [He]2s22p5 -10 CI [Ne]3s23p5 -1,0,+1,+3,+4,+5,+7 Br [Ar]4s24p5 -1,0,+1,+3,+4,+5,+7 I [Kr]5s25p5 -1.0+1,+3,+4,+5,+7 At [Xe]6s26p5 -1,0,+1,+5
卤素通性 电子构型 氧化态 F [He]2s 22p 5 -1,0, Cl [Ne]3s 23p 5 -1,0,+1,+3,+4,+5,+7 Br [Ar]4s 24p 5 -1,0,+1,+3,+4,+5,+7 I [Kr]5s 25p 5 -1,0,+1,+3,+4,+5,+7 At [Xe]6s 26p 5 -1,0,+1,+5 卤素的氧化态

卤素单质 单质的通性 单质的发现 单质的制备 单质的颜色 氟的特殊性 卤素单质的化学性质 过电位
单质的通性 卤素单质的化学性质 单质的发现 单质的制备 单质的颜色 氟的特殊性 卤素单质 过电位
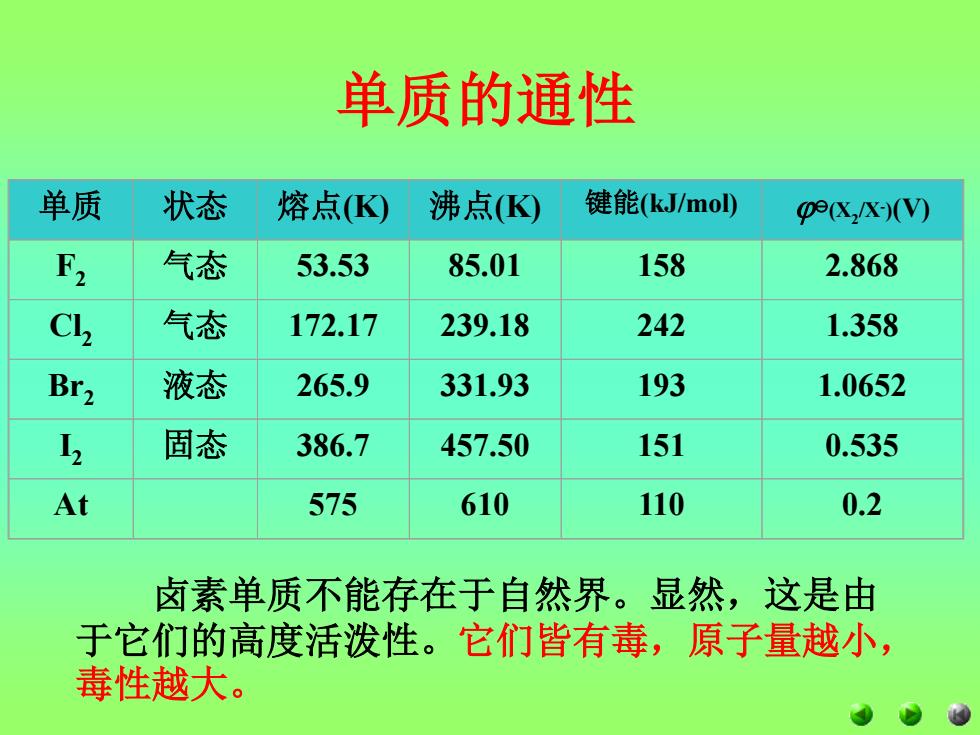
单质的通性 单质 状态 熔点K 沸点K 键能(kJ/mo ge(x,x)(V) F2 气态 53.53 85.01 158 2.868 CL2 气态 172.17 239.18 242 1.358 Br2 液态 265.9 331.93 193 1.0652 固态 386.7 457.50 151 0.535 At 575 610 110 0.2 卤素单质不能存在于自然界。显然,这是由 于它们的高度活泼性。它们皆有毒,原子量越小, 毒性越大
单质的通性 单质 状态 熔点(K) 沸点(K) 键能(kJ/mol) (X2 /X- )(V) F2 气态 53.53 85.01 158 2.868 Cl2 气态 172.17 239.18 242 1.358 Br2 液态 265.9 331.93 193 1.0652 I 2 固态 386.7 457.50 151 0.535 At 575 610 110 0.2 卤素单质不能存在于自然界。显然,这是由 于它们的高度活泼性。它们皆有毒,原子量越小, 毒性越大
单质的发现 硝业的 肖业, E,再 里海藻 友中突 以使人 本凝成 创它不 元素 刑成里儿系。少则患碘缺 碘的升华与凝华
单质的发现 他曾对这种新发现的物质进行研究,了解到它不 易和氯、碳等元素形成化合物,但能和氢,磷等元素 化合。1814年这一元素被定名为“Iodine”。 在人体中碘是一种必须的微量元素。少则患碘缺 乏病。 1、单质碘的发现:碘是在1811年为从事制硝业的 法国人库特瓦所发现。1811年库特瓦正经营制硝业, 经常到诺曼底海岸采集海藻类植物。把它烧成灰,再 用水浸渍制成几种母液.有一次他在用硫酸处理海藻 灰母液以除去硫化物时,由于用酸过多,从溶液中突 然发生一种紫色的蒸气,并且有一股和氯气相似使人 窒息的气味充满全屋.这些蒸气接触到冷的物体凝成 大片暗黑色的结晶,光泽与金属一样

单质的发现 2、单质溴的发现:1825年,德国海得堡大学学 生罗威将其家乡克罗茨纳克的一种矿泉水用氯气处 理时,产生了一种红色物质.这种物质可被乙瞇提 取出来.当把这种红色提取液中的乙醚蒸去后,他 得到了一种红棕色的液体,这就是溴。 当罗威和他的老师格梅林正在对这一新物质进 行认真研究的时候,1826年的《理化会志》上发表 了巴拉尔的论文,也宣布发现了溴
单质的发现 2、单质溴的发现:1825年,德国海得堡大学学 生罗威将其家乡克罗茨纳克的一种矿泉水用氯气处 理时,产生了一种红色物质.这种物质可被乙醚提 取出来.当把这种红色提取液中的乙醚蒸去后,他 得到了一种红棕色的液体,这就是溴。 当罗威和他的老师格梅林正在对这一新物质进 行认真研究的时候,1826年的《理化会志》上发表 了巴拉尔的论文,也宣布发现了溴

单质的发现 巴拉尔是法国人,1824年他正在从事研究盐湖 中所产的植物。他看到当地人在处理提取了食盐后 的母液时,仅再回收其中的芒硝。随即将母液弃掉, 感到十分可惜。于是他有意识地要寻求这种母液的 用途。 为此,他多次进行试验,观察到在这种母液中 加进某些氧化性试剂后,母液会变成棕黄色。以后 他又从海水中也找到了这种物质,他宣称:若用氯 气饱和海水,再用蒸馏法即可将这种棕红色液体分 出,经研究,这种液体沸点为47°C;蒸气很象二氧 化氮;能和各种金属化合,化合物呈中性。1826年 这种新元素被命名为Bromine(溴)即“恶臭”之 音
单质的发现 巴拉尔是法国人,1824年他正在从事研究盐湖 中所产的植物。他看到当地人在处理提取了食盐后 的母液时,仅再回收其中的芒硝。随即将母液弃掉, 感到十分可惜。于是他有意识地要寻求这种母液的 用途。 为此,他多次进行试验,观察到在这种母液中 加进某些氧化性试剂后,母液会变成棕黄色。以后 他又从海水中也找到了这种物质,他宣称:若用氯 气饱和海水,再用蒸馏法即可将这种棕红色液体分 出,经研究,这种液体沸点为47C;蒸气很象二氧 化氮;能和各种金属化合,化合物呈中性。1826年 这种新元素被命名为Bromine(溴)即“恶臭”之 意

单质的发现 k子三4h凸t 心见,到最活泼 为此不屈不 至贡献了他 有平坦的 ,才有希望 907)认真 遭失败,其 氟酸中,以 取得了单质 氟斑牙 。他却说: 氟是人体的微量元素,但过多有害。如氟斑牙
3、单质氟的发现:从萤石(CaF2 )的发现,到最活泼 的元素氟被征服足足化费了350年。科学家为此不屈不 挠地辛勤劳动,很多人由此而中剧毒,有的甚至贡献了他 们的生命,正象马克思所说的:“在科学上没有平坦的 大道,只有不畏劳苦沿着陡峭山路攀登的人,才有希望 达到光辉的顶点”。 法国人莫瓦桑(Henri Moissan 1852一1907)认真 总结了前人的经验教训,继续实验,但仍屡遭失败,其 间曾因中毒而中断了四次试验。 最后他将干燥的氢氟化钾溶于无水的氢氟酸中,以 此作为电解质,进行电解。在1886年第一次取得了单质 氟。因而摩瓦桑荣获了1906年诺贝尔化学奖。他却说: “氟夺去了我十年的生命”。 氟是人体的微量元素,但过多有害。如氟斑牙。 单质的发现