过渡元素(一) 钛分族 钒分族 铬分族 锰分族 本章要求
过渡元素(一) 通 性 钛 分 族 作 业 本 章 要 求 钒 分 族 锰 分 族 铬 分 族
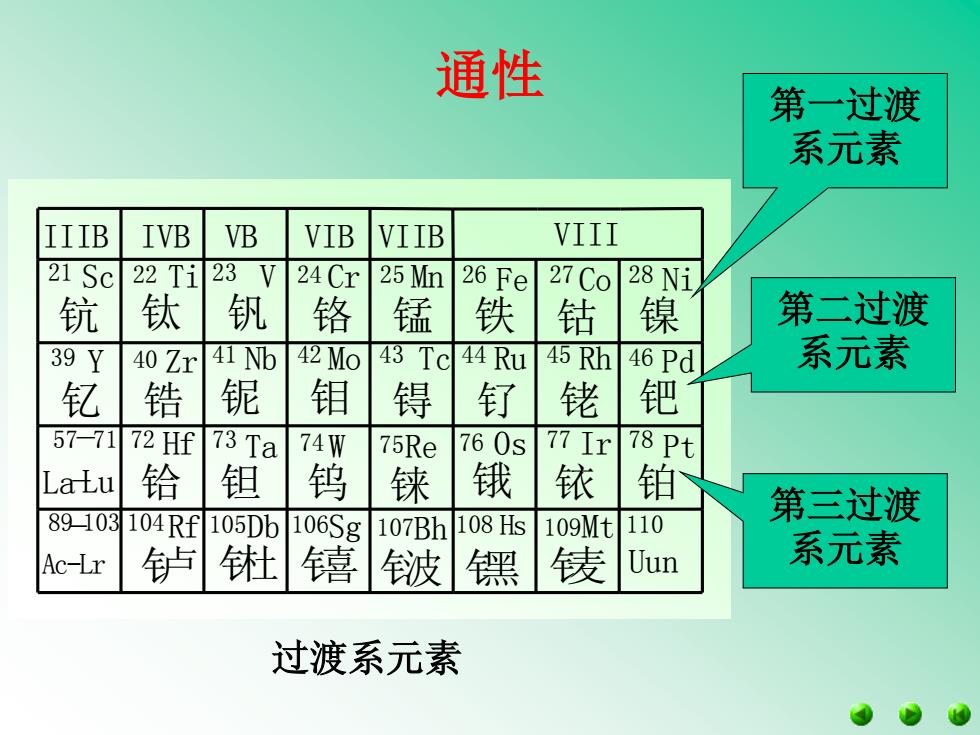
通性 第一过渡 系元素 IIIB IVB VB VIB VIIB VIII 21 Sc 22T1 23V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 钪 钛 钒 铬 锰 铁 钴 镍 第二过渡 39Y 40 Zr 41 Nb 42 Mo 43 Tc44 Ru 45 Rh 46 Pd 系元素 钇 锆 铌 钼 锝 钉 铑 钯 57-7172Hf 73 Ta 74 75Re 760S 77 78 Pt LaLu 铪 钽 钨 铼 锇 铱 铂 89▣103 104Rf105Db 第三过渡 106Sg 107Bh 108Hs 109Mt 110 Ac-Lr 轳 波镙 债 Uun 系元素 过渡系元素
过渡系元素 通性 钅卢 钅杜 钅喜 钅波 钅黑 钅麦 铌 钽 钇 锆 铪 钼 钨 锝 铼 钌 铑 钯 锇 铱 铂 钪 钛 钒 铬 锰 铁 钴 镍 Zr Nb Mo Tc Ru Rh Pd Hf Ta W Re Os Ir Pt IIIB IVB VB VIB VIIB VIII Rf Db Sg Bh Hs Mt Ac-Lr Uun Sc Ti V Cr Mn Fe Co Ni Y La-Lu 21 22 23 24 25 26 27 28 39 40 41 42 43 44 45 46 72 73 74 75 76 77 78 104 105 106 107 108 109 110 57 89 -103 -71 第一过渡 系元素 第二过渡 系元素 第三过渡 系元素

通性 一、共性 1、都有较大的硬度、熔点和沸点。它们的导电性、 导热性好,相互间可形成合金。 2、大多数溶于酸,只是有些“贵”金属电极电势 较大,难与普通的酸反应。 3、除B族外,都有多种氧化态,水合离子和酸 根离子常呈现一定颜色。 4、由于d电子不满,化合物通常是顺磁性化合物。 5、原子半径从左到右逐渐减小
通性 一、共性 1、都有较大的硬度、熔点和沸点。它们的导电性、 导热性好,相互间可形成合金。 2、大多数溶于酸,只是有些“贵”金属电极电势 较大,难与普通的酸反应。 3、除IIIB族外,都有多种氧化态,水合离子和酸 根离子常呈现一定颜色。 4、由于d电子不满,化合物通常是顺磁性化合物。 5、原子半径从左到右逐渐减小

通性 二、电子构型 除Pd外,它们都有未充满的d轨道,最外层也仅 有1-2个电子,过渡元素通常指价电子层结构即: (n-1)dl-9nsl-2。 三、氧化态 它们的(n-1)d和ns轨道能级的能量相差很小,d电 子也可部分或全部作为价电子参加成键。一般由+2价 直到与族数相同的氧化态(VⅡ例外)。 四、单质的化学性质 B族是它们中最活泼的金属,性质与碱土金属 接近。同族元素的活泼性从上到下依次减弱
通性 二、电子构型 除Pd外,它们都有未充满的d轨道,最外层也仅 有1-2个电子,过渡元素通常指价电子层结构即: (n-1)d1-9ns1-2 。 三、氧化态 它们的(n-1)d和ns轨道能级的能量相差很小,d电 子也可部分或全部作为价电子参加成键。一般由+2价 直到与族数相同的氧化态(VIII例外)。 四、单质的化学性质 IIIB族是它们中最活泼的金属,性质与碱土金属 接近。同族元素的活泼性从上到下依次减弱

通性 五、氧化物及其水合物的酸碱性 同种元素,不同氧化态的氧化物,其酸碱性随氧 化数的降低酸性减弱,碱性增强。 Mn207 MnO; MnO2 Mn203 MnO 强酸性 酸性 两性 弱碱性 碱性 这是由于其水合物中非羟基氧的数目减少。 同一过渡系内各元素的最高氧化态的氧化物及水 合物,从左到右碱性减弱,酸性增强。 Sc2O3 TiO CrO; Mn207 强碱 两性 酸性 强酸 同族元素,自上而下各元素相同氧化态的氧化物 及其水合物,通常是酸性减弱,碱性增强。 H,CrO H,MoO H,WO 中强酸 弱酸 两性偏酸性
通性 五、氧化物及其水合物的酸碱性 同种元素,不同氧化态的氧化物,其酸碱性随氧 化数的降低酸性减弱,碱性增强。 Mn2O7 MnO3 MnO2 Mn2O3 MnO 强酸性 酸性 两性 弱碱性 碱性 这是由于其水合物中非羟基氧的数目减少。 同一过渡系内各元素的最高氧化态的氧化物及水 合物,从左到右碱性减弱,酸性增强。 Sc2O3 TiO2 CrO3 Mn2O7 强碱 两性 酸性 强酸 同族元素,自上而下各元素相同氧化态的氧化物 及其水合物,通常是酸性减弱,碱性增强。 H2CrO4 H2MoO4 H2WO4 中强酸 弱酸 两性偏酸性

通性 六、配合性 配合能力强,易形成一系列配合物,因轨道不满 而参加成键时易形成内轨型配合物。 它们的电负性较大,金属离子与配体间的相互作 用加强,形成较稳定的配合物。 中心离子半径在0.0750.06nm范围内的配合物表 现的较突出,主要表现在配位体交换慢,有些很慢。 如:CrCl36HO在水溶液中长期放置: [Cr(H2O)4Cl2*(绿色)+H2O[C(H2O)sCI2+(浅绿色)+CI [Cr(H2O)sCI2+H20[Cr(H,O)6]+(蓝紫色)+CI 过渡元素的性质区别于其它类型的元素,是和它 们具有不全满的d电子有关,这是过渡元素的特点,也 是学习过渡元素化学时应充分注意的
通性 六、配合性 配合能力强,易形成一系列配合物,因d轨道不满 而参加成键时易形成内轨型配合物。 它们的电负性较大,金属离子与配体间的相互作 用加强,形成较稳定的配合物。 中心离子半径在0.075~0.06nm范围内的配合物表 现的较突出,主要表现在配位体交换慢,有些很慢。 如:CrCl3·6H2O在水溶液中长期放置: [Cr(H2O)4Cl2 ] + (绿色)+H2O[Cr(H2O)5Cl]2+(浅绿色)+Cl- [Cr(H2O)5Cl]2++H2O[Cr(H2O)6 ] 3+(蓝紫色)+Cl- 过渡元素的性质区别于其它类型的元素,是和它 们具有不全满的d电子有关,这是过渡元素的特点,也 是学习过渡元素化学时应充分注意的

钛分族 物是 上书 锁石错 钛合金 属性
钛分族 一、存在 钛在地壳中的储量相当丰富(0.45%),主要矿物是 钛铁矿FeTiO3和金红石TiO2,锆以斜锆矿ZrO2和锆英 石ZrSiO4的形式存在,铪总是以锆的百分之几的量和 锆伴生且分离困难。 二、单质的性质和用途 钛抗腐蚀性强、密度小、亲生物及有记忆性的金 属,用于化工、海上设备,医疗、卫星等。锆和铪的 性质极相似,硬度较大、导电不良、外表类似不锈钢。 钛能溶于热的浓HCl 2Ti+6HCl===2TiCl3+3H2↑ 钛更易溶于HF+HCl(H2SO4 ) Ti+6HF===2TiF6 2-+2H++2H2↑ 锆和铪也有上面配合反应的性质。 钛 蓝 宝 石 | 含 钛 刚 玉 镍钛合金 钛合金

钛分族 三、Zr和Hf的分离 钾和铵的氟锆酸盐和氟铪酸盐在溶解度上有明显 的差别,可利用此性质来分离Zr和Hf。 四、金属钛的制备 工业上常用FeTiO3为原料来制金属钛 1、矿石中含有FeO、Fe2O3杂质,先用浓硫酸处理 FeTi03+3H2S04===FeS04+Ti(S04)2+3H20 FeTiO3+2H2SO,---FeSO,+TiOSO+2H2O FeO+H2SO==FeSO+H2O Fe2z03+3H2zS04==Fe2S04)3+3H20 2、加入单质铁把Fe3+离子还原为Fe2+离子,然后 使溶液冷却至273K以下使FeS047H2O结晶析出
钛分族 三、Zr和Hf的分离 钾和铵的氟锆酸盐和氟铪酸盐在溶解度上有明显 的差别,可利用此性质来分离Zr和Hf。 四、金属钛的制备 工业上常用FeTiO3为原料来制金属钛 1、矿石中含有FeO、Fe2O3杂质,先用浓硫酸处理 FeTiO3+3H2SO4===FeSO4+Ti(SO4 )2+3H2O FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O FeO+H2SO4==FeSO4+H2O Fe2O3+3H2SO4===Fe2 (SO4 )3+3H2O 2、加入单质铁把Fe3+离子还原为Fe2+离子,然后 使溶液冷却至273K以下使FeSO4·7H2O结晶析出

钛分族 3、加热煮沸Ti(S04)2和Ti0S04 Ti(SO)2+H2O-=TiOSO,+H2SO TiOSO+H2OA=H2TiO3+H2SO 4、分离煅烧 H2Ti03会Ti02+H20 5、碳氯法 TiO,+2C+2CL00-400KTiCI+2CO 6、在1070K用熔融的镁在氩气氛中还原TiC14可得 海棉钛,再经熔融制得钛锭。 TiCl+2Mg===2MgCl2+Ti
钛分族 3、加热煮沸Ti(SO4 )2和TiOSO4 Ti(SO4 )2+H2O===TiOSO4+H2SO4 TiOSO4+H2O===H2TiO3↓+H2SO4 4、分离煅烧 H2TiO3===TiO2+H2O 5、碳氯法 TiO2+2C+2Cl2======TiCl4+2CO 6、在1070K用熔融的镁在氩气氛中还原TiCl4可得 海棉钛,再经熔融制得钛锭。 TiCl4+2Mg===2MgCl2+Ti 1000-1100K

钛分族 五、钛的化合物 1、T02:金红石、钛白,白色粉末,不溶于水 及稀酸,可溶于F和浓硫酸中。 TiO,+6HF===H2[TiF J+2H2O T4+容易水解得到TiO2+离子一 钛酰离子。 T02是一种优良颜料、催化剂、纳米材料。 2、TiCl4:易水解,为偏钛酸及TiOC2,在浓 HC1中生成H2TiCl6 3、Ti2(S04)3:三价钛的还原性比(Sn2+)稍强 Ti2(S04)3+Fe2(S04)3==2Ti(S04)2+2FeS04 二价钛具有更强的还原性
钛分族 五、钛的化合物 1、TiO2:金红石、钛白,白色粉末,不溶于水 及稀酸,可溶于HF和浓硫酸中。 TiO2+6HF===H2 [TiF6 ]+2H2O Ti4+容易水解得到TiO2+离子——钛酰离子。 TiO2是一种优良颜料、催化剂、纳米材料。 2、TiCl4:易水解,为偏钛酸及TiOCl2,在浓 HCl中生成H2 [TiCl6 ] 3、Ti2 (SO4 )3:三价钛的还原性比(Sn2+)稍强 Ti2 (SO4 )3+Fe2 (SO4 )3===2Ti(SO4 )2+2FeSO4 二价钛具有更强的还原性