过渡元素( (二) 铁系元素 铂系元素 过渡金属的通性 金属小结 本章要求 变
过渡元素(二) 本 章 要 求 铁 系 元 素 铂 系 元 素 作 业 过 渡 金 属 的 通 性 金 属 小 结
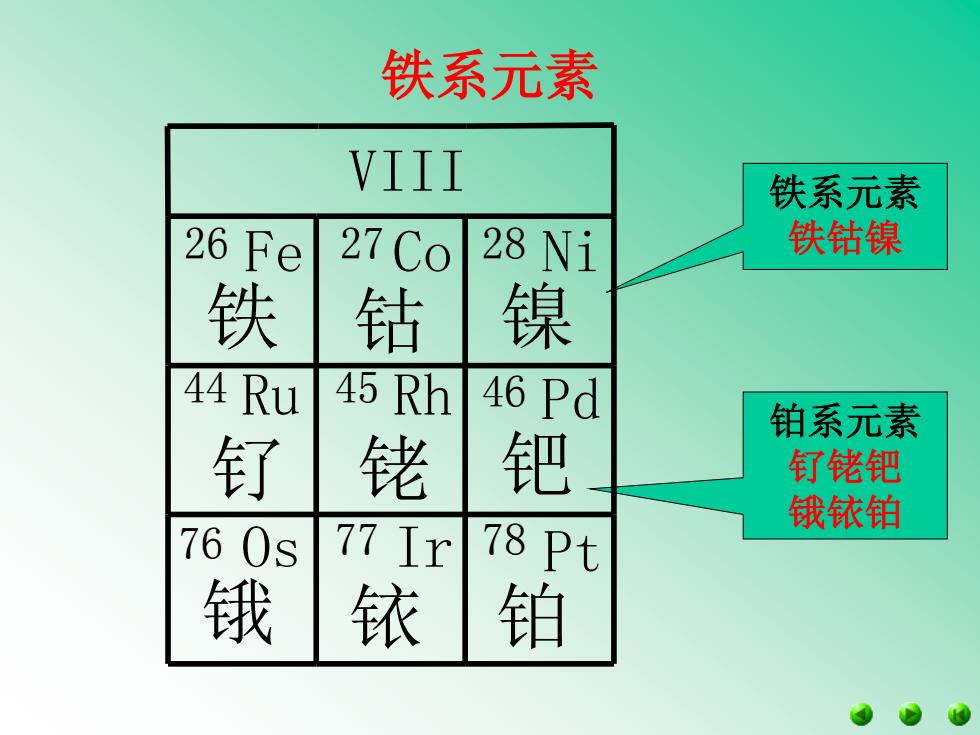
铁系元素 VIII 铁系元素 26 Fe 27 Co 28 Ni 铁钴镍 铁钴 镍 44 Ru 45 Rh 46 Pd 铂系元素 钌 铑 钯 钉铑钯 锇铱铂 760s 77 Ir 78 Pt 锇 铱 铂
铁系元素 铁系元素 铁钴镍 铂系元素 钌铑钯 钌 铑 钯 锇铱铂 锇 铱 铂 铁 钴 镍 Ru Rh Pd Os Ir Pt VIII 26 Fe 27 Co 28 Ni 44 45 46 76 77 78

铁系元素 铁的氧化态有+I、+I、+VI,钴和镍有+、 +IⅡ、+V。 一、单质的性质 钴和镍在常温下对水和空气都较稳定,它们都 溶于稀酸中,但不与强碱发生作用,故熔融碱性物 质可以用镍制容器。和铁不同,钴和镍与浓硝酸激 烈反应,与稀硝酸反应较慢。 钴和镍也都是生物体必需的元素。钴在体内的 重要化合物是维生素B12,它是人类和几乎所有动植 物都必需的营养物。镍对促进体内铁的吸收,红细胞 的增长,氨基酸的合成均有重要的作用
铁系元素 铁的氧化态有+II、+III、+VI,钴和镍有+II、 +III、+IV。 一、单质的性质 钴和镍在常温下对水和空气都较稳定,它们都 溶于稀酸中,但不与强碱发生作用,故熔融碱性物 质可以用镍制容器。和铁不同,钴和镍与浓硝酸激 烈反应,与稀硝酸反应较慢。 钴和镍也都是生物体必需的元素。钴在体内的 重要化合物是维生素B12,它是人类和几乎所有动植 物都必需的营养物。镍对促进体内铁的吸收,红细胞 的增长,氨基酸的合成均有重要的作用

铁系元素 缺铁的直接结果是导致贫血,但一般症状并不很明 显,除非严重性贫血。 近年来,大量证据还表明铁是益智元素之一。铁缺 乏可引起心理活动和智力发育的障碍及行为改变。研究 表明,6-24月龄的儿童若发生缺铁性贫血,其学习和记 忆能力比同月龄的正常儿童显著下降,同时还表现为易 疲劳、有恐惧感。对年龄较大的儿童或青少年缺铁性贫 血者进行认知能力测验,得到了与上述一致的结果。 缺铁性贫血的另一个特点是在寒冷环境中保持体温 能力受损。这种异常产生的原因可能是与甲状腺激素分 泌减少有关。可通过输血使这种异常得到改善。 实验研究表明高水平铁可能有致癌作用或促进肿瘤 生长,强有力的证据是血色素沉着症患者肝癌发病率较 高。高水平铁还能引起心血管疾病、早衰和大脑异常
铁系元素 缺铁的直接结果是导致贫血,但一般症状并不很明 显,除非严重性贫血。 近年来,大量证据还表明铁是益智元素之一。铁缺 乏可引起心理活动和智力发育的障碍及行为改变。研究 表明,6-24月龄的儿童若发生缺铁性贫血,其学习和记 忆能力比同月龄的正常儿童显著下降,同时还表现为易 疲劳、有恐惧感。对年龄较大的儿童或青少年缺铁性贫 血者进行认知能力测验,得到了与上述一致的结果。 缺铁性贫血的另一个特点是在寒冷环境中保持体温 能力受损。这种异常产生的原因可能是与甲状腺激素分 泌减少有关。可通过输血使这种异常得到改善。 实验研究表明高水平铁可能有致癌作用或促进肿瘤 生长,强有力的证据是血色素沉着症患者肝癌发病率较 高。高水平铁还能引起心血管疾病、早衰和大脑异常
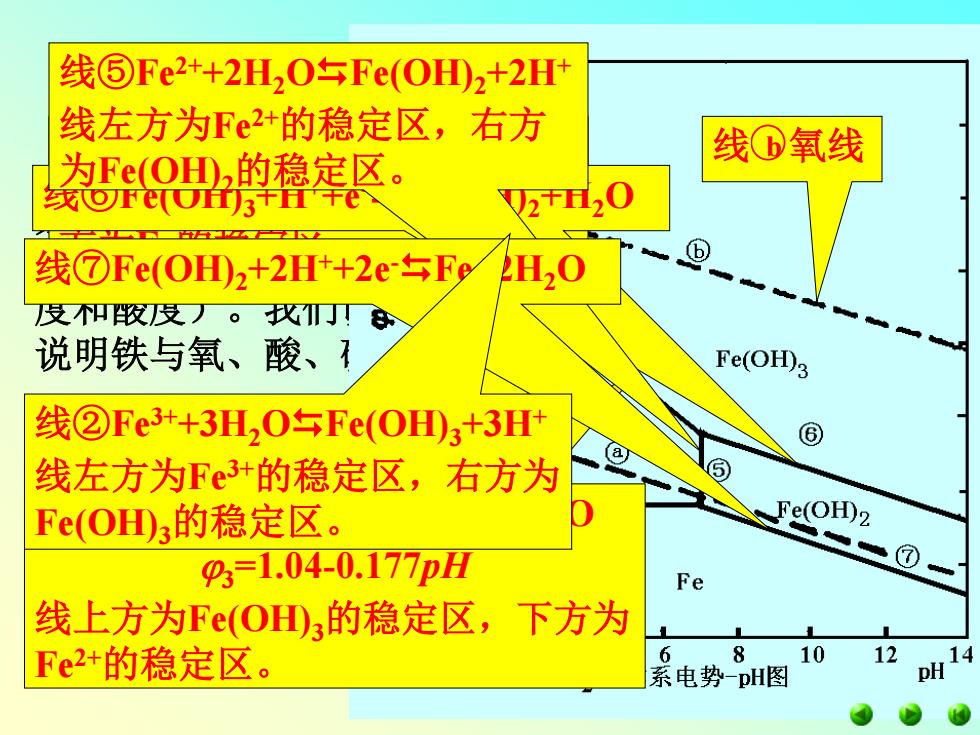
线⑤Fe2++2H,0sFe(0HD2+2H 线左方为Fe2+的稳定区,右方 线①氧线 为Fe(OH山,的稳定区。 线©F心Uf3干T干 V220 E2262 线⑦Fe(OHD2+2Ht+2e占Fe H20 及刚收及)。仪丁丁 说明铁与氧、酸、1 Fe(OH)3 线②Fe3++3H,0午Fe(0H3+3H 线左方为Fe3+的稳定区,右方为 Fe(OH3的稳定区。 Fe(OH)2 9=1.04-0.177pH 。(⑦ Fe 线上方为Fe(OD3的稳定区,下方为 Fe2+的稳定区。 8 10 12 系电势-pH图
铁系元素 二、Fe-H2O体系的电势pH图 电势一pH图就是将各种物质的电极电势与pH的关 系以曲线表示出来,从图中可以直接看出反应自发进 行的可能性,或者要使反应能够进行所需的条件(浓 度和酸度)。我们以Fe-H2O体系的电势一pH图为例, 说明铁与氧、酸、碱等的反应。 线①Fe3++e-Fe2+1=0.771V 线上方为Fe3+的稳定区,线下 方为Fe2+的稳定区。 线③Fe(OH)3+3H++e-Fe2++3H2O 3=1.04-0.177pH 线上方为Fe(OH)3的稳定区,下方为 Fe2+的稳定区。 线④Fe2++2e-Fe4 =-0.473V 线上方为Fe2+的稳定区,线下 方为Fe的稳定区。 线⑥Fe(OH)3+H++e-Fe(OH)2+H2O 线⑤Fe2++2H2OFe(OH)2+2H+ 线左方为Fe2+的稳定区,右方 为Fe(OH)2的稳定区。 线⑦Fe(OH)2+2H++2e-Fe+2H2O 线@氢线 线 b 氧线 线②Fe3++3H2OFe(OH)3+3H+ 线左方为Fe3+的稳定区,右方为 Fe(OH)3的稳定区

铁系元素 三、重要化合物 1、氢氧化物 M2+2OH===M(OHD2↓ Fe(OH)2在空气中易被氧化为Fe(OH)3 Co(OHD2在空气中可被氧化为Co(OHD)3但较慢。 Ni(OD2在空气中不被氧化为Ni(OHD)3。 Co(OHD2,Ni(OHD2在碱性条件下可被NaCIO、溴 水等氧化为相应的三价氢氧化物。试写出反应方程式。 新沉淀的Fe(OHD3略有两性,能溶于热的浓KOH 溶液,生成KFeO2或K3IFe(OD6。试写出反应方程式。 钴和镍的MO3或M(OHD3都是强氧化剂,当与盐 酸反应时生成MCL,与氯气
铁系元素 三、重要化合物 1、氢氧化物 M2++2OH-===M(OH)2↓ Fe(OH)2在空气中易被氧化为Fe(OH)3 Co(OH)2在空气中可被氧化为Co(OH)3但较慢。 Ni(OH)2在空气中不被氧化为Ni(OH)3。 Co(OH)2、Ni(OH)2在碱性条件下可被NaClO、溴 水等氧化为相应的三价氢氧化物。试写出反应方程式。 新沉淀的Fe(OH)3略有两性,能溶于热的浓KOH 溶液,生成KFeO2或K3 [Fe(OH)6 ]。试写出反应方程式。 钴和镍的M2O3或M(OH)3都是强氧化剂,当与盐 酸反应时生成MCl2与氯气
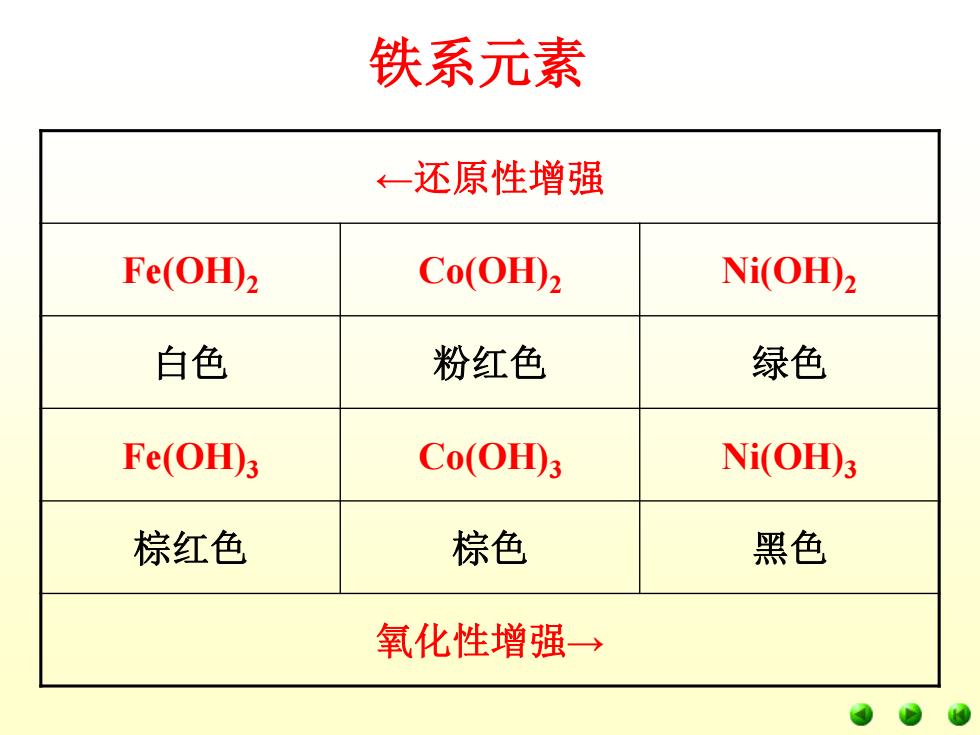
铁系元素 ←-还原性增强 Fe(OH)2 Co(OH)2 Ni(OH)2 白色 粉红色 绿色 Fe(OH田3 Co(OH)3 Ni(OH)3 棕红色 棕色 黑色 氧化性增强→
铁系元素 ←还原性增强 Fe(OH)2 Co(OH)2 Ni(OH)2 白色 粉红色 绿色 Fe(OH)3 Co(OH)3 Ni(OH)3 棕红色 棕色 黑色 氧化性增强→

铁系元素 2、二价盐 Fe(H20)2+浅绿色,Co(HO)62+粉红色, Ni(H2O)62+亮绿色。 无水Fe(D盐白色,CoD蓝色,NiD黄色。 (NH)2SO4FeSO6H2O- 一摩尔盐。 FeSO47H,O称为绿矾。它与摩尔盐都是常用的 还原剂,但由于摩尔盐较稳定,在分析化学中用得多。 CoC1,常用于干燥剂硅胶中的变色剂。 Ca0r6H,025sc0r2H,0363S0 363K 393K ClH2O=CoCl 粉红 紫红 蓝色 蓝色 当干燥硅胶吸水后,逐渐由蓝色变为粉红色, 表示干燥剂失效,放在烘箱中受热失水后可再用
铁系元素 2、二价盐 Fe(H2O)6 2+浅绿色,Co(H2O)6 2+粉红色, Ni(H2O)6 2+亮绿色。 无水Fe(II)盐白色,Co(II)蓝色,Ni(II)黄色。 (NH4 )2SO4·FeSO4·6H2O——摩尔盐。 FeSO4·7H2O称为绿矾。它与摩尔盐都是常用的 还原剂,但由于摩尔盐较稳定,在分析化学中用得多。 CoCl2常用于干燥剂硅胶中的变色剂。 CoCl 2 . 6H2O CoCl 2 . 2H2O CoCl 2 . H2O CoCl 2 325K 363K 393K 粉 红 紫 红 蓝 色 蓝 色 当干燥硅胶吸水后,逐渐由蓝色变为粉红色, 表示干燥剂失效,放在烘箱中受热失水后可再用

铁系元素 3、三价盐 三价铁盐易水解,具有弱氧化性,可把Sn+、上、 HS、Cu等氧化。 三价钴盐和三价镍盐却不稳定具有强氧化性, 易分解。 Fe3+、A3+和Cr3+有许多相似性,如何分离? 利用AI(OH3和Cr(OHD3主要显两性,Fe(OH)3 主要显碱性。而三价铬盐可被氧化为六价铬盐。 即:先加过量的稀NaOH溶液过滤出Fe(OD)3? 在滤液中加入Na202,把NaCr02氧化为Na2Cr04, 再加适量的酸过滤出A(OH)3°
铁系元素 3、三价盐 三价铁盐易水解,具有弱氧化性,可把Sn2+ 、I -、 H2S、Cu等氧化。 三价钴盐和三价镍盐却不稳定具有强氧化性, 易分解。 Fe3+ 、Al3+和Cr3+有许多相似性,如何分离? 利用Al(OH)3和Cr(OH)3主要显两性,Fe(OH)3 主要显碱性。而三价铬盐可被氧化为六价铬盐。 即:先加过量的稀NaOH溶液过滤出Fe(OH)3, 在滤液中加入Na2O2,把NaCrO2氧化为Na2CrO4, 再加适量的酸过滤出Al(OH)3

铁系元素 四、配合物 1、氨配合物 Fe2+、Fe3+离子不形成氨配合物。 Co2+6NH3→Co(NH3)62+(不稳定易被氧化) [Co(NH3)]3++e===[Co(NH3)6l2+B=0.1V 4[CoNH3)62+02+H20-=4[CoNH3)63+4OH 磁矩测定[CoNH,)62+有3个未成对电子,杂化类 型为sp3d2,[CoNH36+中无未成对电子,杂化类型 为d2sp3,稳定性增强。 [NNH3)6J2+是稳定的配合物,有2个未成对电子, 杂化类型为sp3d2
铁系元素 四、配合物 1、氨配合物 Fe2+ 、Fe3+离子不形成氨配合物。 Co2++6NH3→[Co(NH3 )6 ] 2+(不稳定易被氧化) [Co(NH3 )6 ] 3++e-===[Co(NH3 )6 ] 2+ B=0.1V 4[Co(NH3 )6 ] 2++O2+H2O===4[Co(NH3 )6 ] 3++4OH- 磁矩测定[Co(NH3 )6 ] 2+有3个未成对电子,杂化类 型为sp3d 2 ,[Co(NH3 )6 ] 3+中无未成对电子,杂化类型 为d 2 sp3,稳定性增强。 [Ni(NH3 )6 ] 2+是稳定的配合物,有2个未成对电子, 杂化类型为sp3d 2