第三章:原子结构 本章要求 作 道尔顿原子论 核外电子运动状志 基态原子电子组志 元素周期系 元素周期性
第三章:原子结构 道 尔 顿 原 子 论 核 外 电 子 运 动 状 态 作 业 本 章 要 求 基 态 原 子 电 子 组 态 元 素 周 期 系 元 素 周 期 性

道尔顿原子论 如果说近代化学达到了对物质的原子、分子水平 的认识,那么在19世纪初,电子、x一射线、放射性的发 现,则拉开了探索原子、分子内部微观结构的序幕, 使化学进入到一个新的境界。原子结构和分子结构是 结构化学研究的课题,也是无机化学的基本理论。这两 部分内容对如何解释和揭示化学反应的本质是很重要 的。 化学工作者着眼于化学反应,而化学反应则以原 子相互作用为基础的。通常在化学反应中,原子核不 发生变化。那么什么在变呢?电子的运动状态在变, 通俗地说,是核外电子在“跳来跳去”,所以研究核 外电子的运动的规律是化学工作者要探索的重要问题。 本章用了一些量子化学的公式来解释无机化学的 现象和本质,对量子化学公式的推导不作要求
道尔顿原子论 如果说近代化学达到了对物质的原子、分子水平 的认识,那么在19世纪初,电子、x-射线、放射性的发 现,则拉开了探索原子、分子内部微观结构的序幕, 使化学进入到一个新的境界。原子结构和分子结构是 结构化学研究的课题,也是无机化学的基本理论。这两 部分内容对如何解释和揭示化学反应的本质是很重要 的。 化学工作者着眼于化学反应,而化学反应则以原 子相互作用为基础的。通常在化学反应中,原子核不 发生变化。那么什么在变呢?电子的运动状态在变, 通俗地说,是核外电子在“跳来跳去”,所以研究核 外电子的运动的规律是化学工作者要探索的重要问题。 本章用了一些量子化学的公式来解释无机化学的 现象和本质,对量子化学公式的推导不作要求

道尔顿原子论 从1787年开始,中学 地观测气象,为了解释 均匀的混合物”,他于1: 年,道尔顿明确地提出了 有:每一种化学元素有 不同种原子质量不同; 变为另一种原子;化学反 使反应前的物质变成反 道尔顿提出了原子星 对质量的概念,并用大星 的相对质量。道尔顿原 知的化学反应的定量关系 道尔顿,J
从1787年开始,中学教员出身的道尔顿持续不断 地观测气象,为了解释“复杂的大气”为什么“竟是 均匀的混合物”,他于1801年引入原子的假说。1805 年,道尔顿明确地提出了他的原子论,这个理论的要点 有:每一种化学元素有一种原子;同种原子质量相同, 不同种原子质量不同;原子不可再分;一种原子不会转 变为另一种原子;化学反应只是改变了原子的结合方式, 使反应前的物质变成反应后的物质。 道尔顿原子论 道尔顿提出了原子量的概念,实质上就是原子相 对质量的概念,并用大量实验测定了一些元素的原子 的相对质量。道尔顿原子论十分圆满地解释了当时已 知的化学反应的定量关系

道尔顿原子论 不久,道尔顿用自己的原子论导出了倍比定律一若 两种元素化合得到不止一种化合物,这些化合物中的元 素的质量比存在整数倍的比例关系一并用实验予以证实, 例如,他用实验证实,碳和氧有2种化合物一一氧化碳和二 氧化碳,其中碳与氧的质量比是4:3和8:3。 尽管道尔顿提出了原子量的概念,却不能正确给出 许多元素的原子量。例如:设氢的原子量为1,作为相 对原子质量的标准,已知水中氢和氧的质量比是:8, 若水分子是由1个氢原子和1个氧原子构成的,氧的原子 量是8,若水分子是由2个氢原子和1个氧原子构成的, 氧的原子量便是16。道尔顿武断地认为,可以从“思维 经济原则”出发,认定水分子由1个氢原子和1个氧原子 构成,因而就定错了氧的原子量
道尔顿原子论 不久,道尔顿用自己的原子论导出了倍比定律—若 两种元素化合得到不止一种化合物,这些化合物中的元 素的质量比存在整数倍的比例关系—并用实验予以证实, 例如,他用实验证实,碳和氧有2种化合物—一氧化碳和二 氧化碳,其中碳与氧的质量比是4:3和8:3。 尽管道尔顿提出了原子量的概念,却不能正确给出 许多元素的原子量。例如:设氢的原子量为1,作为相 对原子质量的标准,已知水中氢和氧的质量比是1:8, 若水分子是由1个氢原子和1个氧原子构成的,氧的原子 量是8,若水分子是由2个氢原子和1个氧原子构成的, 氧的原子量便是16。道尔顿武断地认为,可以从“思维 经济原则”出发,认定水分子由1个氢原子和1个氧原子 构成,因而就定错了氧的原子量
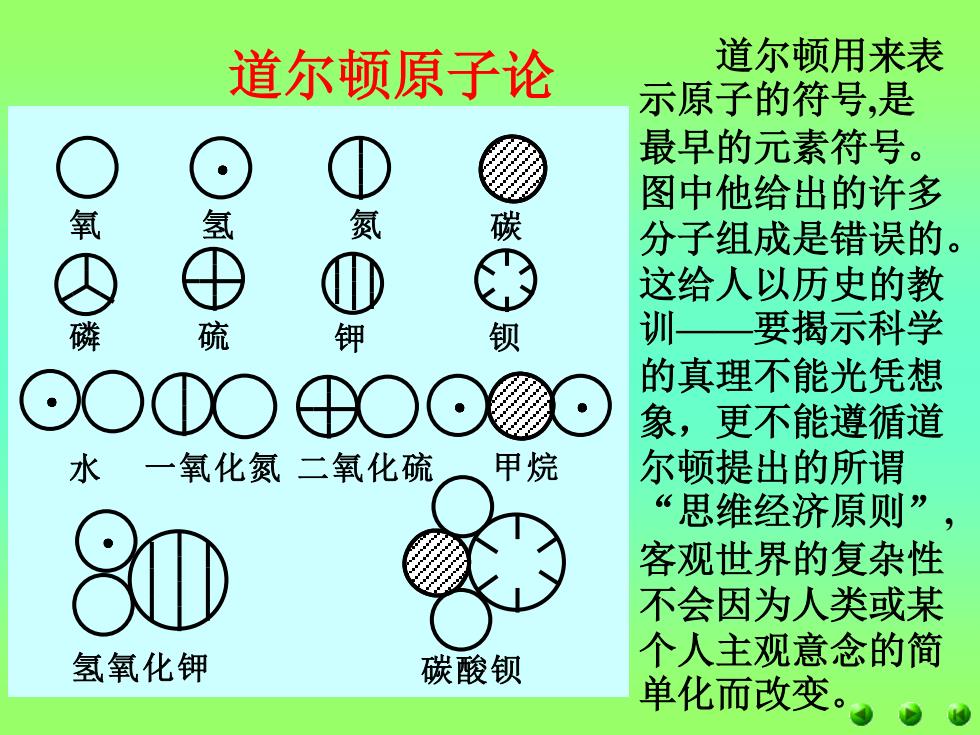
道尔顿原子论 道尔顿用来表 示原子的符号,是 最早的元素符号。 图中他给出的许多 氧 氢 氮 碳 分子组成是错误的。 这给人以历史的教 磷 硫 钾 训—要揭示科学 ⊙O①O⊕O⊙题⊙ 的真理不能光凭想 象,更不能遵循道 水一氧化氮二氧化硫 甲烷 尔顿提出的所谓 “思维经济原则”, 客观世界的复杂性 不会因为人类或某 氢氧化钾 碳酸钡 个人主观意念的简 单化而改变
道尔顿原子论 道尔顿用来表 示原子的符号,是 最早的元素符号。 图中他给出的许多 分子组成是错误的。 这给人以历史的教 训——要揭示科学 的真理不能光凭想 象,更不能遵循道 尔顿提出的所谓 “思维经济原则”, 客观世界的复杂性 不会因为人类或某 个人主观意念的简 单化而改变。 氧 氢 氮 碳 磷 硫 钾 钡 水 一氧化氮 二氧化硫 甲 烷 氢氧化钾 碳酸钡

道尔顿原子论 但道尔顿原子论极大 别是在1818和1826年,瑞典 Berzelius1779-1848)通过 时已知化学元素的原子量 误值,为化学发展奠定了 同时,贝采里乌斯还 物质化学组成和反应的符 达元素符号,一直沿用至今 贝采利乌斯JJ
道尔顿原子论 但道尔顿原子论极大地推动了化学的发展。特 别是在1818和1826年,瑞典化学家贝采里乌斯(C-L. Berzelius 1779-1848)通过大量实验正确地确定了当 时已知化学元素的原子量,纠正了道尔顿原子量的 误值,为化学发展奠定了坚实的实验基础(如表)。 同时,贝采里乌斯还创造性地发展了一套表达 物质化学组成和反应的符号体系,他用拉丁字母表 达元素符号,一直沿用至今

核外电子运动状态 气体装进真空管,真空管 会发光,叫做电致发光。 玉钠灯就是气体的电致发 红光,氩、汞发蓝光。 一词是牛顿根据太阳光通 黄、绿、青、蓝、紫而提 墨大学的基尔霍夫和本生 普学的基础,使光谱分析成 本生,R.W. 重要手段
一、氢原子光谱 焰火是热致发光。把气体装进真空管,真空管 两端施以高压电,气体也会发光,叫做电致发光。 如霓虹灯、高压汞灯、高压钠灯就是气体的电致发 光现象。例如,氢、氖发红光,氩、汞发蓝光。 “光谱” (spectrum)一词是牛顿根据太阳光通 过三棱镜后得到红、橙、黄、绿、青、蓝、紫而提 出的。 到1859年,德国海德堡大学的基尔霍夫和本生 发明了光谱仪,奠定了光谱学的基础,使光谱分析成 为认识物质和鉴定元素的重要手段。 核外电子运动状态

核外电子运动状态 光谱仪可以测量物质发射或吸收的光的波长, 拍摄各种光谱图。光谱图就像“指纹”辨人一样, 可以辨别形成光谱的元素。人们用光谱分析发现了 许多元素,如铯、铷、氦、镓、铟等十几种。 Prism 光源 隙缝 聚光镜 三棱镜 屏幕 光谱仪示意图
核外电子运动状态 光谱仪可以测量物质发射或吸收的光的波长, 拍摄各种光谱图。光谱图就像“指纹”辨人一样, 可以辨别形成光谱的元素。人们用光谱分析发现了 许多元素,如铯、铷、氦、镓、铟等十几种
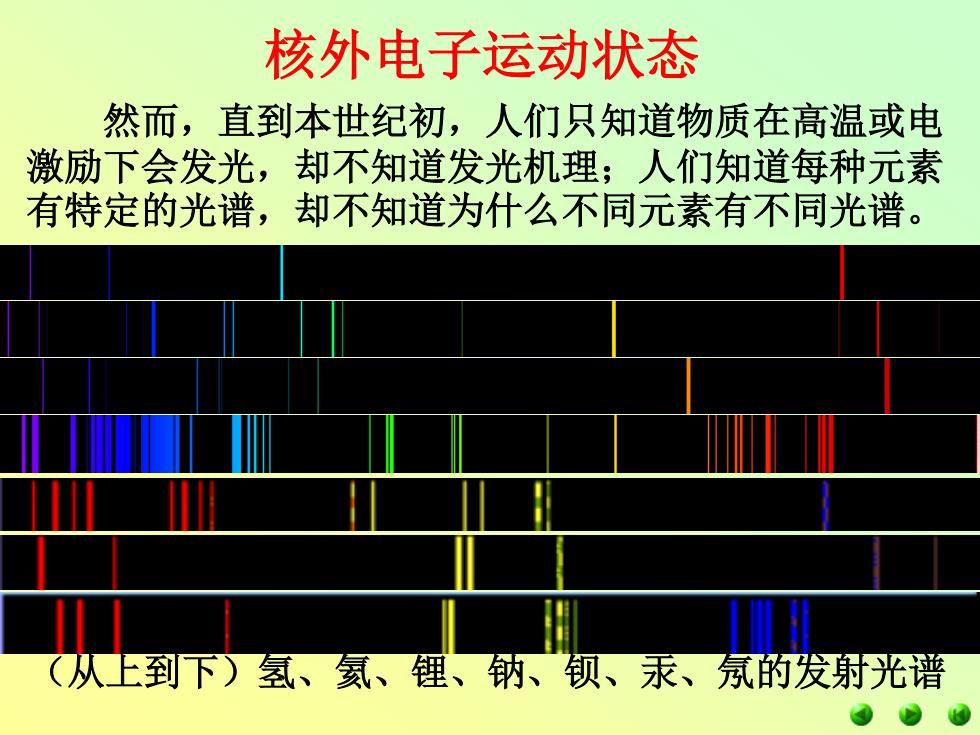
核外电子运动状态 然而,直到本世纪初,人们只知道物质在高温或电 激励下会发光,却不知道发光机理;人们知道每种元素 有特定的光谱,却不知道为什么不同元素有不同光谱。 (从上到下)氢、氦、锂、钠、钡、汞、氖的发射光谱
(从上到下)氢、氦、锂、钠、钡、汞、氖的发射光谱 然而,直到本世纪初,人们只知道物质在高温或电 激励下会发光,却不知道发光机理;人们知道每种元素 有特定的光谱,却不知道为什么不同元素有不同光谱。 核外电子运动状态

核外电子运动状态 氢光谱是所有元素的光谱中最简单的光谱。在可见 光区,它的光谱只由几根分立的线状谱线组成,其波长 和代号如下所示: 谱线 Ho b Hs He… 编号 (n) 2 3 4 5.… 波长 /mm656.279486.133434.048410.175397.009. 不难发现,从红到紫,谱线的波长间隔越来越小。 n>5的谱线密得用肉眼几乎难以区分。1883年,瑞士 的巴尔麦(J.J.Balmer1825-1898)发现,谱线波长() 与编号()之间存在如下经验方程: 3646.00×n2 n2-4
核外电子运动状态 氢光谱是所有元素的光谱中最简单的光谱。在可见 光区,它的光谱只由几根分立的线状谱线组成,其波长 和代号如下所示: 谱线 Hα Hβ Hγ Hδ H … 编号 (n) 1 2 3 4 5 … 波长 /nm 656.279 486.133 434.048 410.175 397.009 … 不难发现,从红到紫,谱线的波长间隔越来越小。 n>5的谱线密得用肉眼几乎难以区分。1883年,瑞士 的巴尔麦(J.J.Balmer 1825-1898)发现,谱线波长(λ) 与编号(n)之间存在如下经验方程: 3646 00 4 2 2 . n n