
第三章 滴定分析概述 •概述 •标准溶液 滴定分析的计算 •滴定分析中的化学平衡
第三章 滴定分析概述 •概述 •标准溶液 •滴定分析的计算 •滴定分析中的化学平衡

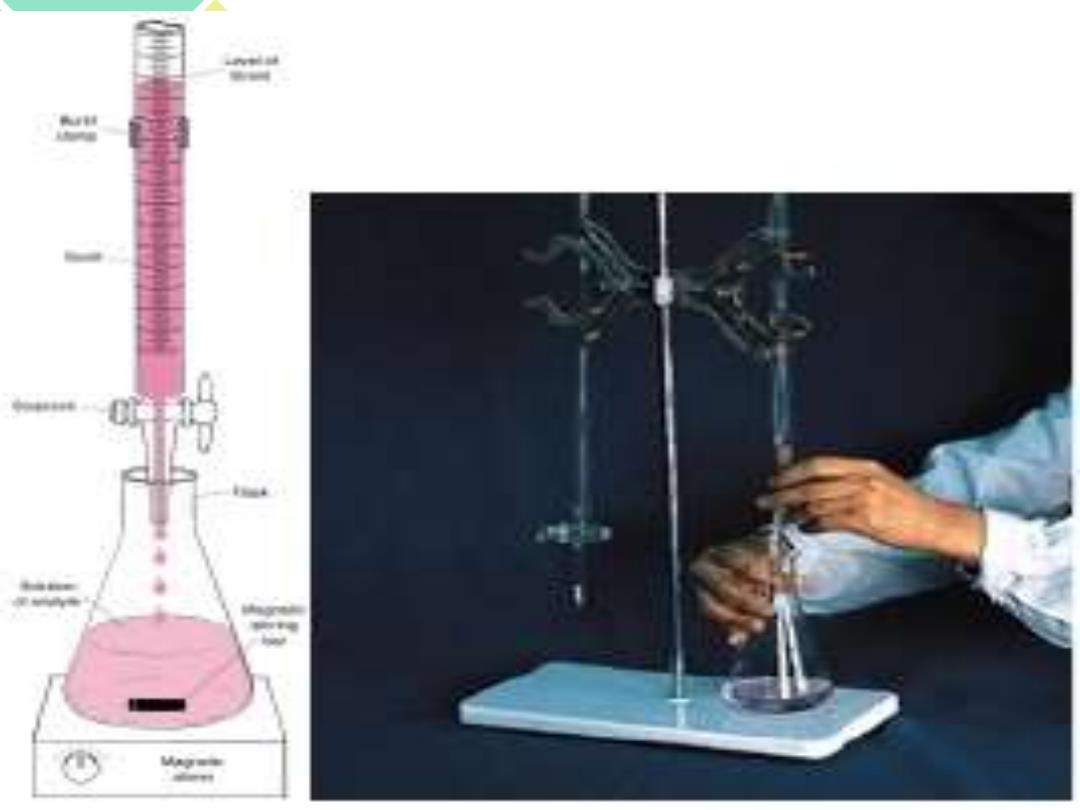
概述 、 滴定分析法 滴定分析法 (titrimetric analysis): •用已知浓度的标准溶液,滴定一定体 30 积的待测溶液,按计量关系反应完全, 计算待测物含量,称为滴定分析法, 该过程称为滴定。 如图右为酸滴定碱的示意简图 100 ml L25
. 概述 •一、滴定分析法 •滴 定 分 析 法 (titrimetric analysis): •用已知浓度的标准溶液,滴定一定体 积的待测溶液,按计量关系反应完全, 计算待测物含量,称为滴定分析法, 该过程称为滴定。 •如图右为酸滴定碱的示意简图

标准溶液:二、 基本概念及术语 (2)滴定剂: (3)滴定: (4)指示剂(indicator) 在被测物质的溶液中加入一种辅助剂,借 助于颜色变化判断化学计量点到达。 (5)化学计量点(stoichiometric point): 加入的滴定剂与被测物质定量反应完全, 称滴定达到了化学计量点
• 二、基本概念及术语 (1)标准溶液: (2)滴定剂: (3)滴定: (4)指示剂(indicator) 在被测物质的溶液中加入一种辅助剂,借 助于颜色变化判断化学计量点到达。 (5)化学计量点(stoichiometric point): 加入的滴定剂与被测物质定量反应完全, 称滴定达到了化学计量点

●(6)滴定终点(end point of the titration): ●滴定分析中,指示剂颜色变化停止滴定, 这一点称为滴定终点。 ●(T)滴定误差(end point error) ● 滴定终点与化学计量点不一致所造成 的误差
⚫(6)滴定终点(end point of the titration): ⚫滴定分析中,指示剂颜色变化停止滴定, 这一点称为滴定终点。 ⚫(7)滴定误差 (end point error) ⚫ 滴定终点与化学计量点不一致所造成 的误差

●(8)滴定分析法的特点: 1)用于常量组分的测定 2)仪器简单、操作简便 3)快速准确 4)应用广泛
⚫(8)滴定分析法的特点: 1)用于常量组分的测定 2)仪器简单、操作简便 3)快速准确 4)应用广泛

3.滴定分析法的分类和对化学反应的要求 3.1.2对化学反应的要求 (1)反应必须定量完成 待测物质与标准溶液之间的反应要严格按 一定的化学计量关系进行,反应定量完成 的程度要达到99.9%以上
3.1滴定分析法的分类和对化学反应的要求 3.1.2对化学反应的要求 (1)反应必须定量完成 待测物质与标准溶液之间的反应要严格按 一定的化学计量关系进行,反应定量完成 的程度要达到99.9%以上

(2)反应必须迅速完成 对于速度较慢的反应可以采取加热、 使用催化剂等措施提高反应速度。 (3)必须有适宜的指示剂或其它简便可 靠的方法确定终点
(2)反应必须迅速完成 对于速度较慢的反应可以采取加热、 使用催化剂等措施提高反应速度。 •(3)必须有适宜的指示剂或其它简便可 靠的方法确定终点

3.2滴定分析分类(按化学反应的类型) 酸碱滴定 •滴定分析 配位滴定 氧化还原滴定 沉淀滴定
3.2滴定分析 分类(按化学反应的类型) 酸碱滴定 •滴定分析 配位滴定 氧化还原滴定 沉淀滴定

(1)酸碱滴定法(acid-base titration) 定义:以质子传递反应为基础的滴定 分析法。 例:用NaOH标准溶液测定HAc含量 OH+HAc-Ac+H,O
(1)酸碱滴定法(acid-base titration) 定义: 以质子传递反应为基础的滴定 分析法。 例: 用NaOH标准溶液测定HAc含量 OH- + HAc → Ac- + H2O