
第三章化学势 偏摩尔量 化学势 气体物质的 启强高等教育”十一玉”国家领规划教材 理想液态混合物 理想稀溶液 物理化学简明教程 依数性 (第四版) ■自水带无正结长样木等到 非理想多组分系统 卷等有反 高等教育出版社 高等教育电子音像出版社
高等教育出版社 高等教育电子音像出版社 理想稀溶液 依数性 非理想多组分系统 理想液态混合物 化学势 偏摩尔量 气体物质的

§3.1偏摩尔量 1.偏摩尔量的定义 2.偏摩尔量的集合公式 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 2 §3.1 偏摩尔量 1. 偏摩尔量的定义 2. 偏摩尔量的集合公式
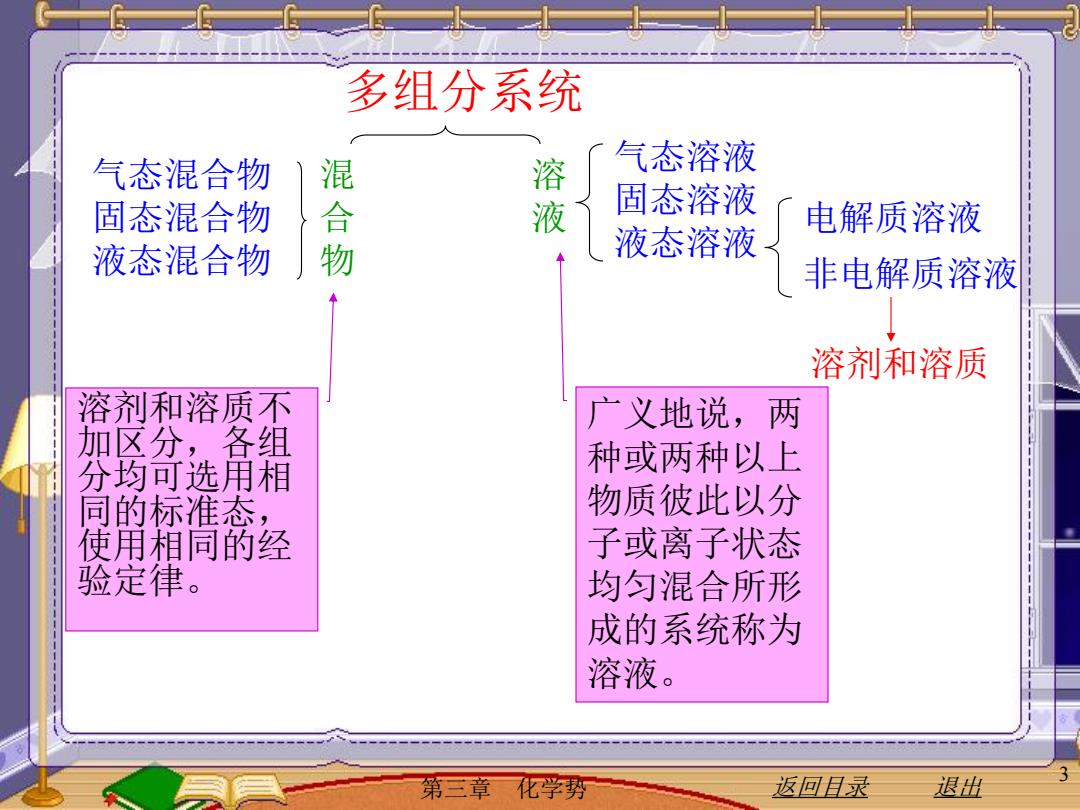
多组分系统 气态混合物 混 溶 气态溶液 固态混合物 合 液 固态溶液 电解质溶液 液态混合物 液态溶液 非电解质溶液 溶剂和溶质 溶剂和溶质不 广义地说,两 加区分,各组 分均可选用相 种或两种以上 同的标准态, 物质彼此以分 使用相同的经 子或离子状态 验定律。 均匀混合所形 成的系统称为 溶液。 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 3 多组分系统 溶 液 混 合 物 气态溶液 固态溶液 液态溶液 电解质溶液 非电解质溶液 溶剂和溶质 气态混合物 固态混合物 液态混合物 溶剂和溶质不 加区分,各组 分均可选用相 同的标准态, 使用相同的经 验定律。 广义地说,两 种或两种以上 物质彼此以分 子或离子状态 均匀混合所形 成的系统称为 溶液

为什么要提出偏摩尔量这个概念? 对于多组分系统,系统状态不仅仅是温度压力的函数 例如25℃和标准压力时 100cm3水+100cm3乙醇 混合物总体积V≈192cm3 150cm3水+50cm3乙醇 混合物总体积V≈195cm3 50cm3水+100cm3乙醇 混合物总体积V≈193cm3 这说明对乙醇和水的混合物来说,虽然指明了系统的温 度和压力,但系统的状态性质 体积却不能确定。 当浓度确定后,例如100cm3(含20%乙醇)乙醇水混合物 +100cm3(含20%乙醇)乙醇水混合物=200cm3 从上例可看出,对于乙醇水混合物,除了指定T,外, 还须指定溶液的组成,才能确定系统的状态。 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 4 为什么要提出偏摩尔量这个概念? 对于多组分系统, 系统状态不仅仅是温度压力的函数 例如25℃和标准压力时 100cm3水+100 cm3乙醇 混合物总体积V ≈192cm3 150cm3水+50 cm3乙醇 混合物总体积V ≈195cm3 50cm3水+100 cm3乙醇 混合物总体积V ≈193cm3 从上例可看出, 对于乙醇水混合物, 除了指定T, p外, 还须指定溶液的组成,才能确定系统的状态。 当浓度确定后,例如 100 cm3 (含20%乙醇)乙醇水混合物 +100 cm3 (含20%乙醇)乙醇水混合物=200 cm3 这说明对乙醇和水的混合物来说,虽然指明了系统的温 度和压力,但系统的状态性质——体积却不能确定

1.偏摩尔量的定义 多组分(B、C、D..)系统中任一容量性质X X=T,p,ng,nc,nD,…) 其全微分表达式为 OX dY= dns /T.p,nC+B 在定温定压的条件下: f XB- aX B物质的偏摩尔量 T,p,nc≠B 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 5 1. 偏摩尔量的定义 多组分(B、C、D……)系统中任一容量性质 X B , B , , , d d d d C B n n X p p X T T X X p nk T nk T p n C B d e f B B T , p , n X X n -----B物质的偏摩尔量 其全微分表达式为 X = f(T, p, nB , nC , nD , ) 在定温定压的条件下:

则其全微分表达式为: OX OX dY dp+∑Xndnp n.ni 在定温定压的条件下,上式可表示为: dX=∑Xgdng B 若是二组分系统 dX-Yadna+XBdnB X是系统中任意一个容量性质。例如 X为体积时,V是物质B的偏摩尔体积: 为吉布斯函数G时,G是物质B的偏摩尔吉布斯 函数,余类推 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 6 B B dX X Bdn 在定温定压的条件下,上式可表示为: B B B , , d d dp X dn p X T T X X k p n k T n 则其全微分表达式为: XB是系统中任意一个容量性质。例如 X为体积V时,VB是物质B的偏摩尔体积; X为吉布斯函数G时,GB是物质B的偏摩尔吉布斯 函数,余类推。 若是二组分系统 dX=XAdnA+XBdnB

X B- ax T,p,nc≠B 注意: (1)只有容量性质有偏摩尔量: (2)必须是等温等压条件: (3)偏摩尔量本身是强度性质(两个容量性质之比); (4)偏摩尔量除了与工,p有关外,还与浓度有关; (⑤)单组分系统X=Xm(如:VB=Vm,GB=Gm》 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 7 注意: (1)只有容量性质有偏摩尔量; (2)必须是等温等压条件; (3)偏摩尔量本身是强度性质(两个容量性质之比); (4)偏摩尔量除了与T, p有关外,还与浓度有关; (5)单组分系统XB =Xm(如: VB =Vm , GB =Gm) C B B , , B T p n def n X X

偏摩尔量的物理意义 ()由定义式可见:定温定压时,往无限大的系统 中加入1molB物质所引起的X的变化,即dX; (2)由偏微商的概念可理解为图中的曲线的斜率。 av B =斜率 ong )T.p.nc nB 返回目录 8 第三章 化学势 退出
第三章 化学势 返回目录 退出 8 偏摩尔量的物理意义 (1)由定义式可见:定温定压时,往无限大的系统 中加入1mol B物质所引起的X的变化,即dX; C B B , , B T p n n V V V nB (2)由偏微商的概念可理解为图中的曲线的斜率。 =斜率 O

2.偏摩尔量的集合公式 一系统如图:A和B的偏摩 nA +nB 尔体积分别为VA,V,则 )Tp dV=Vadna+VednB 如果由纯物质A(nA),B(nB) 配置该系统:连续加入A和 B,并保持系统组成不变, 即dnA:dnB=nA:nB 则 dv=Vdn vodnn 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 9 2. 偏摩尔量的集合公式 nA +nB 则 B 0 A B 0 A 0 d d d A B V V n V n V n n 一系统如图:A和B的偏摩 尔体积分别为VA ,VB ,则 ( )T,p dV=VAdnA+VBdnB 如果由纯物质A(nA), B(nB) 配置该系统: 连续加入A和 B,并保持系统组成不变, 即dnA : dnB = nA : nB

由于制备过程中保持浓度不变,故偏摩尔体积不变: dv=V dn V=VAnA+VBnB X-XANA+XBNB 集合公式 若系统有多个组分,则多组分系统的集合公式为: X=∑XBnB B G=∑GBnB 0 第三章 化学势 返回目录 退出
第三章 化学势 返回目录 退出 10 V = VAnA+ VBnB 若系统有多个组分,则多组分系统的集合公式为: B B X X B n B B B G G n B 0 A B 0 A 0 d d d A B V V n V n V n n X = XAnA+ XBnB ----------集合公式 由于制备过程中保持浓度不变,故偏摩尔体积不变: