
2022年西北大学硕士研究生招生考试试题 科目代码及名称:(635) 化学综合一 共7页 请考生将答案写在答题纸上,写在本试题纸上的答案一律无效 第一部分物理化学(75分) 一、选择题(每个选择题有A、B、C、D四个答案,其中只有一个是正确的。每 小题1分,共15分) 1. 某气体其行为服从状态方程:p(Vm-b)=RT(b>0),该气体发生节流膨胀过程 后: () (A)-T>0,△S>0 (B)-T0 (C)-T=0,△S=0 D)-T不定,△S>0 2. 两液体混合物在p-x图上有最高点,则该混合物在Tx图上产生: (A)最低恒沸点 (B)最高恒沸物 (C)不产生恒沸物 D)稳定化合物 3. 对于带正电的F(OHD3和带负电的Sb2S3溶胶体系的相互作用,下列说法正确 的是: (A)混合后一定发生聚沉 (B)混合后不可能聚沉 (C)聚沉与否取决于Fe和Sb结构是否相似 (D)聚沉与否取决于正、负电量是否接近或相等 4. Rayleigh在研究散射作用后发现,对于单位体积的被研究体系,散射光总能 量与入射光波长之间的关系为 (A)Io1-1 (B)I1(C)Ic14D)I∝14 5. 某固体的蒸气压p与T的关系为lg(p/Pa)=10.65-2560/(TK),则其平均升华热为 (A)2.128 kJ-mol-1 (B)49.02 kJ-mol-1 (C)9.242 kJ-mol-l (D)10.33 kJ-mol-1 6. 当一定的直流电流通过某一含有铜离子的电解质溶液时,在阴极上析出铜的 量正比于 (A)阴极电极面积 (B)溶液中铜离子的浓度 (C)通过的电量 D)阴极距离阳极之间的距离 7.以石墨为阳极,电解6.0 mol-kg-I的NaC1水溶液。己知:[Cl2/C]=1.36V, P[O/OH门=0.401V,Cl2(g)和O2(g)在石墨上的超电势分别为n(Cl2)=0V. 7(O2)尸0.6V,设活度因子均为1。在电解时阳极上首先析出 (A)Cl2(g)(B)Oz(g) (C)C12(g)和O2(g)混合气体 D)无气体析出 第1页

8. 已知,能级的能量和简并度s与基态能级的能单m和简并度g0的犬系为 &4w,g,=2go,在温度定时,根括Boltzmann分布,在i能级与基态上 的粒数之I北(M'o)为 (A)2exp(-3) (B)exp(-3 (C)2exp(3avkD) (D)cxp(-Dk7门 9.知,(H,0.291K)-4.89102Sm°.mo.此时(291K)纯水中的: mH)-i(OH)=7.8l0 nol-kg.则该温度下沌水的电导克率为: (A)3.81x10Sm (B)3.81x10Sm (C)7.6310°Sm (D)?.6310Sm1 10.某应的计方程和速率方程分别为:2A1B2D: -!_-B-D=灯AB:则该收应的分千数为: 2 dr dr 2 dr (A)单分∫了反应 (B)双分于反应 ()三分子反应 (D)不能确定 山.将大分子电解质N、R的水溶浓与纯水用半透膜隔开.人分子电解质中的 R不能透过途骏,其余小离∫和水分于可以。达到Donnan半衡后,股外 水的pH将 (A)>7 (3)7 (C)7(D)不能确定 12.一个简场的测E细管内伦足均)的方法。在洁净的玻璃干细管内放少 的纯水,将工细管水平放置,发现水一直向左方移动,说明 (A)内位不均),向左逐渐变细 (B)内价不均),向左让渐变相 ()内伦均),水称动是正常的 (D)该方法不能说明问题 13.温、等小下,1mol术和1ol甲米形成了液念混合物,现在要将两分 定个分离为纯组分,竿少要做的非休和功的数值为 (A)R71n0.5(B)2Rnn0.5(C)-2R/1n0.5D) R7In0.5 14.菜双原子分子分解尺应的临界能为83.68,在300K时活化分所古的 分数尽 (A)6.17x1013% (B)6.17、101% (C)2.681010。 (D)2.68x1013。 15,卜列热力学性质的配分图数失达式与体系巾粒的可辨与否无关的是 (A)S、G、A、C、(B)G、A、H、U(C)以、H、C、P(D)S、、H、G .、填空题(每空1分,共15分) 1. 只化学及应若在但温相6下(29815K,10P)进行,放热40k.若使 该反应酒温恒压通过可逆电池来完成,则吸热4kJ。计算该反应的培及 为一·熵变为一。 弟2页

2. 将反应Ag*+C一→AgCs)设成电池为: ,已2082K时,中池电 势3:0.576V,则中池应的.L,(im9-_ 3. 失汉应物消耗掉50°。75,所需的时间分别为11:和14,若反应级数分判是一 级则1:一一·级则1= 4. 在:293K刷内弱的表而张力为)-0.0233Nm.度)790kgm3.将半为 0.01cm的毛细治插入其中,液面上升了_一。 5. 对丁gl的水溶校,当以K1为格定剂时,具特构式以成 当加入中解质aC1.1gSO,cC,KFc(N)时,对该溶胶探沉能力 最强的足。.。 6. 298K时,已CH:COOH(0),()(g)和H,CO(I)的标准浮尔片.成含 4H,kJl)分别为-4S4.5,-393.5相-285.5,则(H:(O011)的 标准冷尔燃处哈.1Hn-_Jmo、 在等温等卡的水件卜,有…个A和B组成的均相系统。若人的偏学尔体积 边浓度的改作增加.电B的院烨尔休积随浓度将。〈填湾加、减小或 不变)】 8. 在0100℃的汽内,液态水的蒸气生与T的大茶为:g)一265T +11.101,长尚原地区的气卡只有59995P.则该地×水的沸点为C。 9 某及应在340K时的速率茶数k0.292mil,活化能Fa-1033kmo。则 湿度1.升10K后的半哀期(:、_mn 10.然十空气中的球液膜,名其血径为210m,长面张力为0.7Nm, 该液膜所受的附加压力为一 11.胶体粒的Z:电势是指_ 三、计算边(10分) 浓体A360K的饱和蒸'(6为81.06P:,在此条件下A()的摩尔化热 40kJmol.(2.m.A=75 J-Kmol!.Cm.g=(30+10J-K.mol, S9e-174.35JKm0.民定Ag)为理想(体, 计兑1molA()在下列始终.间的AUm·⊥Hm,1S·A4nm及(Gm 4(l.310K.S1.06kPa)->A(g.38)K.50.66kPa) 四、计算题(10分) H电池:P(s)H(g.1.0kPa)I1Br(0.I mol kg')AgBr(s)Ag(s) :298K时电动势E-0.165Y.AgBr()的活度常数Kn1.0x10, 属银电极的协准电极电势[Ag*/Ag0.79V: (1)写出电极反应和电池反应: (2)计算电池的标准电动势9: (3)i计算H3r(0.1 nol kg)的中均活度小了yt,设气是埋想气作, 第3功

五、计算题(10分) 两个都是二级的平行反应 A:En1 ·C(1"物) KEa? →D(wh) ()若A和B的起始浓度都分,试推导该行反应迷弃方程的定积分式: (2)在500K时.当起始沐度a-0.50 mol dm,纶过30mn后,得到C和D的 浓度分别为0.075wd3利0.1251 nol-dm.求速拖系数k1f和lk: (3)在500K时,心1a1=150kJo,求E:的值。设两个反应的指前因 相的,即.41=A (4)为了提尚1产物的比例,州公式说明升高温度有利还是降有利。 六、计算题(15分) Vcso电池是测定电池电动势常用的标准电池,其负报为福求齐,正极是 求-硫酸亚水电极,电解液采用硫被镉的不泡利和水溶液。 (I)与出此协准电池的衣巡式、电极反应和电池反泣: (2)清问作为小祖电池应该具有哪些特红? (3)下图为HgCd的二分相图,请写出区域1、Ⅱ、m、T和1',以及CDE 线的相数相态 (4)绘出中状念点为a、b、c三个样品的步冷曲线图。并注明各阶段时的相变 化。 pe B 593 区城1 C.. b 之菜冈 513 455 E 433 城 353 298 273 HG 0.050.14 025 065 Hg Cd)) Cd Hg-Cd的二组分相图 第4页
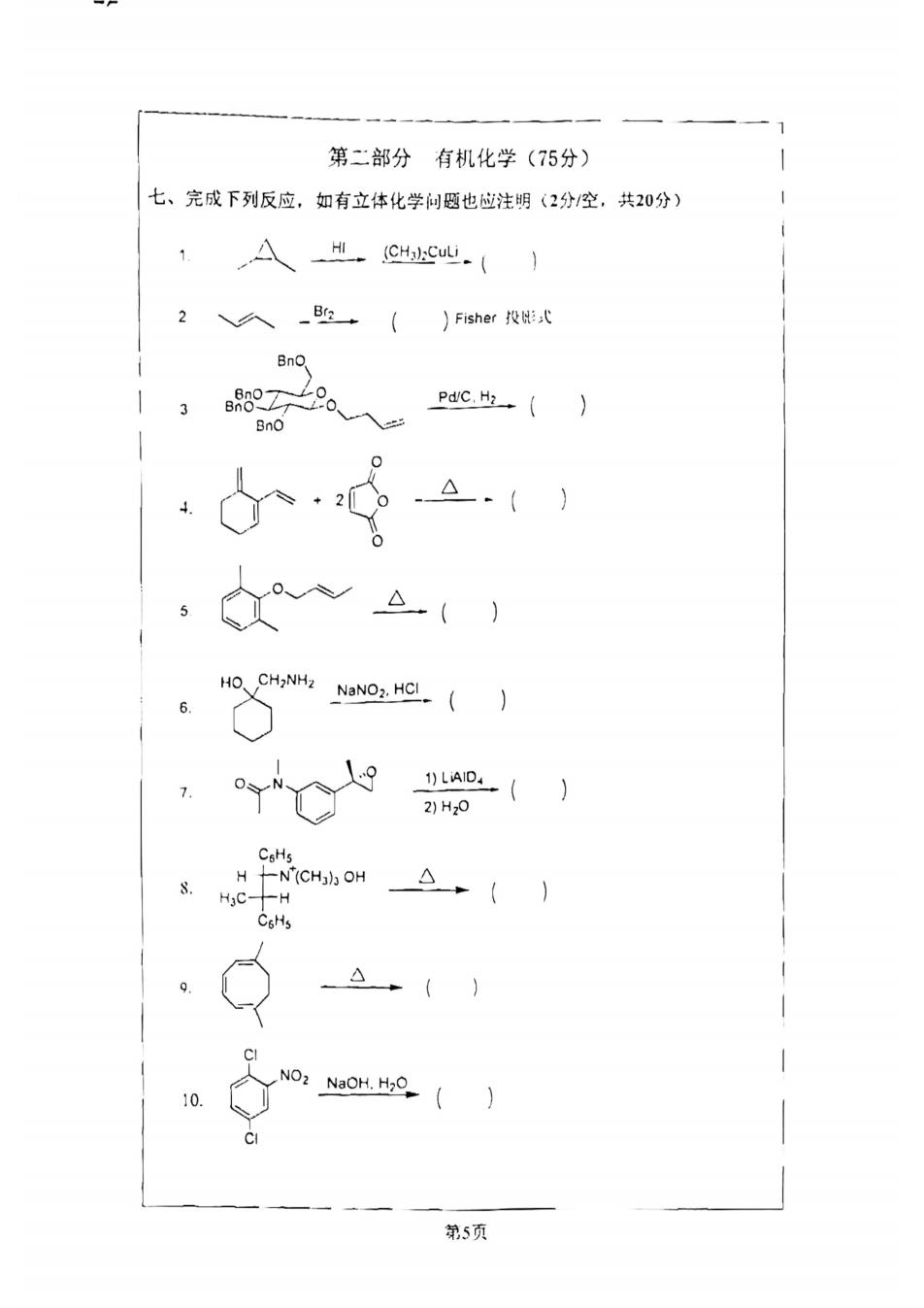
第二部分有机化学(75分) 七、完成下列反应,如有立体化学问题也应注明(2分/空,共20分) 1 (CHSu.() 2 )Fisher投:式 BnO 0、 BnO 20 HO.CH2NH2 NaNO2.HC.(J C 2)Hz0 CsHs H十N"(CH])3 OH H3C-H CoHs ci NO2 10 NaOH.H2】 CI 第5页

八、选择题(2分1题,共10分) 1.下列化合物没有旋光性的是(): XXw OH OH OH H:N OH OH B D 2.一乙胶(a),NHb,吡(c),t(d的碱性强到次子为( A:u>b>edB:abd小心(C:a>eh>d D:a>c>d-b 3,Hofinann排反应的条件是()。 A.Br2,hv B.Br2.Fe C.Br:,NaOH D.Bi2.CCls 4.在NNH:任在卜,卜面化合物易与术醛发生加成的是()。 CH3 CH3 0 5.如下反应中,最终产物T的结构式是()。 CO2H SOCi2 LIAIH(O'Bul3 Ph3P=CHCO2Me TM CO2Me A CO2Me 0 九、写出下列反应的历程(5分/题,共10分) 第6负

NaOH.H2o 十、由指定原料及必要的试剂合成H标产物(5分/题,共20分) 1.以不超过3个碳行机物为原料合成 2从甲苯合成 OH OH 3.1乙酰乙酸乙脂和其他必要的原料合成 4.用对三瓶甲基术甲醛和必要的原料合成 十一、推测结构(8分) 化介胸A(Cl()能与羟胺反应得B(CHNO)。A与十伦试剂不反应,们与 NaOH溶液作用冉酸化后得·种酸C,C资化得术甲酸。A在被性丞件下与 乙-醇作HD(CHO).1D的HNMR为:1.3(s.3H.2.S(s.2H).3.6-38(m 4H).7.1-7.3(m,5H)。武推断A、B、C和D的可能结构.1核磁数据.并j:反 应方样式。 十二、头验题(7分) 川水杨酸、醋袋酐、浓硫酸方法制备7酰水杨酸(阿可匹林),清简要回公 卜的问邀:1)出反应力程式及能的副产物:2)木实验使用車结品进行纯 化,简述重结品的操作步骤:)如虹问快速检测本实验所得阿匹林的纯度:4) 木实验中浓硫酸的作用是什么? 弟7页

2022年西北大学硕士研究生招生考试试题 科目代码及名称: (826) 化学综合二 共6页 请考生将答案写在答题纸上,写在本试题纸上的答案一律无效 第一部分无机化学(75分) 一、单项选择题(每题1分,共20分) 1. 证明电子具有波动性的方法是 () A.使用德布罗意关系式计算 B.使用加速电子通过晶体薄片形成衍射图 C.使用相机对电子照相 D.利用原子光谱 2. 下列各组量子数中,合理的一组是 A.n=4,1=2,m=+3,ms=+1/2 B.n=3,1=1,m=+1,ms=-1/2 C.n=4,1=6,m=0,ms=+1/2 D.n=3,1=3,m=+1,ms=-1/2 3.下列离子的外层轨道为电子全充满的是 () A.Cut B.Fe2+C.Mn2+D.Co2+ 4.下列物质中既有共价键又有离子键的是 A.NH4+B.Cl2 C.CO2 D.NaNO3 5. 下列互为等电子体的一组是 A.SO3,BCl3,CO32,NO3 B.CO,N2,NO,NaH C.SO2,NO2,OCN-,N3 D.NH3,PH3,C2,HCI 6. 下列哪个分子中至少有两个不同长度的键 A.ClO4 B.SF4 C.XeF4 D.CO32. 7. 按VSEPR理论,NO2的键角∠ONO应是 () A.大于120°B.等于120°C.介于109.5~120° D.小于109° 8. 某温度下,A+B=2C反应达到平衡,若增大或减少B的量,不影响C 和A的平衡浓度,则B的说法正确的是 () A.B是气体B.B是溶液C.B是纯固体或纯液体D.以上都不是 9. 有20克水,在100℃和标准压力下如有18克汽化为100℃1个标准压力下 的水蒸气,此时Gibbs自由能变为 () A.△G>0B.△G<0C.△G=0D.无法判断 10.比较室温同浓度NaPO4、Na2HPO4和NaH2PO.4溶液的水解度 第1页

A.三者相等B.NazHPO4最大C.NaH2PO4最大D.Na3PO4最大 11.pH=4和pH=8的溶液中H的浓度相差 () A.100倍B.10000倍C.4倍D.12倍 12.已知:E(Fe3+/Fe2)=+0.77V,E9(Sn4+/Sn2=+0.15V,不能共存在同 一溶液中的离子对是 () A.Fe3+和Fe2+B.Sn4+和Sn2+C.Sn4+和Fe2+D.Fe3+和Sn2t 13.下列化合物显反磁性的是 A.CuCl2 B.Mn(NO3)2 C.TiF3 D.VOCl 14.在[CoNH)4C]中,金属离子的配位数和氧化数分别为 A.2和+2B.6和+3C.4和+3D.6和+2 15.下列钡盐中,在酸中溶解度最小的是 A.BaCO3 B.BaCrO4 C.BaSO4 D.Ba(NO3)2 16.下列各物质中,中心原子轨道杂化类型不同的是 A.CH4与SiH4B.CF4与SF4C.HO+与NH3D.CH4与NH4 17.下列物质只有还原性的是 A.Na2S2 B.Na2SO3 C.Na2S D.Na2S203 18.由镧系收缩引起下列哪一组元素的性质相似 A.Sc和LaB.Cr和MoC.Co和NiD.Nb和Ta 19.下列氢化物,在室温下与水反应不产生氢气的是 A.NH3 B.SiH4 C.LiAlH4 D.CaH2 20. CeCl3nH0在高温(823K)空气中加热,最后的产物是 A.CeOCl B.CeCl3 C.Ce2O3 D.CeO2 二、 填空题(每空格1分,共20分) 1. 原子轨道线性组合成分子轨道的三条原则是: 2. 写出对应物质化学式:芒硝 纯碱 烧 碱 ;萤石 重品石 ;天青石 3. 某温度下反应2N0(g)+O2(g)=2NO2(g)的速率常数k=8.8×102mol2. dmsl,已知反应对02来说是一级反应,则对NO为 级反应,反应的 速率方程为 :当反应物浓度均为0.05 mol-dm3时,反应的速率 是 4. Mn(acac)的磁矩为4.90B,则中心原子Mn的氧化态为 配位数 为 ;单电子数为 ;空间几何构型为 杂化轨道类 型为 5 X原子的M层比Y原子的M层少4个电子,X原子比Y原子的N层少5电子。则 X的元素符号为 ,Y的元素符号为 X和过量Y的两种单质 在密闭反应器中反应得到化合物的化学式为 第2页

三、判断正(√)误(×)题(每题1分,共15分) 1. 对多电子原子,若几个电子处同一能级组,则它们的能量也相同。() 2. Be的核电荷大于Li,但电子亲合能却比Li的小。 () 3. 02,02,02,02的键级分别为1,2,2.5和1.5,因此它们的稳定性次序 为02*>02>02>022。 () 4. 由于Si原子和C1原子的电负性不同,所以SiCl4分子具有极性。 () 5. 分子中的π键电子不决定分子的几何构型,但影响键角的大小。 () 6. 如果△H>0,△,S鼎<0,则该反应在任何温度下都是非自发的。 () 7. 根据价键理论,形成外轨型配合物时,中心原子用的都是外层轨道,形成 内轨型配合物时,中心原子用的都是内层轨道。 () 8. FeC,,KMnO4和H2O2是常见的氧化剂,当溶液中[H增大时,它们的氧 化能力都增加。 () 9. 配合物的中心原子的配位数等于该中心原子配位的配体数。 () 10.MX2Y2Z2八面体型化合物有4种立体异构体。 () 11.将离子Na+,K+,A1+,NO,HC0和SO42混合时,会有反应发生。() 12.碱金属和碱土金属很活泼,故自然界中没有它们的游离状态。 () 13.NO2和NaOH溶液反应生成亚硝酸钠和硝酸钠的混合溶液。 () 14.Fe3+能氧化I,而[Fe(CN)3不能氧化,可知Fe(CN)的稳定常数小于 [Fe(CN)4的稳定常数。 () 15.镧系元素的价电子构型为4f0146s2,所以最稳定的氧化态是+2。 () 四、计算题(每题5分,共20分) 1.固体CrCl6H0具有三种异构体:[Cr(H2O)6Cl、[CrH2O)sCI]C2HO和 [Cr(H2O)4C2]C2H20,称量0.5728g的CrCl36H20配制溶液通过氢离子交换 柱,之后用标准NaOH(0.149molL)溶液滴定交换出的Ht,消耗了NaOH 溶液28.84mL,请确定此C(II⑩)配合物的化学式是上述异构体的哪一种。(相 对原子质量:Cr52.00:H1.008;C135.45:016.00) 2.在标准状况下,根据热力学近似计算并判断NH4CI的升华分解反应在 100℃时能否自发进行? NH4CI(s) NH3 (g) HCI (g) 在25℃,100kPa下,NH4Cl(S) NH:(g) HCI(g) △rH/kJmol -314.4 -46.1 -92.3 /JmolK 94.56 192.34 186.82 3.已知KH)=6.8×104,K°NH)=1.8×105,请计算K°(F)和K°NH4。 4.海水中Mg2+的浓度大约为0.059 mol-dm3,在工业提取镁的过程中,首先把 Mg2+转化成Mg(OH2沉淀,然后进行提取。如果一个海水样品的OH浓度为 2.0×103 mol-dm3,那么沉淀完全后,Mg2+的浓度是多少? 第3页