
课程教案 课程名称有机化学 课程代码PHAR1020 课程属性大类基础课 主讲教师陈维一 授课对象药学、生物制药、中药专业
课程教案 课程名称 有机化学 课程代码 PHAR1020 课程属性 大类基础课 主讲教师 陈维一 授课对象 药学、生物制药、中药专业

第一章绪论 一、教学目标 1.掌握有机化合物和有机化学的概念。 2.了解有机化合物的一般特性。 3.掌握有机化合物的分类、结构和官能团等概念。 4.了解共价键理论及其属性。 5.重点掌握杂化轨道理论、碳原子的杂化类型。 6.掌握有机化学反应的基本类型和反应中间体的概念。 7.了解研究有机化合物的一般步骤。 8.了解有机化学中的酸碱理论。 二、教学重点 1.有机化合物和有机化学的概念: 2.有机化合物的分类、结构和官能团等概念: 3.杂化轨道理论、碳原子的杂化类型。 三、教学过程 1.有机化合物和有机化学概念 有机化合物是指烃类化合物及其衍生物。有机化学是研究有机化合物的来源、组成、结 构、性质、合成、变化和伴随这些变化所发生的一系列现象以及应用,并发展与之相关的理 论和方法的一门学科。 2.有机化合物一般特性 有机化合物的一般特性是:能燃烧:热稳定性差,受热易分解:大多数为非极性或极 性较弱的化合物,难溶于水易溶于有机溶剂:有机化学反应一般较慢并常伴有副产物生成。 3.有机化合物分类 按碳链骨架分类:开链化合物、碳环(脂环、芳环)化合物、杂环(脂杂环、芳杂环) 化合物。按官能团分类。 4.有机化合物的结构 (1)构造及其表示 分子中原子间的连接顺序和方式称为分子的构造,表示构造的化学式称为构造式,也 叫结构式,早期因分析测试技术落后认为构造即代表了结构而得名,本课程若无具体要求, 提及结构式一般就是指构造式。 构造式的表示有多种方法。常见的有:价键式、结构简式、键线式。其中结构简式和 键线式较为常用。 H H-C-0-H CH2=CH OH 价键式 结构简式 键线式 (2)构型、构象及其表示 分子中原子或基团的空间排布(即原子和基团的空间伸展方向,有线型、面型或体型) 统称立体结构,包括构型和构象。 构型指分子中由于存在限制单键自由旋转的因素(双键或环),使受限键端的原子和基
第一章 绪论 一、教学目标 1. 掌握有机化合物和有机化学的概念。 2. 了解有机化合物的一般特性。 3. 掌握有机化合物的分类、结构和官能团等概念。 4. 了解共价键理论及其属性。 5. 重点掌握杂化轨道理论、碳原子的杂化类型。 6. 掌握有机化学反应的基本类型和反应中间体的概念。 7. 了解研究有机化合物的一般步骤。 8. 了解有机化学中的酸碱理论。 二、教学重点 1. 有机化合物和有机化学的概念; 2. 有机化合物的分类、结构和官能团等概念; 3. 杂化轨道理论、碳原子的杂化类型。 三、教学过程 1. 有机化合物和有机化学概念 有机化合物是指烃类化合物及其衍生物。有机化学是研究有机化合物的来源、组成、结 构、性质、合成、变化和伴随这些变化所发生的一系列现象以及应用,并发展与之相关的理 论和方法的一门学科。 2. 有机化合物一般特性 有机化合物的一般特性是:能燃烧;热稳定性差,受热易分解;大多数为非极性或极 性较弱的化合物,难溶于水易溶于有机溶剂;有机化学反应一般较慢并常伴有副产物生成。 3. 有机化合物分类 按碳链骨架分类:开链化合物、碳环(脂环、芳环)化合物、杂环(脂杂环、芳杂环) 化合物。按官能团分类。 4. 有机化合物的结构 (1)构造及其表示 分子中原子间的连接顺序和方式称为分子的构造,表示构造的化学式称为构造式,也 叫结构式,早期因分析测试技术落后认为构造即代表了结构而得名,本课程若无具体要求, 提及结构式一般就是指构造式。 构造式的表示有多种方法。常见的有:价键式、结构简式、键线式。其中结构简式和 键线式较为常用。 CH2=CH2 OH 价键式 结构简式 键线式 C O H H H H (2)构型、构象及其表示 分子中原子或基团的空间排布(即原子和基团的空间伸展方向,有线型、面型或体型) 统称立体结构,包括构型和构象。 构型指分子中由于存在限制单键自由旋转的因素(双键或环),使受限键端的原子和基

团在空间的相对位置被固定,不同构型之间的转变需要通过共价键的断裂和重建才能完成。 构象指分子中由碳碳单键旋转而产生的原子和基团在空间排列的无数特定的形象。不同构象 之间可以相互转变,不要求共价键的断裂和重建。各种构象中,势能最低、最稳定的构象称 优势构象。 立体结构的表示主要有:伞形透视式、锯架透视式、纽曼投影式、费歇尔投影式、哈沃 斯透视式。例如: CHO CH2OH -O.H OH 8加/ OH CH2OH H OH 伞形式 锯架式 纽曼投影式 费歌尔投影式 哈沃斯透视式 5.杂化轨道理论 碳原子经激发,其最外层不同的原子轨道间发生线性组合,形成能量等同的新轨道, 这个过程称为杂化,形成的新轨道称杂化轨道。 碳原子有三种杂化类型:sp3、sp和sp: 6.共价键属性 共价键属性指共价键的重要参数,主要有键长、键角、键能、键的极性和极化。 键长:形成共价键的两个原子核间的平均距离。键角:同一原子上两个共价键之间的夹 角。键能:双原子气态分子分解为气态原子所需要的能量,即离解能。对于双原子分子,键 的离解能就是键能。 7.键的极性和极化 共价键分为非极性共价键和极性共价键。成键的两个原子电负性无差异、成键原子间 电子云均匀分布在两核之间的,称为非极性共价键:反之,成键原子间的电子云不是平均分 布,而是偏向电负性大的原子一边,使一个原子带有部分负电荷而另一个原子带有部分正电 荷,这样的共价键称为极性共价键。 键的极性取决于两个成键原子的电负性差异,差异越大,极性越大。例如,C-X键的极 性大小顺序为:C-F>C-CI>C-Br>CI。 在外界电场作用下使共价键极性发生改变称为极化。共价键极化的难易程度称为极化 度。键的极化的难易与原子核对最外层电子云的吸引能力有关,吸引力越大,键的极化越难, 反之则越易。例如,C-X键的极化度大小顺序为:C-1>C-Br>C-CI>CF。 键的极性是永久现象,键的极化是暂时现象,外界电场消失,键的极化也消失。 8.共价键的断裂方式 共价键断裂方式分为均裂和异裂。 均裂:共价键断裂时,成键原子之间的一对共用电子对均匀分裂,两原子各获一个电子, 生成两个带单电子的自由基。 异裂:共价键断裂时,成键原子之间的一对共用电子对由一个原子或基团独得形成负离 子,另一个原子失去一个电子形成正离子。 9.有机反应类型和有机反应中间体 有机反应类型按共价键断裂方式的不同分为自由基反应、离子型反应和周环反应。 自由基反应:发生共价键均裂的反应称自由基反应。 离子型反应:由共价键异裂而进行的反应称离子型反应。碳自由基和碳正离子都是Sp 杂化的平面构型:简单的碳负离子为sp杂化的三角锥形,但也有以sp杂化出现而成平面 型几何结构(如环戊二烯碳负离子等)。 10.有机化学中的酸碱理论
团在空间的相对位置被固定,不同构型之间的转变需要通过共价键的断裂和重建才能完成。 构象指分子中由碳碳单键旋转而产生的原子和基团在空间排列的无数特定的形象。不同构象 之间可以相互转变,不要求共价键的断裂和重建。各种构象中,势能最低、最稳定的构象称 优势构象。 立体结构的表示主要有:伞形透视式、锯架透视式、纽曼投影式、费歇尔投影式、哈沃 斯透视式。例如: H H H H H H H H H H H H H H H H 伞形式 锯架式 纽曼投影式 H O OH H OH H H OH OH CH2OH H OH CHO H CH2OH 费歇尔投影式 哈沃斯透视式 5. 杂化轨道理论 碳原子经激发,其最外层不同的原子轨道间发生线性组合,形成能量等同的新轨道, 这个过程称为杂化,形成的新轨道称杂化轨道。 碳原子有三种杂化类型:sp3、sp2和 sp: 6. 共价键属性 共价键属性指共价键的重要参数,主要有键长、键角、键能、键的极性和极化。 键长:形成共价键的两个原子核间的平均距离。键角:同一原子上两个共价键之间的夹 角。键能:双原子气态分子分解为气态原子所需要的能量,即离解能。对于双原子分子,键 的离解能就是键能。 7. 键的极性和极化 共价键分为非极性共价键和极性共价键。成键的两个原子电负性无差异、成键原子间 电子云均匀分布在两核之间的,称为非极性共价键;反之,成键原子间的电子云不是平均分 布,而是偏向电负性大的原子一边,使一个原子带有部分负电荷而另一个原子带有部分正电 荷,这样的共价键称为极性共价键。 键的极性取决于两个成键原子的电负性差异,差异越大,极性越大。例如,C-X 键的极 性大小顺序为:C-F > C-Cl > C-Br > C-I。 在外界电场作用下使共价键极性发生改变称为极化。共价键极化的难易程度称为极化 度。键的极化的难易与原子核对最外层电子云的吸引能力有关,吸引力越大,键的极化越难, 反之则越易。例如,C-X 键的极化度大小顺序为:C-I > C-Br > C-Cl > C-F。 键的极性是永久现象,键的极化是暂时现象,外界电场消失,键的极化也消失。 8. 共价键的断裂方式 共价键断裂方式分为均裂和异裂。 均裂:共价键断裂时,成键原子之间的一对共用电子对均匀分裂,两原子各获一个电子, 生成两个带单电子的自由基。 异裂:共价键断裂时,成键原子之间的一对共用电子对由一个原子或基团独得形成负离 子,另一个原子失去一个电子形成正离子。 9. 有机反应类型和有机反应中间体 有机反应类型按共价键断裂方式的不同分为自由基反应、离子型反应和周环反应。 自由基反应:发生共价键均裂的反应称自由基反应。 离子型反应:由共价键异裂而进行的反应称离子型反应。碳自由基和碳正离子都是 sp2 杂化的平面构型;简单的碳负离子为 sp3杂化的三角锥形,但也有以 sp2杂化出现而成平面 型几何结构(如环戊二烯碳负离子等)。 10. 有机化学中的酸碱理论

布朗斯特酸碱质子理论:凡能给出质子的分子或离子是酸,凡能接受质子的分子或离子 是碱。酸失去质子,剩余的基团就是这个酸的共轭碱:碱得到质子,生成的物质就是这个碱 的共轭酸。 路易斯酸碱理论:酸是能接受外来电子对的电子接受体,碱是能给出电子对的电子给予 体。酸碱反应是酸从碱中接受一对电子。 路易斯酸一般至少有一个原子具有空轨道,具有接受电子对的能力。例如,AICl3、ZnC、 L、Ag、H等都是路易斯酸。路易斯碱至少含有一对未共用电子对(孤对电子),具有给 出电子对的能力。例如,HO、NH、ROH、X、OH、RO等都是路易斯碱。 四、课程思政案例 案例1:引入和讲述屠呦呦的事迹,使学生了解有机化学,同时引导学生树立远大的理 想信念以及对职业方向做合理规划,克服学习上的畏难情绪,树立学习自信心。在讲述有机 化学发展史,培养学生爱国主义精神与民族自信心。 案例2:介绍我国古代有机化学工艺的发展,无论是稀罕的造纸术、唐代的火药,还是 是由、天然气的开采,以及酿酒、发酵和染色等工艺技术,都说明中华民族对人类文明和发 展作出的辉煌贡献
布朗斯特酸碱质子理论:凡能给出质子的分子或离子是酸,凡能接受质子的分子或离子 是碱。酸失去质子,剩余的基团就是这个酸的共轭碱;碱得到质子,生成的物质就是这个碱 的共轭酸。 路易斯酸碱理论:酸是能接受外来电子对的电子接受体,碱是能给出电子对的电子给予 体。酸碱反应是酸从碱中接受一对电子。 路易斯酸一般至少有一个原子具有空轨道,具有接受电子对的能力。例如,AlCl3、ZnCl2、 Li+、Ag+、H+等都是路易斯酸。路易斯碱至少含有一对未共用电子对(孤对电子),具有给 出电子对的能力。例如,H2O、NH3、ROH、X-、OH-、RO-等都是路易斯碱。 四、课程思政案例 案例 1:引入和讲述屠呦呦的事迹,使学生了解有机化学,同时引导学生树立远大的理 想信念以及对职业方向做合理规划,克服学习上的畏难情绪,树立学习自信心。在讲述有机 化学发展史,培养学生爱国主义精神与民族自信心。 案例 2:介绍我国古代有机化学工艺的发展,无论是稀罕的造纸术、唐代的火药,还是 是由、天然气的开采,以及酿酒、发酵和染色等工艺技术,都说明中华民族对人类文明和发 展作出的辉煌贡献

第二章立体化学 一、教学目标 1.了解立体化学概念及其研究对象。 2.掌握立体异构的概念及其分类。 3.掌握手性碳原子、分子的手性和对映异构体概念。 4.掌握化合物的光学活性与结构的关系以及对称面和对称中心的判断。 5.掌握费歇尔投影式的意义和书写。 6.掌握旋光异构体的DL和R/S构型标记。 7.了解平面偏振光、比旋光度、旋光性等概念。 8.掌握内、外消旋体和非对映体的概念以及了解外消旋体的拆分。 9.了解化学反应中的立体化学。 10.了解手性分子的生物学意义。 二、教学重点 1.手性碳原子、分子的手性和对映异构体概念。 2.化合物的光学活性与结构的关系以及对称面和对称中心的判断。 3.费歇尔投影式的意义和书写。 4.旋光异构体的R/S构型标记。 三、教学过程 1.立体化学及其研究对象 立体化学是研究有机分子的立体结构、反应的立体选择性及其相关规律和应用的科学, 是现代有机化学的一个重要分支。有机分子具有三维立体结构,它们的许多性质都与其三维 立体结构息息相关,因此立体化学的观点和方法在研究有机化合物的结构与反应性能、研究 天然产物化学、生物化学、药物化学、高分子化学等方面发挥着重要作用。立体化学根据其 研究对象可分为静态立体化学和动态立体化学。 本章讨论静态立体异构之一的旋光异构现象。 2.立体异构 立体异构指构造相同的分子中,原子或基团的空间排布不同而使分子具有不同的结构, 分为构型异构和构象异构。 构型异构:成键两端碳原子所连原子或基团的不同的空间排布,不能通过键的旋转而相 互转换的立体异构现象,又可分为顺反异构和旋光异构。 顺反异构:因共价键旋转受阻而产生的立体异构。例如下面两对化合物中,由于双键或 环系的影响,共价键旋转受阻,使端基碳上连接的取代基被固定于不同的空间伸展方向上, 其中相同的原子或基团分列在双键或环的同侧时称为顺式,异侧时称为反式,谓之顺反异构。 顺式 反式 顺式 反式 旋光异构:因分子中手性因素而产生的立体异构,对平面偏振光的作用不同而得名。旋 光异构是本章的重点。 构象异构:成键两端碳原子所连原子或基团的不同的空间排布,可以通过单键“自由
第二章 立体化学 一、教学目标 1. 了解立体化学概念及其研究对象。 2. 掌握立体异构的概念及其分类。 3. 掌握手性碳原子、分子的手性和对映异构体概念。 4. 掌握化合物的光学活性与结构的关系以及对称面和对称中心的判断。 5. 掌握费歇尔投影式的意义和书写。 6. 掌握旋光异构体的 D/L 和 R/S 构型标记。 7. 了解平面偏振光、比旋光度、旋光性等概念。 8. 掌握内、外消旋体和非对映体的概念以及了解外消旋体的拆分。 9. 了解化学反应中的立体化学。 10. 了解手性分子的生物学意义。 二、教学重点 1. 手性碳原子、分子的手性和对映异构体概念。 2. 化合物的光学活性与结构的关系以及对称面和对称中心的判断。 3. 费歇尔投影式的意义和书写。 4. 旋光异构体的 R/S 构型标记。 三、教学过程 1. 立体化学及其研究对象 立体化学是研究有机分子的立体结构、反应的立体选择性及其相关规律和应用的科学, 是现代有机化学的一个重要分支。有机分子具有三维立体结构,它们的许多性质都与其三维 立体结构息息相关,因此立体化学的观点和方法在研究有机化合物的结构与反应性能、研究 天然产物化学、生物化学、药物化学、高分子化学等方面发挥着重要作用。立体化学根据其 研究对象可分为静态立体化学和动态立体化学。 本章讨论静态立体异构之一的旋光异构现象。 2. 立体异构 立体异构指构造相同的分子中,原子或基团的空间排布不同而使分子具有不同的结构, 分为构型异构和构象异构。 构型异构:成键两端碳原子所连原子或基团的不同的空间排布,不能通过键的旋转而相 互转换的立体异构现象,又可分为顺反异构和旋光异构。 顺反异构:因共价键旋转受阻而产生的立体异构。例如下面两对化合物中,由于双键或 环系的影响,共价键旋转受阻,使端基碳上连接的取代基被固定于不同的空间伸展方向上, 其中相同的原子或基团分列在双键或环的同侧时称为顺式,异侧时称为反式,谓之顺反异构。 顺式 反式 顺式 反式 旋光异构:因分子中手性因素而产生的立体异构,对平面偏振光的作用不同而得名。旋 光异构是本章的重点。 构象异构:成键两端碳原子所连原子或基团的不同的空间排布,可以通过单键“自由
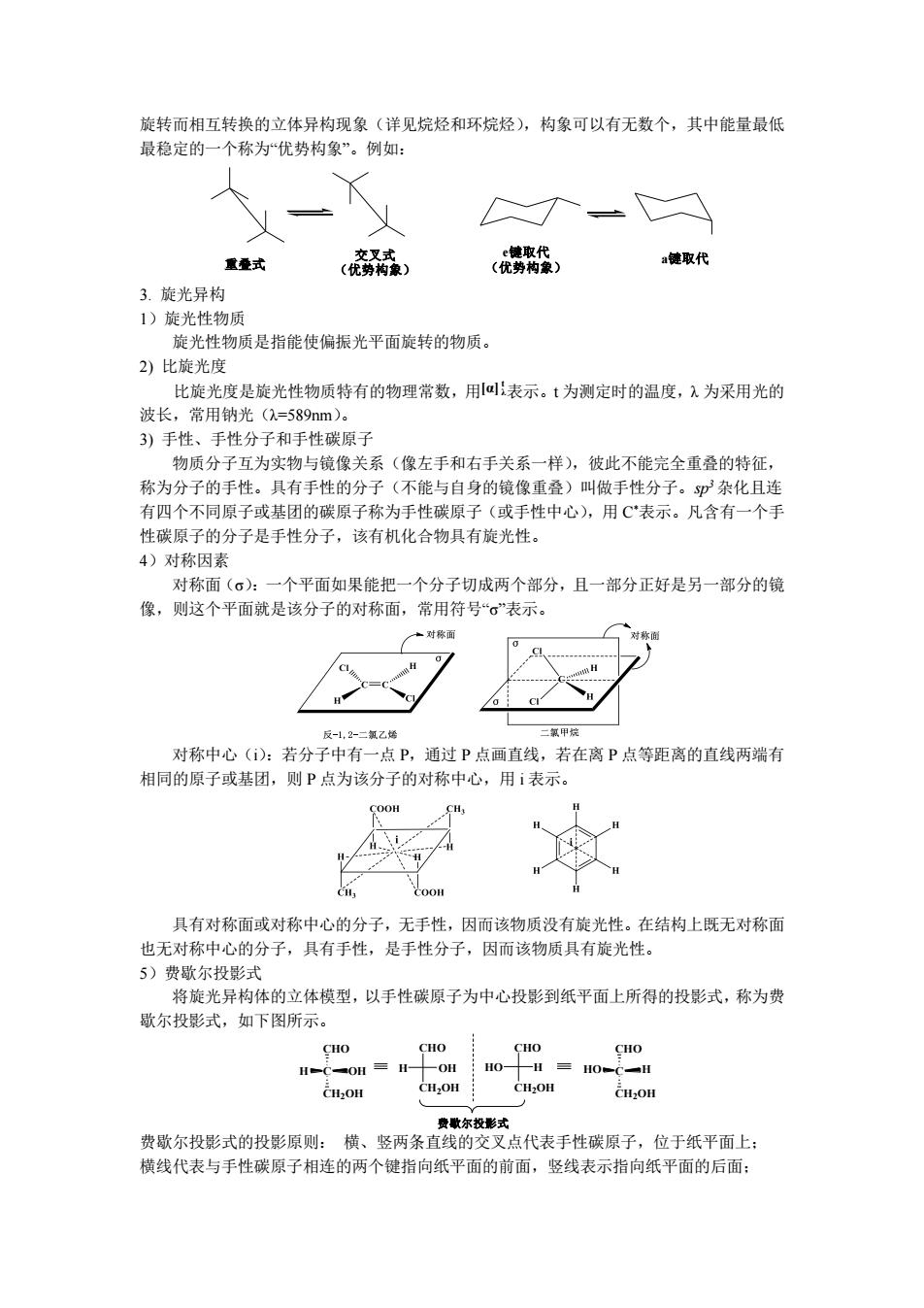
旋转而相互转换的立体异构现象(详见烷烃和环烷烃),构象可以有无数个,其中能量最低 最稳定的一个称为优势构象”。例如: 交叉式 e键取代 重叠式 a键取代 (优势构象) (优势构象) 3.旋光异构 1)旋光性物质 旋光性物质是指能使偏振光平面旋转的物质。 2)比旋光度 比旋光度是旋光性物质特有的物理常数,用@表示。t为测定时的温度,入为采用光的 波长,常用钠光(=589nm)。 3)手性、手性分子和手性碳原子 物质分子互为实物与镜像关系(像左手和右手关系一样),彼此不能完全重叠的特征, 称为分子的手性。具有手性的分子(不能与自身的镜像重叠)叫做手性分子。p杂化且连 有四个不同原子或基团的碳原子称为手性碳原子(或手性中心),用C表示。凡含有一个手 性碳原子的分子是手性分子,该有机化合物具有旋光性。 4)对称因素 对称面(σ):一个平面如果能把一个分子切成两个部分,且一部分正好是另一部分的镜 像,则这个平面就是该分子的对称面,常用符号“σ”表示。 一对称面 反-1,2-二氯乙烯 二氯甲烧 对称中心():若分子中有一点P,通过P点画直线,若在离P点等距离的直线两端有 相同的原子或基团,则P点为该分子的对称中心,用i表示。 COOH 具有对称面或对称中心的分子,无手性,因而该物质没有旋光性。在结构上既无对称面 也无对称中心的分子,具有手性,是手性分子,因而该物质具有旋光性。 5)费歇尔投影式 将旋光异构体的立体模型,以手性碳原子为中心投影到纸平面上所得的投影式,称为费 歇尔投影式,如下图所示。 CHO CHO CHO HC=OH三H 一OH HO- 三HOCH CH2OH CH,OH CH2OH CH2OH 费歌尔投形式 费歇尔投影式的投影原则:横、竖两条直线的交叉点代表手性碳原子,位于纸平面上: 横线代表与手性碳原子相连的两个键指向纸平面的前面,竖线表示指向纸平面的后面:
旋转而相互转换的立体异构现象(详见烷烃和环烷烃),构象可以有无数个,其中能量最低 最稳定的一个称为“优势构象”。例如: 重叠式 交叉式 (优势构象) e键取代 (优势构象) a键取代 3. 旋光异构 1)旋光性物质 旋光性物质是指能使偏振光平面旋转的物质。 2) 比旋光度 比旋光度是旋光性物质特有的物理常数,用 [α] λ t 表示。t 为测定时的温度,λ 为采用光的 波长,常用钠光(λ=589nm)。 3) 手性、手性分子和手性碳原子 物质分子互为实物与镜像关系(像左手和右手关系一样),彼此不能完全重叠的特征, 称为分子的手性。具有手性的分子(不能与自身的镜像重叠)叫做手性分子。sp3 杂化且连 有四个不同原子或基团的碳原子称为手性碳原子(或手性中心),用 C*表示。凡含有一个手 性碳原子的分子是手性分子,该有机化合物具有旋光性。 4)对称因素 对称面(σ):一个平面如果能把一个分子切成两个部分,且一部分正好是另一部分的镜 像,则这个平面就是该分子的对称面,常用符号“σ”表示。 对称中心(i):若分子中有一点 P,通过 P 点画直线,若在离 P 点等距离的直线两端有 相同的原子或基团,则 P 点为该分子的对称中心,用 i 表示。 具有对称面或对称中心的分子,无手性,因而该物质没有旋光性。在结构上既无对称面 也无对称中心的分子,具有手性,是手性分子,因而该物质具有旋光性。 5)费歇尔投影式 将旋光异构体的立体模型,以手性碳原子为中心投影到纸平面上所得的投影式,称为费 歇尔投影式,如下图所示。 H C OH CHO CH2OH H OH CHO CH2OH HO C H CHO CH2OH HO H CHO CH2OH 费歇尔投影式 费歇尔投影式的投影原则: 横、竖两条直线的交叉点代表手性碳原子,位于纸平面上; 横线代表与手性碳原子相连的两个键指向纸平面的前面,竖线表示指向纸平面的后面;

一般将主链竖起来放,编号最小的碳原子放在竖线最上端。 6)旋光异构体的构型标记 R/S标记法,又称绝对构型标记法,方法如下: ①把分子写成透视式或费歇尔投影式,按次序规则将C*上的四个原子或基团进行排序。 ②若是透视式,则把排序最小的放在离观察者最远的位置,将其余三个按大→中→小顺序 连接,顺时针方向的是R构型,逆时针方向的是S构型。 ③若是费歇尔投影式,当次序最小的位于竖线(无论上或下),其余三个按大→中→小顺序 连接成顺时针方向的是R构型,逆时针的是S构型:当次序最小的位于横线(无论左或右), 其余三个按大→中→小顺序连接成顺时针方向的是S构型,逆时针的是R构型。 7)含手性碳原子化合物的对映异构 含有一个手性碳原子化合物的对映异构:这类化合物的分子中因为没有对称面和对称中 心,所以一定是手性分子,有两种不同的构型,互为实物与镜像关系,称为对映异构体,简 称对映体。对映体旋光能力相同,旋光方向相反,其中一个左旋,另一个右旋。等量的左旋 体和右旋体混合,对外将不显旋光性,称为外消旋体。 对映体之间的异同点: 物理化学性质一般都相同,比旋光度数值相等,仅旋光方向相反。 在手性环境条件下,对映体表现出某些不同性质,如反应速度有差异,生理作用不同等。 含有两个不同手性碳原子化合物的对映异构:当两个手性碳原子各自连接的四个不同的 原子或基团之间不完全对应,它们称为不同的手性碳原子。以2-羟基-3氯丁二酸为例进行 讨论。 该化合物具有两个不相同的手性碳原子,存在四个旋光异构体,其费歇尔投影式如下: COOH COOH COOH COOH H--OH HO十H H--OH HO-H H十CI CIH CI十H H十CI COOH COOH COOH COOH 00 y 对映体 对映体 8..1o +7.1° 1回0.9.3° +9.3° m.p.173℃ 173℃ mp.167℃167C (仕)外消旋体m.p.145C (生)外消旋体mp.157℃ 非对映异构体的特征:物理性质(熔点、沸点、溶解度等)不同。比旋光度不同。旋光 方向可能相同,也可能不同。化学性质相似,但反应速度有差异。 含有两个相同手性碳原子化合物的对映异构:当两个手性碳原子各自连接的四个不同的 原子或基团之间可以完全对应,它们称为相同的手性碳原子。以2,3-二羟基丁二酸(酒石酸) 为例进行讨论。 该化合物具有两个相同手性碳原子,也可写出四个旋光异构体,其费歇尔投影式如下: COOH COOH COOH COOH H--OH HO--H H--OH HO--H HO-H H--OH 。-i中0州 H0平# COOH COOH COOH COOH 1 I IV 对映体 同一物质 I@0+120 -12 Ia290 0 (仕)酒石酸 (m)酒石酸 外消旋体 内消旋体 酒石酸只有三个旋光异构体:一对对映体和一个内消旋体
一般将主链竖起来放,编号最小的碳原子放在竖线最上端。 6) 旋光异构体的构型标记 R/S 标记法,又称绝对构型标记法,方法如下: ① 把分子写成透视式或费歇尔投影式,按次序规则将 C*上的四个原子或基团进行排序。 ② 若是透视式,则把排序最小的放在离观察者最远的位置,将其余三个按大→中→小顺序 连接,顺时针方向的是 R 构型,逆时针方向的是 S 构型。 ③ 若是费歇尔投影式,当次序最小的位于竖线(无论上或下),其余三个按大→中→小顺序 连接成顺时针方向的是 R 构型,逆时针的是 S 构型;当次序最小的位于横线(无论左或右), 其余三个按大→中→小顺序连接成顺时针方向的是 S 构型,逆时针的是 R 构型。 7)含手性碳原子化合物的对映异构 含有一个手性碳原子化合物的对映异构:这类化合物的分子中因为没有对称面和对称中 心,所以一定是手性分子,有两种不同的构型,互为实物与镜像关系,称为对映异构体,简 称对映体。对映体旋光能力相同,旋光方向相反,其中一个左旋,另一个右旋。等量的左旋 体和右旋体混合,对外将不显旋光性,称为外消旋体。 对映体之间的异同点: 物理化学性质一般都相同,比旋光度数值相等,仅旋光方向相反。 在手性环境条件下,对映体表现出某些不同性质,如反应速度有差异,生理作用不同等。 含有两个不同手性碳原子化合物的对映异构:当两个手性碳原子各自连接的四个不同的 原子或基团之间不完全对应,它们称为不同的手性碳原子。以 2-羟基-3-氯丁二酸为例进行 讨论。 该化合物具有两个不相同的手性碳原子,存在四个旋光异构体,其费歇尔投影式如下: COOH H OH COOH H Cl COOH HO H COOH Cl H COOH H OH COOH Cl H COOH HO H COOH H Cl Ⅰ Ⅱ Ⅲ Ⅳ 对映体 对映体 m.p. 173℃ 173℃ [α] 20D - 7.1° + 7.1° (±)外消旋体 m.p. 145℃ m.p. 167℃ 167℃ [α] 20D - 9.3° + 9.3° (±)外消旋体 m.p. 157℃ 非对映异构体的特征:物理性质(熔点、沸点、溶解度等)不同。比旋光度不同。旋光 方向可能相同,也可能不同。化学性质相似,但反应速度有差异。 含有两个相同手性碳原子化合物的对映异构:当两个手性碳原子各自连接的四个不同的 原子或基团之间可以完全对应,它们称为相同的手性碳原子。以 2,3-二羟基丁二酸(酒石酸) 为例进行讨论。 该化合物具有两个相同手性碳原子,也可写出四个旋光异构体,其费歇尔投影式如下: COOH H OH COOH HO H COOH HO H COOH H OH COOH H OH COOH H OH COOH HO H COOH HO H Ⅰ Ⅱ Ⅲ Ⅳ 对映体 同一物质 [α] 20 D + 12° - 12° (±)酒石酸 [α] 20 D 0° 0° 内消旋体 σ 外消旋体 (m)酒石酸 σ 酒石酸只有三个旋光异构体:一对对映体和一个内消旋体

由内消旋酒石酸可看出,具有两个手性碳原子的分子不一定是手性分子,故不能说含有 手性碳原子的分子一定具有手性。 内消旋体与外消旋体的异同: 相同点:都没有旋光性。不同点:内消旋体是纯物质,外消旋体是两个对映体的等量混 合物,可用适当方法进行拆分。 8)不含手性碳原子化合物的对映异构 2,3-戊二烯的分子中没有手性碳原子,但由于双键两端碳原子上所连四个基团两两各在 相互垂直的平面上,整个分子没有对称面和对称中心,因此具有手性。 "3"S CH H 2,3-戊二烯的对映异构体 但如果丙二烯型化合物的分子中,任何一端的双键碳原子上连有两个相同的原子或基团, 则分子内就存在对称面,从而不具有手性。 四、课程思政案例 引入“反应停”事件。不仅能够加深学生对手性、对映异构等概念的理解、提高学习兴 趣:同时,通过真实的案例,引发学生自发思考讨论一一药品的本质是为人服务的商品,而 不是单纯为了谋利的产品。以此,将社会责任感与职业道德根植于学生内心深处,引导其形 成正确、积极的价值观念
由内消旋酒石酸可看出,具有两个手性碳原子的分子不一定是手性分子,故不能说含有 手性碳原子的分子一定具有手性。 内消旋体与外消旋体的异同: 相同点:都没有旋光性。不同点:内消旋体是纯物质,外消旋体是两个对映体的等量混 合物,可用适当方法进行拆分。 8)不含手性碳原子化合物的对映异构 2,3-戊二烯的分子中没有手性碳原子,但由于双键两端碳原子上所连四个基团两两各在 相互垂直的平面上,整个分子没有对称面和对称中心,因此具有手性。 2,3-戊二烯的对映异构体 C C H3C H C CH3 H C C H3C H C CH3 H 但如果丙二烯型化合物的分子中,任何一端的双键碳原子上连有两个相同的原子或基团, 则分子内就存在对称面,从而不具有手性。 四、课程思政案例 引入“反应停”事件。不仅能够加深学生对手性、对映异构等概念的理解、提高学习兴 趣;同时,通过真实的案例,引发学生自发思考讨论——药品的本质是为人服务的商品,而 不是单纯为了谋利的产品。以此,将社会责任感与职业道德根植于学生内心深处,引导其形 成正确、积极的价值观念

第五章饱和脂肪烃 一、教学目标 1.熟悉同系列、同系物的概念和同分异构现象。 2.掌握烷烃和环烷烃的分子结构、分类和命名方法以及环烷烃的稳定性。 3.熟悉烷烃和环烷烃的构象特点,掌握环已烷及其衍生物的构象,学会判断稳定构象。 4.掌握烷烃和环烷烃的化学性质,了解其物理性质。 5.了解自由基取代反应的历程。 二、教学重点 1.烷烃和环烷烃的分子结构、分类和命名方法以及环烷烃的稳定性。 2.烷烃和环烷烃的构象特点,环已烷及其衍生物的构象及稳定构象。 3.烷烃和环烷烃的化学性质 三、教学过程 1.同系列和同分异构 结构相似,性质也很相似,而在组成上相差CH2或它的倍数的许多化合物,组成一个 系列,叫做同系列。同系列中的各化合物称为同系物。CH2则叫做同系列的系差。 分子式相同而结构不同的化合物称为同分异构体,简称为异构体。烷烃的同分异构现象 主要是碳架异构,即由于分子中碳原子的连接顺序和排列方式不同而引起的异构现象。 碳原子和氢原子的分类:碳原子可以分为伯、仲、叔和季碳原子而与伯、仲、叔碳原子 相连的氢原子分别称为伯、仲、叔氢原子。 2.烷烃和环烷烃的结构和命名 形成烷烃的碳原子都是sp杂化的碳原子,碳原子在以四个单键与其它四个原子结合时, 四个Sp杂化轨道的对称轴在空间的取向相当于从正四面体的中心伸向四个顶点的方向,键 角均为109.5°。 三个碳以上直链烷烃的碳链主要是以锯齿型存在。所谓“直链”烷烃,其“直链”二字的含 意仅指不带有支链。 环烷烃的环的稳定性与环的大小有关,三元环最不稳定,四元环比三元环稍稳定一点, 五元环较稳定,六元环最稳定。大环烷烃,趋近环己烷的稳定性。 烷烃的命名主要有普通命名法和系统命名法。 烷烃系统命名法的原则如下: (1)选取主链(母体),最长原则。 (2)将主链以外的其它烷基看作是主链上的取代基(或叫支链)。 (3)主链碳原子编号,从靠近支链的一端编号。若有几种编号的可能时,应当选定使取代 基的位次最小,即“最低系列”的编号方法。 (4)相同取代基合并:不同取代基按“次序规则”,较优基团写在后面。 (5)当有两条或两条以上相同长度的碳链作为主链时,则应选定具有支链数目最多的碳链 为主链。 单环烷烃的系统命名与相应的烷烃基本相同,只是在相应烷烃的名称前冠以“环”字。环 上只有一个取代基时,不必编号:有两个或两个以上取代基时,连接最小的取代基的碳原子 编为1,其它取代基的位置的编号尽可能小。取代基不同时,则根据“次序规则”,较优基团 给以较大的编号。 螺环烃和桥环烃:两个环共用一个碳原子的环烷烃称为螺环烃:两个环共用两个或两个
第五章 饱和脂肪烃 一、教学目标 1. 熟悉同系列、同系物的概念和同分异构现象。 2. 掌握烷烃和环烷烃的分子结构、分类和命名方法以及环烷烃的稳定性。 3. 熟悉烷烃和环烷烃的构象特点,掌握环已烷及其衍生物的构象,学会判断稳定构象。 4. 掌握烷烃和环烷烃的化学性质,了解其物理性质。 5. 了解自由基取代反应的历程。 二、教学重点 1. 烷烃和环烷烃的分子结构、分类和命名方法以及环烷烃的稳定性。 2. 烷烃和环烷烃的构象特点,环已烷及其衍生物的构象及稳定构象。 3. 烷烃和环烷烃的化学性质 三、教学过程 1. 同系列和同分异构 结构相似,性质也很相似,而在组成上相差 CH2 或它的倍数的许多化合物,组成一个 系列,叫做同系列。同系列中的各化合物称为同系物。CH2 则叫做同系列的系差。 分子式相同而结构不同的化合物称为同分异构体,简称为异构体。烷烃的同分异构现象 主要是碳架异构,即由于分子中碳原子的连接顺序和排列方式不同而引起的异构现象。 碳原子和氢原子的分类:碳原子可以分为伯、仲、叔和季碳原子而与伯、仲、叔碳原子 相连的氢原子分别称为伯、仲、叔氢原子。 2. 烷烃和环烷烃的结构和命名 形成烷烃的碳原子都是 sp3杂化的碳原子,碳原子在以四个单键与其它四个原子结合时, 四个 sp3 杂化轨道的对称轴在空间的取向相当于从正四面体的中心伸向四个顶点的方向,键 角均为 109.5°。 三个碳以上直链烷烃的碳链主要是以锯齿型存在。所谓“直链”烷烃,其“直链”二字的含 意仅指不带有支链。 环烷烃的环的稳定性与环的大小有关,三元环最不稳定,四元环比三元环稍稳定一点, 五元环较稳定,六元环最稳定。大环烷烃,趋近环己烷的稳定性。 烷烃的命名主要有普通命名法和系统命名法。 烷烃系统命名法的原则如下: (1)选取主链(母体),最长原则。 (2)将主链以外的其它烷基看作是主链上的取代基(或叫支链)。 (3)主链碳原子编号,从靠近支链的一端编号。若有几种编号的可能时,应当选定使取代 基的位次最小,即“最低系列”的编号方法。 (4)相同取代基合并;不同取代基按“次序规则”,较优基团写在后面。 (5)当有两条或两条以上相同长度的碳链作为主链时,则应选定具有支链数目最多的碳链 为主链。 单环烷烃的系统命名与相应的烷烃基本相同,只是在相应烷烃的名称前冠以“环”字。环 上只有一个取代基时,不必编号;有两个或两个以上取代基时,连接最小的取代基的碳原子 编为 1,其它取代基的位置的编号尽可能小。取代基不同时,则根据“次序规则”,较优基团 给以较大的编号。 螺环烃和桥环烃:两个环共用一个碳原子的环烷烃称为螺环烃;两个环共用两个或两个
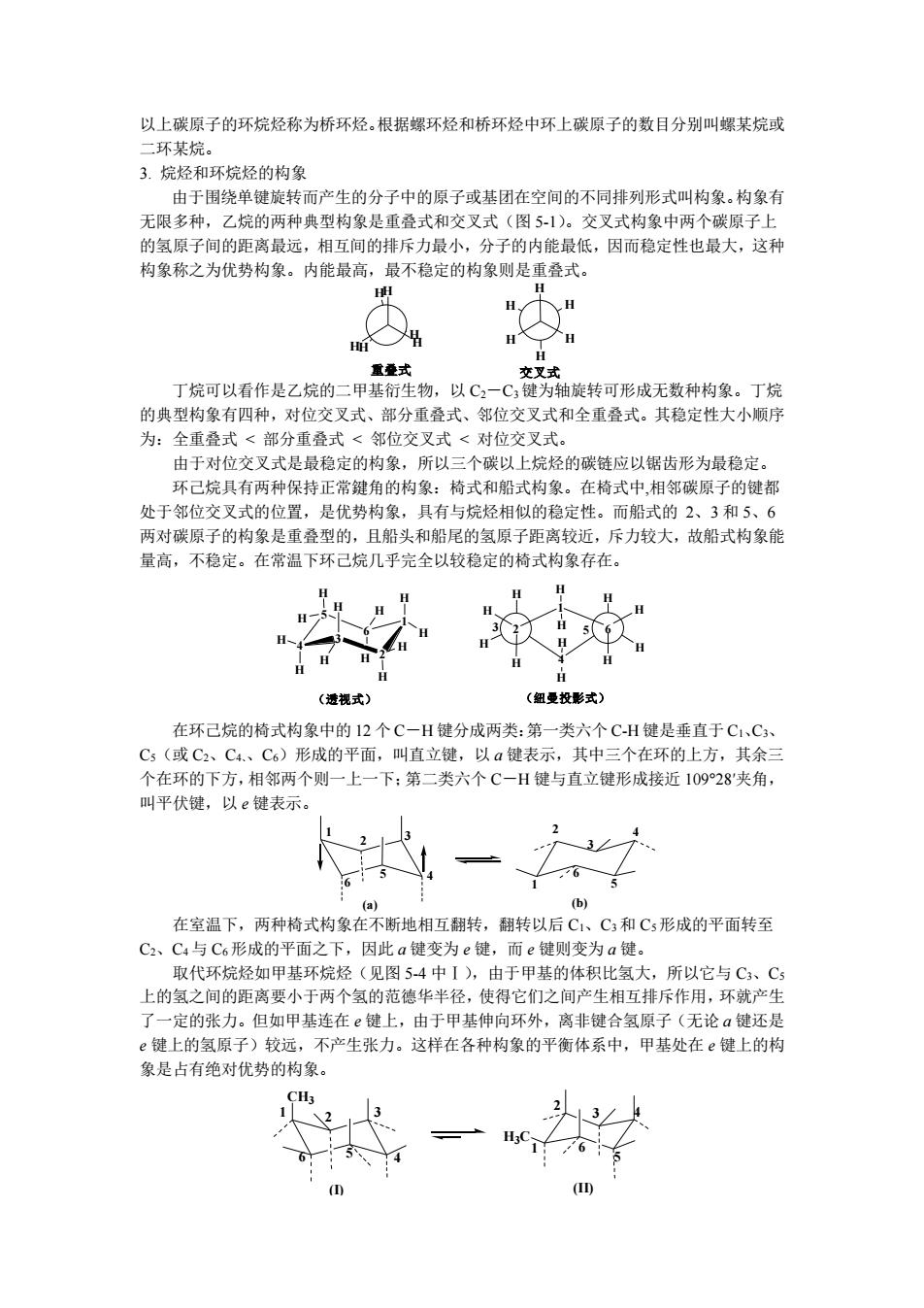
以上碳原子的环烷烃称为桥环烃。根据螺环烃和桥环烃中环上碳原子的数目分别叫螺某烷或 二环某烷。 3.烷烃和环烷烃的构象 由于围绕单键旋转而产生的分子中的原子或基团在空间的不同排列形式叫构象。构象有 无限多种,乙烷的两种典型构象是重叠式和交叉式(图5-1)。交叉式构象中两个碳原子上 的氢原子间的距离最远,相互间的排斥力最小,分子的内能最低,因而稳定性也最大,这种 构象称之为优势构象。内能最高,最不稳定的构象则是重叠式。 H H H的 重叠式 交叉式 丁烷可以看作是乙烷的二甲基衍生物,以C2一C3键为轴旋转可形成无数种构象。丁烷 的典型构象有四种,对位交叉式、部分重叠式、邻位交叉式和全重叠式。其稳定性大小顺序 为:全重叠式<部分重叠式<邻位交叉式<对位交叉式。 由于对位交叉式是最稳定的构象,所以三个碳以上烷烃的碳链应以锯齿形为最稳定。 环己烷具有两种保持正常鍵角的构象:椅式和船式构象。在椅式中,相邻碳原子的键都 处于邻位交叉式的位置,是优势构象,具有与烷烃相似的稳定性。而船式的2、3和5、6 两对碳原子的构象是重叠型的,且船头和船尾的氢原子距离较近,斥力较大,故船式构象能 量高,不稳定。在常温下环己烷几乎完全以较稳定的椅式构象存在。 H (透视式) (纽曼投影式) 在环己烷的椅式构象中的12个C一H键分成两类:第一类六个C-H键是垂直于C1、C3、 C5(或C2、C4、C6)形成的平面,叫直立键,以a键表示,其中三个在环的上方,其余三 个在环的下方,相邻两个则一上一下:第二类六个C一H键与直立键形成接近10928夹角, 叫平伏键,以e键表示。 4 (b) 在室温下,两种椅式构象在不断地相互翻转,翻转以后C1、C3和C5形成的平面转至 C2、C4与C6形成的平面之下,因此a键变为e键,而e键则变为a键。 取代环烷烃如甲基环烷烃(见图5-4中I),由于甲基的体积比氢大,所以它与C3、C5 上的氢之间的距离要小于两个氢的范德华半径,使得它们之间产生相互排斥作用,环就产生 了一定的张力。但如甲基连在键上,由于甲基伸向环外,离非键合氢原子(无论a键还是 e键上的氢原子)较远,不产生张力。这样在各种构象的平衡体系中,甲基处在e键上的构 象是占有绝对优势的构象
以上碳原子的环烷烃称为桥环烃。根据螺环烃和桥环烃中环上碳原子的数目分别叫螺某烷或 二环某烷。 3. 烷烃和环烷烃的构象 由于围绕单键旋转而产生的分子中的原子或基团在空间的不同排列形式叫构象。构象有 无限多种,乙烷的两种典型构象是重叠式和交叉式(图 5-1)。交叉式构象中两个碳原子上 的氢原子间的距离最远,相互间的排斥力最小,分子的内能最低,因而稳定性也最大,这种 构象称之为优势构象。内能最高,最不稳定的构象则是重叠式。 重叠式 交叉式 H H H H H H HH H HH H 丁烷可以看作是乙烷的二甲基衍生物,以 C2-C3键为轴旋转可形成无数种构象。丁烷 的典型构象有四种,对位交叉式、部分重叠式、邻位交叉式和全重叠式。其稳定性大小顺序 为:全重叠式 < 部分重叠式 < 邻位交叉式 < 对位交叉式。 由于对位交叉式是最稳定的构象,所以三个碳以上烷烃的碳链应以锯齿形为最稳定。 环己烷具有两种保持正常鍵角的构象:椅式和船式构象。在椅式中,相邻碳原子的键都 处于邻位交叉式的位置,是优势构象,具有与烷烃相似的稳定性。而船式的 2、3 和 5、6 两对碳原子的构象是重叠型的,且船头和船尾的氢原子距离较近,斥力较大,故船式构象能 量高,不稳定。在常温下环己烷几乎完全以较稳定的椅式构象存在。 4 3 2 1 6 5 H H H H H H H H H H H H 2 H H H H 6 4 H H H H 1 3 5 H H H H (透视式) (纽曼投影式) 2 6 在环己烷的椅式构象中的 12 个 C-H 键分成两类:第一类六个 C-H 键是垂直于 C1、C3、 C5(或 C2、C4、、C6)形成的平面,叫直立键,以 a 键表示,其中三个在环的上方,其余三 个在环的下方,相邻两个则一上一下;第二类六个 C-H 键与直立键形成接近 109°28′夹角, 叫平伏键,以 e 键表示。 1 2 3 5 4 6 1 2 3 4 5 6 (a) (b) 在室温下,两种椅式构象在不断地相互翻转,翻转以后 C1、C3和 C5形成的平面转至 C2、C4 与 C6形成的平面之下,因此 a 键变为 e 键,而 e 键则变为 a 键。 取代环烷烃如甲基环烷烃(见图 5-4 中Ⅰ),由于甲基的体积比氢大,所以它与 C3、C5 上的氢之间的距离要小于两个氢的范德华半径,使得它们之间产生相互排斥作用,环就产生 了一定的张力。但如甲基连在 e 键上,由于甲基伸向环外,离非键合氢原子(无论 a 键还是 e 键上的氢原子)较远,不产生张力。这样在各种构象的平衡体系中,甲基处在 e 键上的构 象是占有绝对优势的构象。 CH3 1 2 3 4 5 6 H3C 1 2 3 4 5 6 (I) (II)