
实验十七、实时荧光PCR检测沙门氏菌(salmonella.spp) 一、实验目的: 学习采用实时荧光PCR仪检测食品、化妆品等中的沙门氏菌(salmonellaspp)的特异检 测。 二、实验原理: 试剂盒采用PC方法结合荧光探针的体外扩增和检测技术,适用于食品、卫生防疫、 化妆品等沙门氏菌((salmonella,spp)的特异检测。 三、仪器与试剂: 1、试剂盒组成 组成成份(48Tk) 规格 DNA提取液 3ml 1管 PCR反应液 1100ul1管 T0酶 25ul 1管 UNG酶 5ul 1管 阳性对照 1管 阴性对照 1管 2、仪器 Roche lightcycler,.ABI系列,M opticon2,Bio-Rad和博日Iine-gcne荧光PCR检测仪 四、实验步骤: 样品的收集及处理以及增菌培养 严格按照无菌操作规程称取25g样品按国标法进行增菌培养。增菌样品可暂存4℃冰箱, 24小时内检验。 使用方法(使用前请仔细阅读本操作流程) 1、增菌液处理(样本处理区) 增菌液的处理可以采取以下方法 取待测样本增菌液1ml加到1.5ml无菌离心管中,8,000rpm离心5min,尽量吸弃上清:加 入50 ul DNA提取液(使用前室温解冻并充分混匀,快速吸取),混匀后沸水浴5min,13,000rpm
实验十七、实时荧光PCR检测沙门氏菌(salmonella .spp) 一、实验目的: 学习采用实时荧光 PCR 仪检测食品、化妆品等中的沙门氏菌(salmonella .spp)的特异检 测。 二、实验原理: 试剂盒采用PCR 方法结合荧光探针的体外扩增和检测技术,适用于食品、卫生防疫、 化妆品等沙门氏菌(salmonella .spp)的特异检测。 三、仪器与试剂: 1、试剂盒组成 组成成份(48T/kit) 规格 DNA 提取液 3ml 1 管 PCR 反应液 1100ul 1 管 Taq 酶 25ul 1 管 UNG 酶 5ul 1 管 阳性对照 1ml 1 管 阴性对照 1ml 1 管 2、仪器 Roche lightcycler, ABI 系列,MJ opticon2,Bio-Rad 和博日 line-gene 荧光 PCR 检测仪 四、实验步骤: 样品的收集及处理以及增菌培养 严格按照无菌操作规程称取 25g 样品按国标法进行增菌培养。增菌样品可暂存 4℃冰箱, 24 小时内检验。 使用方法(使用前请仔细阅读本操作流程) 1、增菌液处理(样本处理区) 增菌液的处理可以采取以下方法: 取待测样本增菌液1ml加到1.5ml无菌离心管中,8,000rpm离心5min,尽量吸弃上清;加 入50ul DNA提取液(使用前室温解冻并充分混匀,快速吸取),混匀后沸水浴5min,13,000rpm
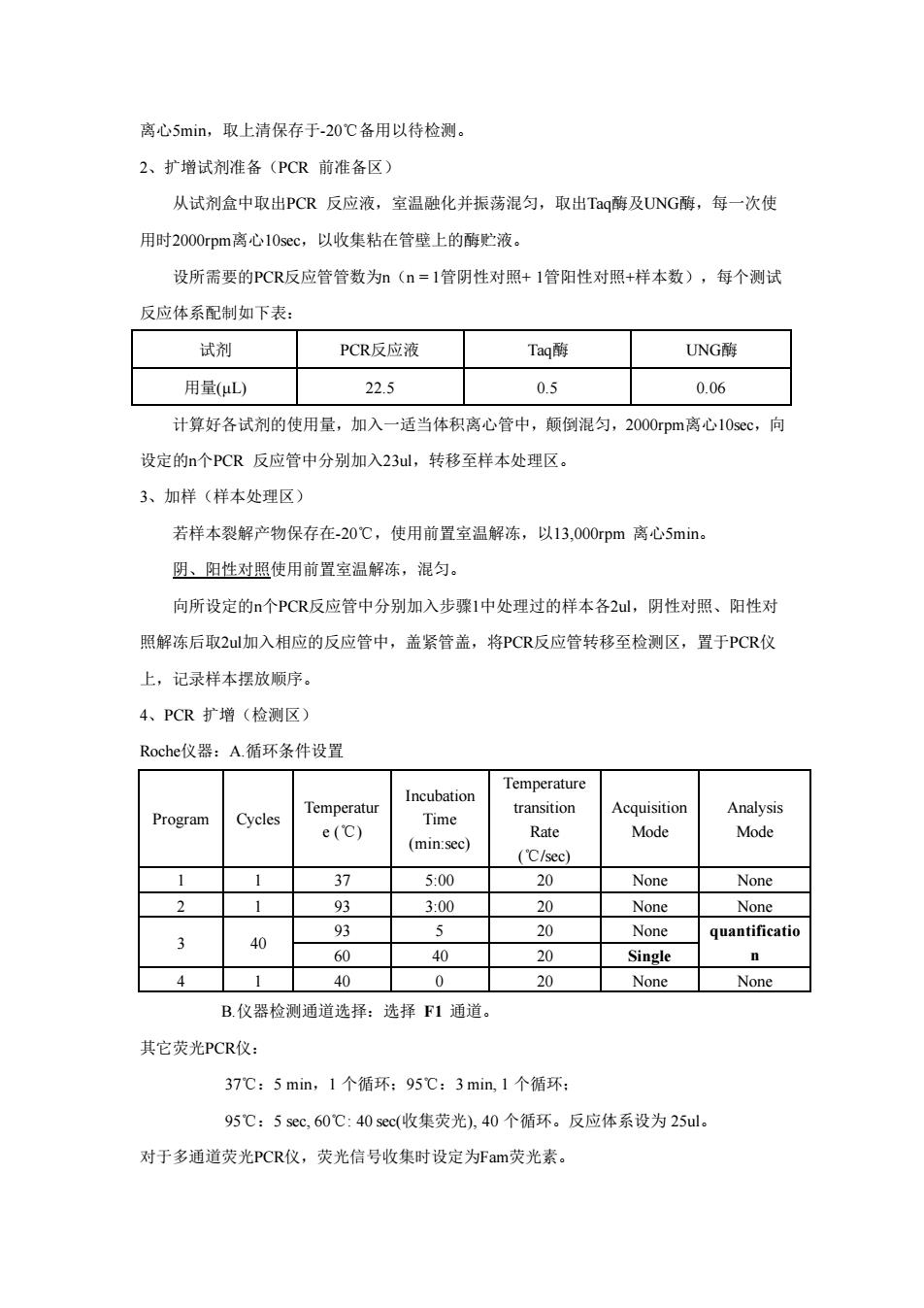
离心5min,取上清保存于-20℃备用以待检测。 2、扩增试剂准备(PCR前准备区) 从试剂盒中取出PCR反应液,室温融化并振荡混匀,取出Taq酶及UNG酶,每一次使 用时2000rpm离心10sec,以收集粘在管壁上的酶贮液。 设所需要的PCR反应管管数为n(n=1管阴性对照+1管阳性对照+样本数),每个测试 反应体系配制如下表: 试剂 PCR反应液 Taq酶 UNG酸 用量(uL) 22.5 0.5 0.06 计算好各试剂的使用量,加入一适当体积离心管中,颠倒混匀,2000pm离心10sec,向 设定的n个PCR反应管中分别加入23ul,转移至样本处理区 3、加样(样本处理区) 若样本裂解产物保存在-20℃,使用前置室温解冻,以13,000rpm离心5min 阴、阳性对照使用前置室温解冻,混匀。 向所设定的个PCR反应管中分别加入步骤1中处理过的样本各2u,阴性对照、阳性对 照解冻后取2加入相应的反应管中,盖紧管盖,将PCR反应管转移至检测区,置于PCR仪 上,记录样本摆放顺序。 4、PCR扩增(检测区) Roche仪器:A循环条件设置 Temperature Temperatur transition Acquisition Analysis Program Cycles Time e(C) Rate Mode Mode (min:sec) (C/sec) 37 5:00 20 None None 300 20 None None 93 5 20 None quantificatio 60 40 20 Single n 4 40 None B.仪器检测通道选择:选择F1通道。 其它荧光PCR仪: 37℃:5min,1个循环:95℃:3min,1个循环: 95℃:5sec,60℃:40sec(收集荧光),40个循环。反应体系设为25ul。 对于多通道荧光PCR仪,荧光信号收集时设定为Fam荧光素
离心5min,取上清保存于-20℃备用以待检测。 2、扩增试剂准备(PCR 前准备区) 从试剂盒中取出PCR 反应液,室温融化并振荡混匀,取出Taq酶及UNG酶,每一次使 用时2000rpm离心10sec,以收集粘在管壁上的酶贮液。 设所需要的PCR反应管管数为n(n = 1管阴性对照+ 1管阳性对照+样本数),每个测试 反应体系配制如下表: 试剂 PCR反应液 Taq酶 UNG酶 用量(μL) 22.5 0.5 0.06 计算好各试剂的使用量,加入一适当体积离心管中,颠倒混匀,2000rpm离心10sec,向 设定的n个PCR 反应管中分别加入23ul,转移至样本处理区。 3、加样(样本处理区) 若样本裂解产物保存在-20℃,使用前置室温解冻,以13,000rpm 离心5min。 阴、阳性对照使用前置室温解冻,混匀。 向所设定的n个PCR反应管中分别加入步骤1中处理过的样本各2ul,阴性对照、阳性对 照解冻后取2ul加入相应的反应管中,盖紧管盖,将PCR反应管转移至检测区,置于PCR仪 上,记录样本摆放顺序。 4、PCR 扩增(检测区) Roche仪器:A.循环条件设置 Program Cycles Temperatur e (℃) Incubation Time (min:sec) Temperature transition Rate (℃/sec) Acquisition Mode Analysis Mode 1 1 37 5:00 20 None None 2 1 93 3:00 20 None None 3 40 93 5 20 None quantificatio 60 40 20 Single n 4 1 40 0 20 None None B.仪器检测通道选择:选择 F1 通道。 其它荧光PCR仪: 37℃:5 min,1 个循环;95℃:3 min, 1 个循环; 95℃:5 sec, 60℃: 40 sec(收集荧光), 40 个循环。反应体系设为 25ul。 对于多通道荧光PCR仪,荧光信号收集时设定为Fam荧光素

荧光PCR仪的使用请参阅详细使用手册。 五、结果分析条件设定: 使用Roche荧光PCR检测仪 1、选择F1或F1/F2通道(建议选择F1/F2通道),点击Quantification进入定量分析窗口。 2、在Quantification窗口中,设定Analysis方式为Fitpoints,Adjustment方式为 proportional:选定Noise band项,闵值(Noise band cursor)设定以刚超过正常阴性对照品 扩增曲线(无规则的噪音线)的最高点,且C:值不出现任何数值为准,也可根据仪器的 实际情况进行调整 使用ABI系列荧光PCR检测仪进行结果分析时基线(baseline)的确定:取3一I0或3 一l5个循环的荧光信号。阔值(threshold)设定原则以阈值线刚好超过正常阴性对照品扩增曲 线(无规则的噪音线)的最高点,且不出现C值为准。 使用博日Line-Gcn荧光PCR检测仪时,在运行扩增程序前,先把增益值调至30左右。 运行结束后点击数据分析进入结果分析界面,选择样点拟合法进行结果分析:零点调整取1 一10或1一15个循环的荧光信号:在噪声容限界面下调整基线位置,其设定原则以闵值线 刚好超过正常阴性对照扩增曲线(无规则的噪音线)的最高点为准,选择定量分析,对样本 进行结果分析。 使用Opticon系列荧光PCR检测役进行结果分析时,先扣除本底信号后再输入I一 10或1-15之间的荧光密度值来手动设置ct值或拖动C线到合适的位置来确定ct值。 质控标准 本试剂盒的灵敏度为:500 copies/ml。定量检测线性范围为:10-100 copies/ml。 阴性对照应该没有C值显示或显示C值为40:阳性对照的C值应小于等于30.0,否则实 验视为无效。 大、结果判断: 1.检测样本C值小于等于35.0时,测定结果有效,可直接报告样本阳性: 2.检测样本Ct值大于35.0且小于40时,重复一次,如果Ct值仍小于40,且曲线有明显的对数 增长期,可报告样本阳性,否则报告样本阴性。 3.检测不到样本C值时,报告样本阴性
荧光PCR仪的使用请参阅详细使用手册。 五、结果分析条件设定: 使用Roche 荧光PCR检测仪 1、 选择F1或F1/F2通道(建议选择F1/F2通道),点击 Quantification 进入定量分析窗口。 2、在 Quantification 窗口中,设定 Analysis 方式为 Fit points , Adjustment 方式为 proportional;选定 Noise band 项,阈值(Noise band cursor)设定以刚超过正常阴性对照品 扩增曲线(无规则的噪音线)的最高点,且 Ct 值不出现任何数值为准,也可根据仪器的 实际情况进行调整。 使用ABI系列荧光PCR 检测仪进行结果分析时基线(baseline)的确定:取3—10 或3 —15 个循环的荧光信号。阈值(threshold)设定原则以阈值线刚好超过正常阴性对照品扩增曲 线(无规则的噪音线)的最高点,且不出现Ct值为准。 使用博日Line-Gene荧光PCR检测仪时,在运行扩增程序前,先把增益值调至30左右。 运行结束后点击数据分析进入结果分析界面,选择样点拟合法进行结果分析:零点调整取1 -10 或1-15 个循环的荧光信号;在噪声容限界面下调整基线位置,其设定原则以阈值线 刚好超过正常阴性对照扩增曲线(无规则的噪音线)的最高点为准,选择定量分析,对样本 进行结果分析。 使用MJ Opticon 系列荧光PCR检测仪进行结果分析时,先扣除本底信号后再输入1- 10或1-15之间的荧光密度值来手动设置ct值或拖动Ct线到合适的位置来确定ct值。 质控标准 本试剂盒的灵敏度为:500 copies /ml。定量检测线性范围为:10-1010 copies/ml。 阴性对照应该没有Ct值显示或显示Ct值为40;阳性对照的Ct值应小于等于30.0,否则实 验视为无效。 六、结果判断: 1. 检测样本Ct值小于等于35.0时,测定结果有效,可直接报告样本阳性; 2. 检测样本Ct值大于35.0且小于40时,重复一次,如果Ct值仍小于40,且曲线有明显的对数 增长期,可报告样本阳性,否则报告样本阴性。 3. 检测不到样本Ct值时,报告样本阴性

七、试剂盒使用注意事项: 1、有关实验室管理规范请严格按照行业行政主管部门颁布的有关基因扩增检验实验室的管 理规范执行。 2、本试剂盒仅用于体外检测,操作人员应经过专业培训并具有一定经验,开始检测前请行 细阅读本说明书全文。 3、实验请严格分区操作:第一区:PCR前准备区一准备扩增所需试剂:第二区:样本处 理区一待测样本和对照品处理:第三区:检测区一PCR扩增检测。 4、试剂盒内各试剂使用前,充分融化后请稍事离心。反应液分装时应尽量避免产生气泡, 上机前注意检查各反应管是否盖紧,以免荧光物质泄露污染仪器。 5、各区物品均为专用,不得交叉使用,避免污染,实验后即请清洁工作台。实验中用过的 吸头请直接打入盛有1%次氯酸钠的废物缸内,并与其他废弃物品一同灭菌后丢弃。扩增完 毕立即取出反应管,密封在专用塑料袋内,丢弃于指定地点。工作台及各物品定期用1%次 氯酸钠、75%酒精或紫外灯进行消毒。 6、储存条件及有效期:本试剂盒于-20℃保存,有效期为6个月(请于有效期内使用) 八、思考题: 1、实时荧光PCR检测沙门氏茵的原理? 2、影响检测准确性主要有哪些因素?
七、试剂盒使用注意事项: 1、有关实验室管理规范请严格按照行业行政主管部门颁布的有关基因扩增检验实验室的管 理规范执行。 2、本试剂盒仅用于体外检测,操作人员应经过专业培训并具有一定经验,开始检测前请仔 细阅读本说明书全文。 3、实验请严格分区操作:第一区:PCR 前准备区— 准备扩增所需试剂;第二区:样本处 理区— 待测样本和对照品处理;第三区:检测区— PCR 扩增检测。 4、 试剂盒内各试剂使用前,充分融化后请稍事离心。反应液分装时应尽量避免产生气泡, 上机前注意检查各反应管是否盖紧,以免荧光物质泄露污染仪器。 5、各区物品均为专用,不得交叉使用,避免污染,实验后即请清洁工作台。实验中用过的 吸头请直接打入盛有1%次氯酸钠的废物缸内,并与其他废弃物品一同灭菌后丢弃。扩增完 毕立即取出反应管,密封在专用塑料袋内,丢弃于指定地点。工作台及各物品定期用1%次 氯酸钠、75%酒精或紫外灯进行消毒。 6、储存条件及有效期:本试剂盒于-20℃保存,有效期为 6 个月(请于有效期内使用)。 八、思考题: 1、实时荧光 PCR 检测沙门氏菌的原理? 2、影响检测准确性主要有哪些因素?