
等性杂化与不等性杂化 等性杂化:杂化后所形成的几个杂化轨道 能量相同(通常参与杂化的轨道 都含有单电子或都是空轨道) 不等性杂化:杂化后所形成的几个杂化轨 道能量不完全相同(通常参与 杂化的轨道有的已被孤对电 子占有)
Ø 等性杂化与不等性杂化 等性杂化: 杂化后所形成的几个杂化轨道 能量相同(通常参与杂化的轨道 都含有单电子或都是空轨道) 不等性杂化: 杂化后所形成的几个杂化轨 道能量不完全相同(通常参与 杂化的轨道有的已被孤对电 子占有)
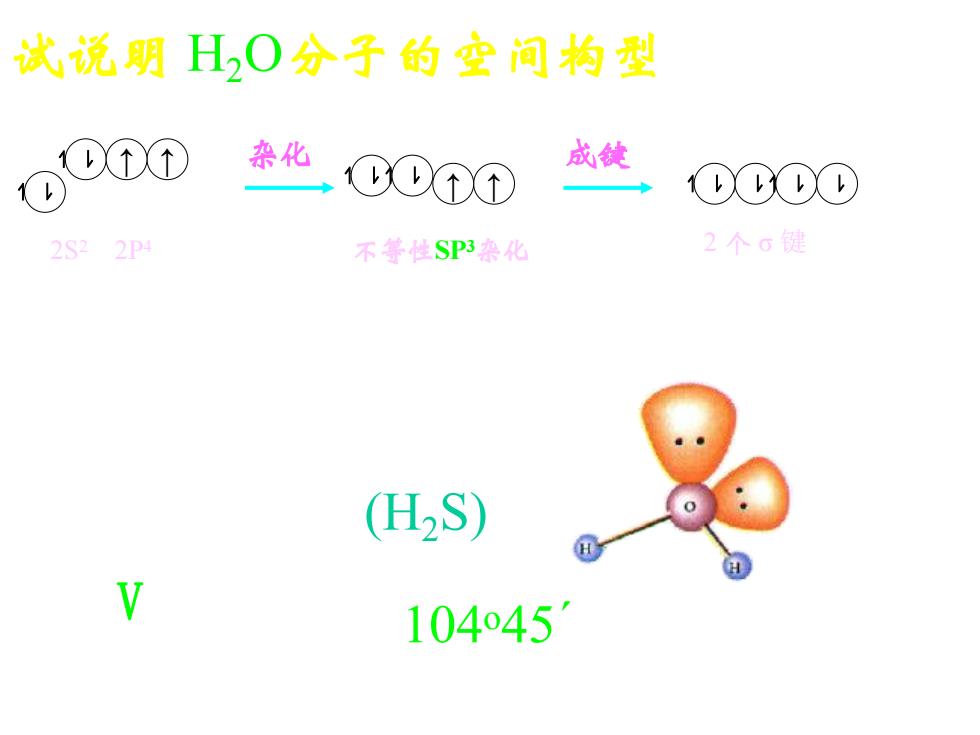
试说明H0分子的空间构型 0onp 杂化 CDT⑦ 成锭 00①0 2S22P 不等性SP3染化 2个G键 (H2S) V 104o451
分子构型: V 型 试说明 H2O分子的空间构型 O原子基态 O原子杂化态 化合态H2O ↿ ⇂ ↿ ⇂ ↑ ↑ 2S2 2P4 杂化 ↿ ⇂ ↿ ⇂ ↑ ↑ ↿ ⇂ ↿ ⇂ ↿ ⇂ ↿ ⇂ 不等性SP3杂化 成键 2 个 σ 键 分子中保留有孤对电子 104 o45´ (H2S)
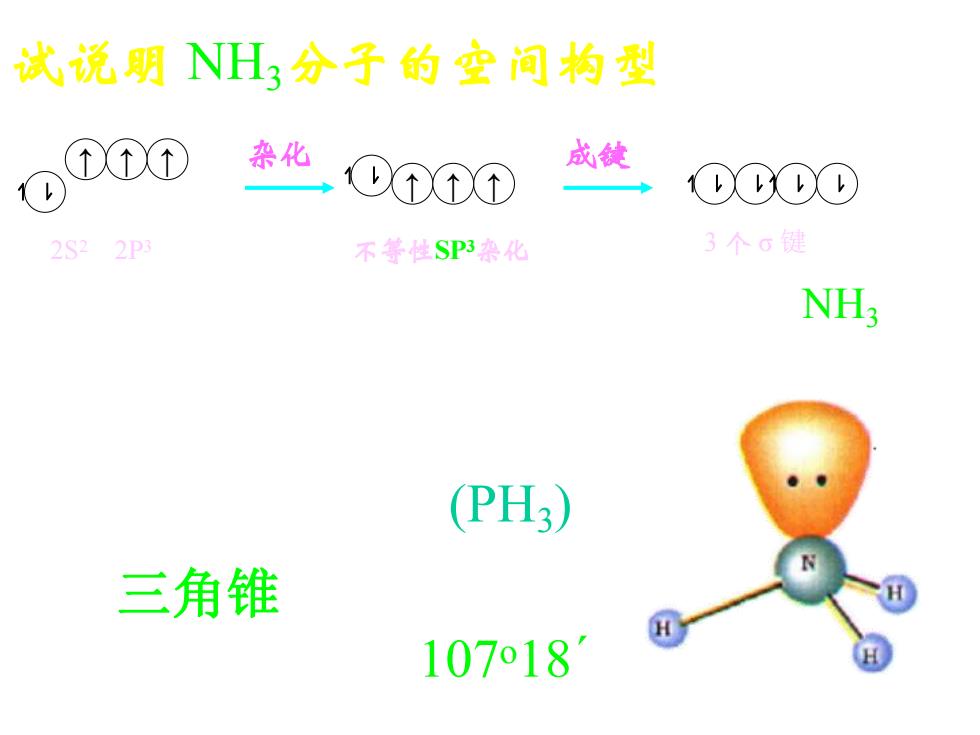
试说明H分子的空间构型 泰化 DTT① 成健 0000 2S22P 不等性SP3染化 3个G键 NH; (PH3) 三角锥 107o18
分子中保留有孤对电子 107 o18´ 试说明 NH3分子的空间构型 N原子基态 N原子杂化态 化合态NH3 ↿ ⇂ ↑ ↑ ↑ 2S2 2P3 杂化 ↿ ⇂ ↑ ↑ ↑ ↿ ⇂ ↿ ⇂ ↿ ⇂ ↿ ⇂ 不等性SP3杂化 成键 3 个 σ 键 分子构型: 三角锥型 (PH3)

5.3分子间作用力 5.3.1键的极性 键的极性是由成键原子的电负性不同引起的 警非极性共价键:成键原子的电负性相同, 正、负电荷重心重合 如:H-H,C1-C1,0-0 警极性共价键:成键原子的电负性不相同, 正、负电荷重心不重合 如:H-CI,H-O△x越大分子极性越强
5.3 分子间作用力 5.3.1键的极性 键的极性是由成键原子的电负性不同引起的 非极性共价键: 成键原子的电负性相同, 正、负电荷重心重合 如: H–H , Cl –Cl , O –O 极性共价键: 成键原子的电负性不相同, 正、负电荷重心不重合 如: H – Cl , H – O ∆χ越大分子极性越强

5.3.2分子的极性 极性分子:正、负电荷重心不重合的分子 非极性分子:正、负电荷重心重合的分子 。分子极性与键的极性的关系 由极性键构成的双原子分子 极性分子 由极性键构成的多原子分子且 空间构型不对称(如:H20) 由非极性键构成的分(如:P) 非极性分子 由极性键构成的多原子分子 且空间构型对称(如:BF)
极性分子 分子极性与键的极性的关系 5.3.2分子的极性 极性分子:正、负电荷重心不重合的分子 非极性分子:正、负电荷重心重合的分子 由极性键构成的双原子分子 由极性键构成的多原子分子且 空间构型不对称 (如:H2O) 非极性分子 由非极性键构成的分(如:P4) 由极性键构成的多原子分子 且空间构型对称(如:BF3)
如: H-H 0=( H-CI 0=C=0 CH H20
如: H-H O=O H-Cl O=C=O CH H2O 4
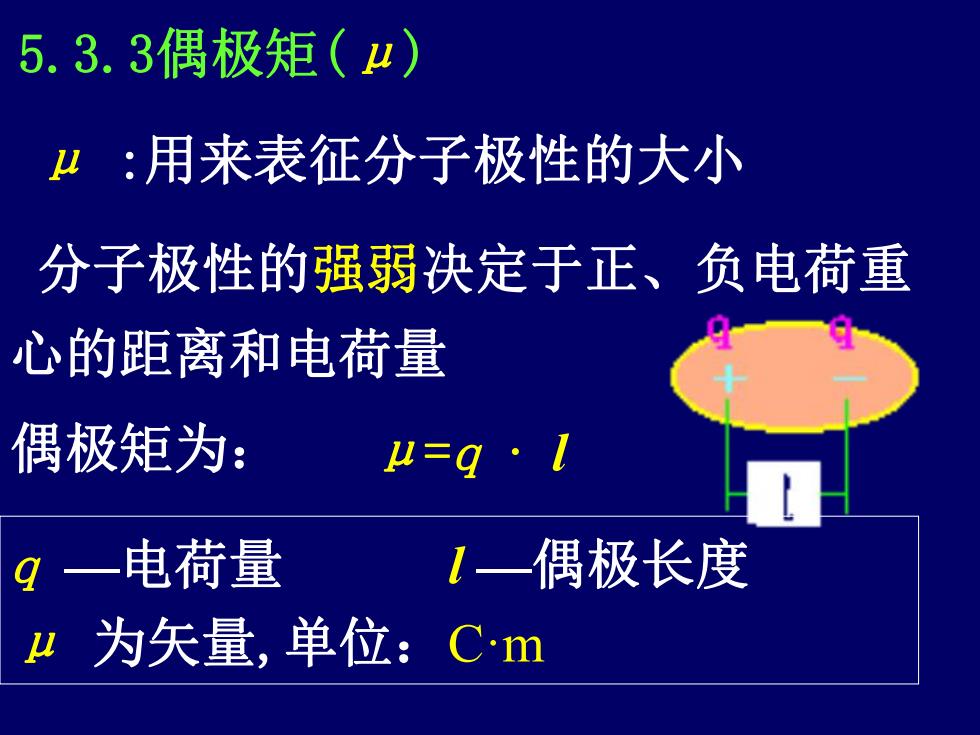
5.3.3偶极矩(4) 4:用来表征分子极性的大小 分子极性的强弱决定于正、负电荷重 心的距离和电荷量 偶极矩为: μ=q·I q一电荷量 1—偶极长度 μ 为矢量,单位:Cm
5.3.3偶极矩(μ) 分子极性的强弱决定于正、负电荷重 心的距离和电荷量 偶极矩为: μ=q · l q —电荷量 l —偶极长度 μ 为矢量,单位:C·m μ :用来表征分子极性的大小

若u=0,表示分子是非极性分子如:CO2 若μ>0,表示分子是极性分子 μ越大,表示分子的极性越大 5.3.4分子的极化 分子间力实质是分子极性间的静电引力, 源于分子的极化。分子极性的变化有三种 情况: 固有偶极:极性分子固有的偶极,与电场无关 μ=q·
若 μ=0,表示分子是非极性分子 固有偶极:极性分子固有的偶极,与电场无关 若μ>0,表示分子是极性分子 μ越大,表示分子的极性越大 如:CO2 μ=q · l 分子间力实质是分子极性间的静电引力, 源于分子的极化。分子极性的变化有三种 情况: 5.3.4 分子的极化
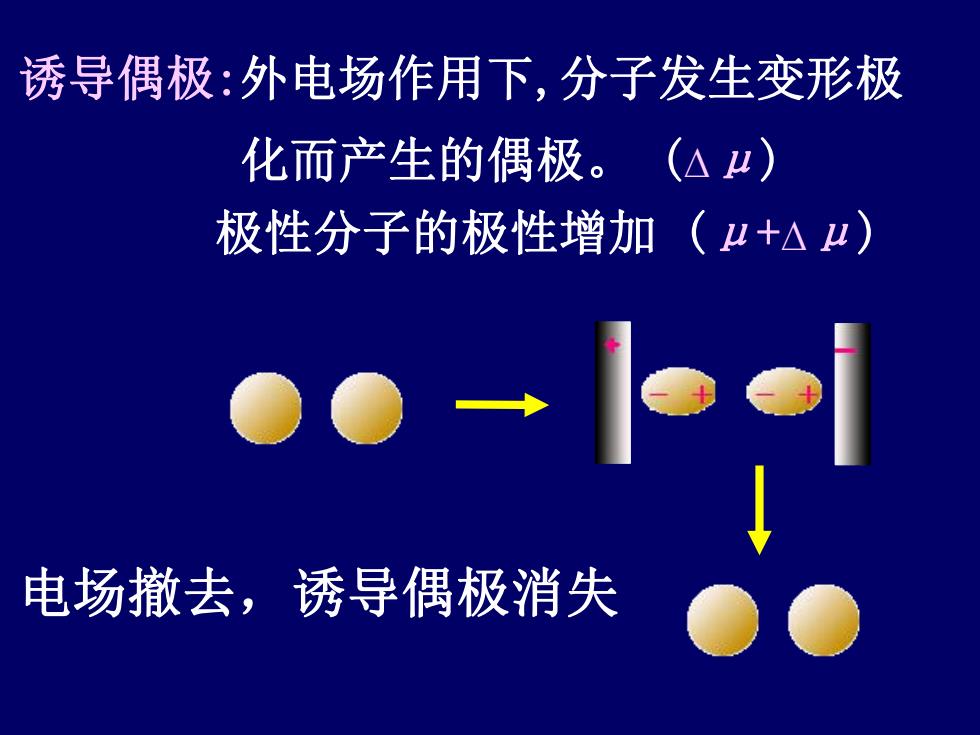
诱导偶极:外电场作用下,分子发生变形极 化而产生的偶极。(△4) 极性分子的极性增加(4+△μ) 电场撤去,诱导偶极消失
电场撤去,诱导偶极消失 诱导偶极:外电场作用下,分子发生变形极 化而产生的偶极。 (∆μ) 极性分子的极性增加 (μ+∆μ)
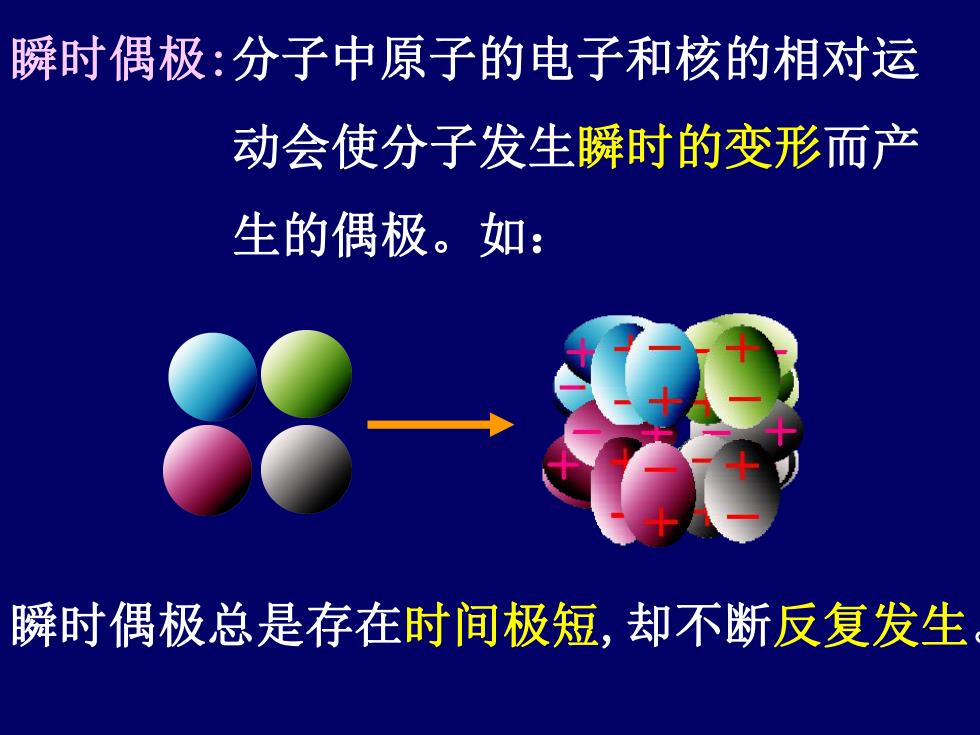
瞬时偶极:分子中原子的电子和核的相对运 动会使分子发生瞬时的变形而产 生的偶极。如: 瞬时偶极总是存在时间极短,却不断反复发生
瞬时偶极:分子中原子的电子和核的相对运 动会使分子发生瞬时的变形而产 生的偶极。如: 瞬时偶极总是存在时间极短,却不断反复发生