
色散力存在于任何分子之间 诱导力存在于极性分子和非极性分子之间 极性分子和极性分子之间 取向力存在于极性分子和极性分子之间 非极性分子之间只存在色散力 极性分子和非极性分子之间存在 诱导力,色散力 极性分子之间存在取向力,诱导力,色散力
色散力存在于任何分子之间 诱导力存在于极性分子和非极性分子之间 极性分子和极性分子之间 取向力存在于极性分子和极性分子之间 非极性分子之间只存在色散力 极性分子和非极性分子之间存在 诱导力,色散力 极性分子之间存在取向力,诱导力,色散力

三种力的比例不同,色散力是主要的,存在 于一切分子之间。其强度与分子的大小有关, 随分子量的增大而增大。如: 卤素分子F2,C2,Br2,2之间只存在着色 散力,色散力随相对分子量的增大而增大, 因此它们的熔点和沸点也随相对分子量的 的增大而升高。 稀有气体的沸点从He到Xe递增的原因 也如此
三种力的比例不同,色散力是主要的,存在 于一切分子之间。其强度与分子的大小有关, 随分子量的增大而增大。如: 卤素分子 F2 , Cl2 , Br2 , I2之间只存在着色 散力,色散力随相对分子量的增大而增大, 因此它们的熔点和沸点也随相对分子量的 的增大而升高。 稀有气体的沸点从He到Xe递增的原因 也如此

5.3.5分子间力的特征 。是弱作用力:比化学键小1-2个数量级。 如:H20中,分子间力47.28kJmo1 而E(OH)=463kJmo-1 是近距离力:在300pm-500pm间有 效,而且与成反比。 无方向性和饱和性
5.3.5分子间力的特征 是弱作用力:比化学键小1-2个数量级。 如:H2O中,分子间力47.28kJ .mol-1 而E(OH)=463kJ .mol-1 无方向性和饱和性。 是近距离力: 在300pm-500pm间有 效,而且与r7成反比

5.4氖键 5.4.1氢键的形成 H与电负性大、半径小的原子(X)形成 共价键时,H几乎成为裸露的质子;H能与 有孤对电子、电负性大、半径小的元素 (Y)产生静电作用,从而形成氢键。 X-HY X、Y可是相同元素,也可是不同元素
5.4 氢 键 H与电负性大、半径小的原子(X)形成 共价键时,H几乎成为裸露的质子;H能与 有孤对电子、电负性大、半径小的元素 (Y)产生静电作用,从而形成氢键。 X-H……Y 5.4.1 氢键的形成 X 、 Y可是相同元素,也可是不同元素

形成条件:X、Y:电负性大、半径小 Y:有孤对电子 X、Y:F、O、N等 氢键的类型: 分子间氢键:一个分子的X-H键与另一 个分子的Y之间形成的氢键 分子内氢键:一个分子内部XH与Y形成 的氢键
形成条件: X 、 Y: 电负性大、半径小 Y: 有孤对电子 X 、 Y: F、O、N 等 氢键的类型: 分子间氢键: 一个分子的X-H键与另一 个分子的Y之间形成的氢键 分子内氢键:一个分子内部X-H与Y形成 的氢键
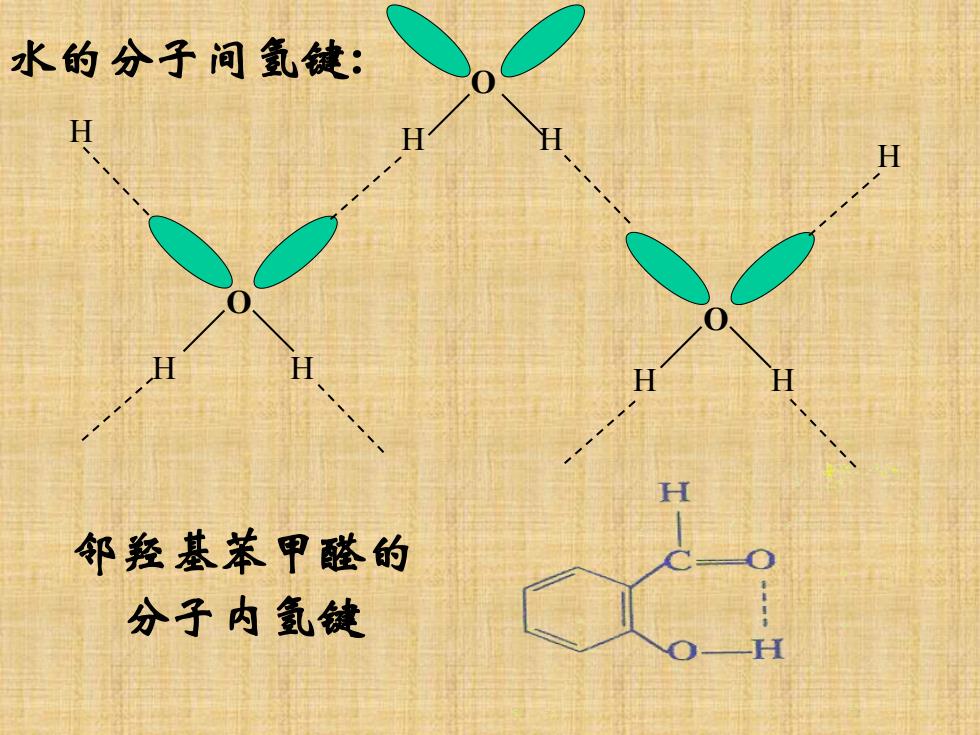
水的分子间氢键: 邻羟基苯甲醛的 分子内氢键
H H O H H O H H O H H 水的分子间氢键: 邻羟基苯甲醛的 分子内氢键

冰弹现象证明了冰的体积比同质量液体水的体积 大这个事实。在金属弹壳里放入一些冷水,然后 把塞子拧紧。把冰弹放进-77℃的干冰丙酮里,水 马上结成冰,冰弹爆炸 t-inm
冰弹现象证明了冰的体积比同质量液体水的体积 大这个事实。在金属弹壳里放 入一些冷水,然后 把塞子拧紧。把冰弹放进-77℃的干冰丙酮里,水 马上结成冰,冰弹爆炸

5.4.2氢键的特征 弱作用力:属分子间力;键能小于42 kJmol-1,比范德华力略强些。 有方向性:分子间氢键中X-HY在同 条直线上 有饱和性:每个X-H中的H只能与一 个Y原子形成氢键
弱作用力:属分子间力;键能小于42 kJ .mol-1 ,比范德华力略强些。 有饱和性: 每个X-H 中的H 只能与一 个Y原子形成氢键 5.4.2 氢键的特征 有方向性:分子间氢键中X-H……Y在同 一条直线上

5.4.3氢键对物质性质的影响 兼 对物质熔、沸点的影响 与同类化合物相比: 形成分子间氢键的物质,熔、沸点升高 如:NH3,H20,HF的沸点比同族元素氢化物 的沸点高 形成分子内氢键的物质,熔、沸点降低 如:邻硝基苯酚的熔点比对硝基苯酚的熔 点低
5.4.3 氢键对物质性质的影响 与同类化合物相比: 形成分子间氢键的物质,熔、沸点升高 如:NH3 ,H2O,HF的沸点比同族元素氢化物 的沸点高 对物质熔、沸点的影响 形成分子内氢键的物质,熔、沸点降低 如:邻硝基苯酚的熔点比对硝基苯酚的熔 点低

对物质溶解度的影响 溶剂和溶质之间形成分子间氢键, 使溶质的溶解度增大 如:对硝基苯酚在水中溶解度大 ·溶质分子形成分子内氢键时: 在极性溶剂中溶解度小; 在非极性溶剂中溶解度大, 如:邻硝基苯酚在水中溶解度小,在苯中 溶解度大
对物质溶解度的影响 溶剂和溶质之间形成分子间氢键, 使溶质的溶解度增大 如:对硝基苯酚在水中溶解度大. 溶质分子形成分子内氢键时: 在极性溶剂中溶解度小; 在非极性溶剂中溶解度大. 如:邻硝基苯酚在水中溶解度小,在苯中 溶解度大